基于LC-MS/MS技术分析中药瓦楞子中发挥免疫调节活性的蛋白质类成分
石 慧,李春磊,曾展灏,李欣玥,赵瑞琪,朱建华,于荣敏*
(1. 暨南大学 药学院,广东 广州 510632;2. 暨南大学 中药生物技术研究所,广东 广州 510632)
瓦楞子是传统中药,首载于汉代《名医别录》,在历代经典中医典籍中皆有收载。中国药典收载的瓦楞子有3种基源:蚶科动物毛蚶(Arca subcrenataLischke)、泥蚶(Arca granosaLinnaeus)魁蚶(Arca inflataReeve)的贝壳。作为一种常用海洋贝类中药,瓦楞子具有消痰化瘀、软坚散结、制酸止痛之功效[1]。中医临床常用于治疗顽痰胶结、黏稠难咯、瘿瘤、瘰疬、症瘕痞块、胃痛泛酸等症。瓦楞子临床功效确切,应用广泛,但对其药效物质基础的研究较少。有研究表明,瓦楞子等贝类中药富含层状和柱状方解石,其主要成分为碳酸钙[2]。口服碳酸钙具有中和胃酸的治疗效果,符合瓦楞子“制酸止痛”的功效和胃痛泛酸的主治症状。因此认为瓦楞子的药效物质基础为碳酸钙。然而,瓦楞子除制酸止痛外,还具有消痰化瘀、软坚散结等其它临床功效,提示瓦楞子的药效物质基础包括但不限于碳酸钙[2-3]。现有针对瓦楞子的药效物质研究存在较大的局限和空缺,仍有活性成分亟需挖掘。
近年,随着现代生化技术、分子生物学技术和蛋白质组学分析技术的发展,从海洋贝壳中发现了多种具有生物活性的肽和蛋白质类成分[4-9]。研究发现,这些成分与贝类生物自身的生物矿化、免疫应答和环境适应有密切联系。贝壳中的基质蛋白可通过促进或抑制方解石和文石的结晶化以及调节其结构形态,参与贝类的生物矿化过程[4]。此外,有报道显示,为应对微生物侵袭,贝壳中多种蛋白成分过量表达,发挥抗菌和免疫调节作用。目前已从截海螂(Mya truncata)、太平洋牡蛎(Crassostrea gigas)和栉孔扇贝(Chlamys farreri)的贝壳中发现了多种具有抗菌、免疫调节等功能的蛋白酶,其在维持贝类自身防御、体液平衡方面发挥了重要作用[5]。研究人员还通过煎煮和离子交换层析方法从牡蛎贝壳中提取出一种抗氧化寡肽,其对1,1-二苯基-2-三硝基苯肼(DPPH)自由基、超氧阴离子自由基具有较强的清除能力[10]。研究通过对贻贝(Perna viridis)进行蛋白组学鉴定分析,从中发现其含有378种贝壳基质蛋白,聚类分析表明:贝类壳蛋白具有免疫调节等多种生物活性,具有潜在的药用开发价值[11]。最近,从瓦楞子基源动物毛蚶的贝壳中分离得到2个活性肽AWLNH和PHDL,其能刺激成骨细胞分化,缓解骨质疏松[12]。
本研究采用水煎煮和乙酸两种提取方法从海洋中药瓦楞子中提取免疫调节活性组分;同时在前期构建的瓦楞子转录组数据库基础上,运用胰蛋白酶酶解和LC-MS/MS技术对瓦楞子免疫调节活性组分中蛋白质类成分进行鉴定分析,以明确瓦楞子中发挥免疫调节作用的物质基础,为进一步研究和开发海洋中药瓦楞子奠定基础,为其临床合理应用提供科学资料。
1 仪器与材料
1.1 仪器
DYY-2C型稳压稳流电泳仪(北京六一生物科技有限公司),DYY-2C型配套垂直电泳槽(北京六一生物科技有限公司),GelDoc XR型凝胶成像仪(美国Bio-Rad生物科技公司),DS-1型高速组织捣碎机(上海精科科学仪器公司),CR21G型冷冻离心机(日本日立有限公司),DF-101S型集热式磁力搅拌器(巩义予华仪器公司),FD-1D-50型真空冷冻干燥机(北京博医康仪器有限公司),6500TC型二氧化碳培养箱(日本NAPCO公司),SW-CJ-1F型单人双面净化工作台(苏州净化有限公司),Synergy H4型全功能酶标仪(美国Bio-Tek有限公司),Triple TOF 5600质谱仪(美国Applied Biosystem仪器公司),Eksigent micro-LC 415 System液相色谱系统(美国AB SCIEX公司)。
1.2 材料
实验样品中药饮片瓦楞子(广东省药材公司中药饮片厂),鼠源巨噬细胞RAW264.7(中山大学医学院细胞库)。
Trypsin蛋白酶(美国Promega生物科技公司),一氧化氮检测试剂盒、BCA蛋白定量试剂盒(上海碧云天生物科技公司),高pH RP肽段分级试剂盒(美国Thermo Fisher生物科技公司),色谱纯乙腈(美国TEDIA高纯试剂公司),其余化学试剂购自广州化学试剂厂,均为分析纯。
2 方法
2.1 活性组分WLZP-1和WLZP-2的制备
活性组分WLZP-1的制备:取净制后的中药瓦楞子饮片加入等倍体积(w/v)去离子水,沸水浴加热30 min,收集煎煮后的液体。再次加入等倍体积(w/v)去离子水,继续煎煮30 min,收集煎煮后的液体。合并两次煎煮液,10000 r/min离心20 min,得上清。上清再用去离子水进行透析除盐(分子量截留值 1 kDa),冷冻干燥后即得WLZP-1组分。
活性组分WLZP-2的制备:取过40目筛瓦楞子粉末加入2倍体积(w/v)去离子水浸泡2 h,去掉去离子水。加入2倍体积(w/v)50 %乙酸4 ℃浸泡过夜,收集液体。再次加入2倍体积(w/v)50 %乙酸4 ℃浸泡过夜,收集液体。与第一次收集液体合并,10000 r/min离心20 min,得上清。所得上清在去离子水中进行透析除盐(分子量截留值 1 kDa),冷冻干燥后即得WLZP-2组分。
采用BCA蛋白定量试剂盒进行蛋白定量,牛血清蛋白为标准品,操作方法参考试剂盒说明书。采用苯酚-硫酸法测定WLZP-1和WLZP-2组分的总糖含量,葡萄糖为标准品。
采用12 %分离胶和4 %浓缩胶对WLZP-1和WLZP-2组分进行还原型聚丙烯酰胺凝胶电泳(SDS-PAGE)分析。
2.2 WLZP-1和WLZP-2免疫调节活性测定
采用噻唑蓝法(MTT法)考察WLZP-1和WLZP-2对RAW264.7巨噬细胞的影响。将处于对数生长期的RAW264.7细胞(贴壁细胞需用胰酶消化)用完全培养基吹打成细胞悬液,调整细胞浓度为3×104个/ml。将细胞悬液接种于96孔细胞培养板上,每孔100 µl,培养板置于37 °C的CO2培养箱中培养24 h。细胞贴壁后,将用培养液稀释成不同浓度的样品加入96孔板中,设置5个样品浓度组,每个浓度设3个平行孔,以不加样品的培养液孔为阴性对照组。在细胞培养箱中继续培养48 h后,每孔加入20 μl MTT溶液(浓度为5 mg/ml)。在细胞培养箱中继续培养4 h后,弃上清,每孔加入100 μl DMSO溶液,室温放置30 min。酶标仪上以570 nm测吸光度(A)值,以1 μg/ml的脂多糖(LPS)为阳性对照。
生长抑制率计算公式:

将处于对数生长期的RAW264.7细胞悬浮于DMEM培养基中并调整细胞密度为1 × 105个/ml。将细胞悬液接种于96孔板,每孔100 μl,每组3个复孔。将96孔板置于细胞培养箱中培养12 h(37 ℃,5 % CO2)使细胞贴壁。随后弃去上清,加入一系列梯度浓度的样品溶液使每组孔中的终浓度分别为0,31.25,62.5,125,250及500 μg/ml)。同时选择1 μg/ml的LPS溶液作为阳性对照。继续将96孔板置于细胞培养箱中培养24 h(37 ℃,5 % CO2)。根据NO检测试剂盒操作手册,测定细胞培养上清中的NO含量。
2.3 WLZP-1和WLZP-2酶解分离及质谱检测
于WLZP-1和WLZP-2组分中分别加入100 μl预冷丙酮溶液,于-20 ℃冷柜过夜沉淀蛋白多肽。蛋白多肽沉淀用含蛋白酶抑制剂的8 mol/L尿素溶解,冰上保温30 min后离心。之后加入1 mol/L三乙基碳酸氢铵(TEAB)溶液和10 mmol/L三-(2-羧乙基)膦(TCEP)溶液,37 ℃下反应1 h。加入40 mmol/L 碘乙酰胺(iodoacetamide)避光继续反应40 min。丙酮沉淀蛋白多肽后,蛋白多肽沉淀加入胰蛋白酶酶解液于37 °C酶解过夜。酶解后的多肽产物用高pH肽段分级试剂盒进行分段,真空离心浓缩后,用质谱上样缓冲液溶解,进行液-质联用分析。每段馏分经Eksigent 3C18-CL-120色谱柱和Eksigent micro-LC 415液相系统进行肽段分离。液相系统设置参数如下:流动相A为2 %乙腈(含0.1 %甲酸),流动相B为98 %乙腈(含0.1 %甲酸),流速5 μl/min,洗脱梯度为0~1 min,2 %~5 %B;1~65 min,5 %~20 %;65~80 min,20 %~25 %;80~90 min,25 %~80 %。质谱设定参数如下:MS扫描范围(m/z)350~1250,累积时间0.25 s;MS/MS扫描模式为HS高灵敏度模式,扫描范围(m/z)100~1500,累积时间0.05 s,IDA采集模式,一个MS1图谱选择40个最强的母离子进行串级扫描[14]。
2.4 数据分析及蛋白多肽鉴定
基于瓦楞子转录组测序ORF的蛋白序列库进行蛋白组分鉴定。使用软件PEAKS Studio 8进行质谱原始数据比对搜库,搜索参数:Enzyme Name:Trypsin;Max. Missed Cleavage Sites: 2;Cys alkylation: Iodoacetamide;ynamic Modification:Oxidation (M), Acetyl (Protein N-Terminus);Precursor Mass Tolorance: 20 ppm;Fragment Mass Tolorance: 0.1 Da;Peptide FDR ≤0.01。利用GO(geneontology)、KEGG(kyoto encyclopedia of genesand genomes orthology)数据库对鉴定的蛋白质类成分进行注释分析。
3 结果
3.1 活性组分WLZP-1和WLZP-2的电泳表征及免疫调节活性
瓦楞子采用水煎煮和乙酸两种提取方法分别得到WLZP-1和WLZP-2组分,苯酚-硫酸法分析和BCA蛋白定量结果表明表明WLZP-1和WLZP-2两组分均不含糖,蛋白多肽含量分别为60 %和19.03 %。
SDS-PAGE分析结果见图1。WLZP-1组分条带弥散分布且条带颜色浅,提示该组分中蛋白质类成分种类多,且各蛋白质类成分丰度低;WLZP-2组分在35 kDa处有明显条带,说明此分子量蛋白丰度较高;此外有多个弥散条带,说明该组分成分复杂。因WLZP-1和WLZP-2组分蛋白质类成分复杂,难以使用分离技术获得全部蛋白多肽化合物,本研究运用蛋白组学联合转录组学技术分析瓦楞子活性组分中蛋白质多肽成分。

图1 WLZP-1和WLZP-2组分的SDS-PAGE图
利用鼠源巨噬细胞RAW264.7细胞进行免疫调节活性测试,结果见图2。WLZP-1和WLZP-2组分对RAW264.7细胞无明显毒性。WLZP-1和WLZP-2组分均能明显促进RAW264.7细胞分泌NO,具有较好的体外免疫增强活性。此外,WLZP-1组分促进NO释放活性强于WLZP-2组分,提示WLZP-1组分的蛋白多肽成分可能与WLZP-2组分不同,特异性存在于WLZP-1组分中的蛋白多肽成分体外免疫增强活性可能更优。

图2 WLZP-1和WLZP-2组分免疫调节活性
3.2 蛋白质类成分的质谱鉴定
运用胰酶酶解和LC-MS/MS对WLZP-1和WLZP-2组分中蛋白质类成分进行鉴定,分别得到26583和15613个质谱图谱数据。将瓦楞子蛋白预测库模拟胰酶酶切,将所得肽段构建标准质谱图谱,运用PEAKS Studio 8软件将实测质谱图谱与标准图谱比对。在假发现率FDR≤1 %时,WLZP-1组分比对得到图谱3890个,鉴定特征肽段2380个,最终鉴定得到276个蛋白质类成分;WLZP-2组分比对得到图谱2460个,鉴定特征肽段2040个,最终鉴定得到175个蛋白质类成分(表1)。通过Venn图分析(图3),WLZP-1和WLZP-2活性组分中仅有17个相同蛋白质类成分。将上述蛋白质的氨基酸序列在NCBI数据库中BLAST比对,结果见表2。这17种蛋白质包括类Actin蛋白、类β-Actin蛋白、类dynactin蛋白、CYP4B1、类丝氨酸/苏氨酸蛋白激酶3蛋白、类烟酰胺N-甲基转移酶、类组蛋白赖氨酸N-甲基转移酶蛋白、类胱硫醚β裂解酶、CEP290、类titin X1亚型和没有特征性的新蛋白。将鉴定得到的蛋白质类成分进行GO和KEGG注释分析。GO注释有助于了解蛋白质类成分所代表的生物学意义,利用GO数据库,将鉴定得到的蛋白多肽按照其细胞组分(cellular component,CC)、分子功能(molecular function, MF)和参与的生物过程(biological process, BP)进行分类注释。结果见表1、图4和图5。WLZP-1和WLZP-2组分中蛋白质类成分分别包含有BP、CC和MF等3类。
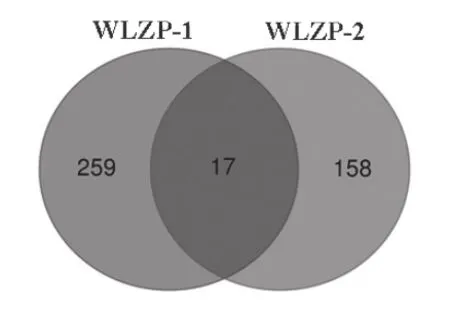
图3 WLZP-1和WLZP-2蛋白多肽成分Venn图

表1 WLZP-1和WLZP-2组分搜库结果及GO注释分析列表/个

图4 WLZP-1蛋白多肽成分GO注释二级分类统计图

图5 WLZP-2蛋白多肽成分GO注释二级分类统计图

表2 WLZP-1和WLZP-2组分共有蛋白的氨基酸序列和注释

表2(续)
通过KEGG注释分析发现,WLZP-1组分有8个蛋白质类成分能参与人源免疫系统,有18个蛋白质类成分具有信号传导功能,进而通过信号转导通路发挥调节人体免疫的作用(图6)。WLZP-2组分中有7个蛋白质类成分能参与人源免疫系统,另有15个蛋白质类成分具有信号传导功能(图7)。这可能是WLZP-1和WLZP-2活性组分发挥免疫调节作用的物质基础。

图6 WLZP-1蛋白多肽成分KEGG注释统计图

图7 WLZP-2蛋白多肽成分KEGG注释统计图
4 讨论
近年,随着对贝壳来源蛋白质类成分研究的不断深入,越来越多的贝壳活性蛋白质类成分被发现并报道。此类发现为研究海洋贝类中药药效物质基础提供了一个全新角度。海洋中药瓦楞子是双壳纲蚶科贝类的贝壳,在中医临床应用广泛。然而,其活性物质相关的研究鲜有报道,这在一定程度上限制了瓦楞子的临床合理使用和深入研究开发。
本研究使用不同提取方法分别获得了水溶性蛋白质类组分WLZP-1和酸溶性蛋白质类组分WLZP-2。从WLZP-1组分中鉴定得到276个蛋白质类成分,在WLZP-2组分中鉴定得到175个蛋白质类成分。然而,WLZP-1和WLZP-2的电泳图谱显示,相同上样量时,WLZP-1组分蛋白多肽条带浅、少且弥散,WLZP-2组分蛋白条带丰富且明显。上述结果提示,WLZP-1组分中各蛋白质类成分丰度低,而WLZP-2组分中的蛋白成分大多数为高丰度蛋白。因此,我们推测,瓦楞子中酸溶性蛋白多肽(碱性蛋白多肽)成分多为高丰度蛋白多肽,而水溶性蛋白多肽(中性蛋白多肽)为低丰度蛋白多肽。
在瓦楞子体外免疫活性实验中,我们发现WLZP-1和WLZP-2活性组分对小鼠RAW264.7巨噬细胞均无明显的细胞毒性,并可显著刺激RAW264.7细胞分泌促炎因子NO,发挥免疫增强作用,其中WLZP-1组分的活性优于WLZP-2。此结果表明,相比于酸溶性蛋白多肽,瓦楞子中水溶性蛋白多肽成分可能为其发挥免疫调节活性的物质基础。我们进一步使用GO和KEGG数据库对瓦楞子活性蛋白质类成分进行了功能注释分析。WLZP-1和WLZP-2活性组分中均包含具有生物过程、细胞组分和分子功能的蛋白质类成分。此外,WLZP-1和WLZP-2活性组分均含有多种与人源免疫系统及信号传导途径相关的蛋白质类成分,这些成分也有助于瓦楞子发挥免疫调节作用。
不同物种的贝壳蛋白质类成分发挥不同的生物活性[14]。目前人们对海洋贝壳来源蛋白质类成分及其生物活性了解甚少,限制了海洋贝类生物资源的研究开发和利用,同时也制约了海洋贝类中药的守正创新。因此,加强贝壳来源蛋白质类成分的鉴定将为海洋贝类中药的合理应用和深入开发提供新的思路和化学结构,为海洋中药综合利用开拓新的方向。本研究结果为进一步挖掘瓦楞子药效物质提供了科学依据,为探索其免疫调节活性物质基础指引了方向,同时也为海洋贝类中药药效物质基础研究提供了参考资料。

