玉米miR395基因家族生物信息学分析及靶基因预测
王 丽,路运才
(1黑龙江大学现代农业与生态环境学院,哈尔滨 150080;2黑龙江省肇东市农业技术推广中心,黑龙江肇东 151100)
0 引言
MicroRNA(miRNA)是 由 20~22 个 核 苷 酸(nucleotide,nt)组成的非编码RNA,较早在秀丽隐杆线虫中发现[1],在植物和动物的发育过程中具有沉默靶基因和负调控基因表达的作用[2-3]。在拟南芥中,miR159和miR172分别参与控制叶形态和花发育[4,5]。miRNA基因具有茎环结构,通常位于前体的茎区域。在植物中,miRNA前体通常为60至上百个nt不等[6]。成熟miRNA由其前体经DCL1(Dicer-like1)酶2次切割形成。miRNA与RNA诱导的沉默复合物(RNA-induced silencing complex,RISC)结合,并通过相同配对位点切割靶mRNA或在miRNA错配时抑制蛋白翻译,从而指导转录后调控过程[7]。
资料表明,microRNA在植物响应环境胁迫方面具有重要调节作用。一些microRNAs已被鉴定响应水稻、小麦、豆类、番茄等非生物胁迫[8-10]。在植物miRNA基因家族中,miR395基因家族较特别,该家族成员在不同物种中形成大小的簇。正常条件下,在拟南芥中无法检测到miR395转录物,但在低硫酸盐胁迫下可被诱导[11]。根据数据库检索显示,miR395与其他几种植物的硫酰化酶mRNA匹配,包括水稻、玉米、芸苔属和葱属,这表明miR395硫酰化酶配对在许多植物基因组中是保守的[12]。在拟南芥,6个miR395基因具有较高的序列相似性,分成两组串联复制[13]。与拟南芥含有6个成员相比,该基因家族在水稻中显著扩大,包括24个成员,在1 kb的范围内存在7个基因[14],表现出清晰的串联和分段重复[15],24个水稻miR395基因形成4个紧凑的簇,每个簇均可转录为一个转录本[16-17]。
此外,miR395还以3种ATP硫酰化酶(APS1、APS3和APS4)和一种低亲和力的硫酸盐转运蛋白(SULTR2)为靶点,两者都参与了植物硫酸盐代谢途径。硫酸盐同化过程的第一步是ATP硫酸化酶催化无机硫酸盐和ATP结合,形成5′-磷酸腺苷(APS)和无机焦磷酸盐。随后,APS被两种不同的硫酸盐同化途径利用。一方面,APS通过使用ATP的APS激酶进一步磷酸化APS,从而导致形成3′-磷酸腺苷5′-磷酸硫酸盐(PAPS),这是用于植物大分子硫酸化的高能SO42-供体。另一方面,APS被腺苷5′-磷酰硫酸还原酶(APR)还原为亚硫酸盐后被进一步还原,然后掺入O-乙酰丝氨酸(OAS)的氨基酸骨架中[18]。有报道称,miR395是由硫酸盐缺乏或重金属胁迫诱导的,而这种诱导对植物的硫酸盐稳态和氧化应激反应起着至关重要的作用[19-20]。已经证实在低硫酸盐期间,miR395在转录后水平上调控了3个APS基因,低硫酸盐对APS1,APS3和APS4有不同的调节作用[21-22]。
本研究采用生物信息学方法,对玉米中16个miR395前体序列、成熟序列、序列保守性、折叠结构、染色体位置进行分析,对前体序列的顺式作用元件及靶基因进行预测,并对zma-miR395基因表达模式进行分析,旨在为解析该家族基因的生物学功能提供依据。
1 材料与方法
1.1 zma-miR395基因家族序列的获得
从miRNA数据库miRBase(http://www.miRbase.org)中下载整理玉米所有miR395基因家族的前体序列、成熟miRNA序列及其相关信息。
1.2 zma-miR395基因定位
采用NCBI数据库相似性搜索工具BLAST(http://blast.ncbi.nlm.nih.gov/Blast.cgi)进行比对,基因定位使用MapChart软件进行zma-miR395基因的染色体位置绘制。使用2个标准确认基因重复:(a)较短的比对序列覆盖了较长序列长度的>70%;(b)中比对的序列的相似性为>70%[23]。位于同一染色体片段中小于100 kb且被5个或更少的基因分隔的2个基因被鉴定为串联重复基因[24]。通过搜索植物基因组复制数据库可以确认重复的zma-miR395基因片段[25]。
1.3 zma-miR395基因家族多序列比对与系统发育分析
利用ClustalW(https://www.genome.jp/tools-bin/clustalw)在线软件对所收集到的所有zma-miR395序列进行多序列比对。采用WebLogo(https://weblogo.berkeley.edu/logo.cgi)在线软件,绘制序列logo图,分析基因保守程度。另外将结果输入MEGA7.0软件中,构建zma-miR395系统发育树,重复抽样数设为1000。
1.4 zma-miR395基因顺式作用原件分析
利用Plant CARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)对基因上游200 bp的启动子区域进行分析。
1.5 前体二级结构分析
利用The mfold Web Server(http://unafold.rna.albany.edu/?q=mfold)中的RNA Folding Form在线预测zma-miR395家族成员前体的二级结构,默认系统参数值。
1.6 zma-miR395基因家族的靶基因预测
使用在线靶位点分析软件psRNATarget(https://bio.tools/psrnatarget)预测zma-miR395的靶基因。
1.7 zma-miR395基因家族表达模式分析
在PmiREN数据库中获得zma-miR395基因家族16个成员不同组织中的表达量数据。
2 结果与分析
2.1 zma-miR395基因定位
从miRBase数据库中共获得16个zma-miR395基因,这些基因分别分布在Chr2和Chr10这2条染色体上。如图1所示,从染色体上基因分布的数量来看,染色体Chr2上分布1个簇,有9个成员(zma-miR395d,zma-miR395f,zma-miR395g,zma-miR395e,zma-miR395i,zma-miR395h,zma-miR395b,zma-miR395a,zma-miR395j),染色体Chr10上分布2个簇,第一个簇有 4 个 成 员 (zma-miR395k,zma-miR395l,zmamiR395m,zma-miR395c),第二个簇只有3个成员(zmamiR395n,zma-miR395o,zma-miR395p)。

图1 zma-miR395基因位置
2.2 zma-miR395基因家族多序列比对与系统发育分析
zma-miR395基因家族的前体序列长度为70~234nt,成熟序列长度为20~23 nt。将zma-miR395家族的前体序列进行比对,结果显示zma-miR395在产生成熟序列的区域碱基高度保守,有些位置上的碱基甚至完全相同(图2)。将16个zma-miR395的序列进行比对,结果显示(表1)zma-miR395的碱基高度保守,有19个碱基甚至完全相同。这可能暗示zma-miR395功能的单一性。

表1 成熟zma-miR395多序列比对结果
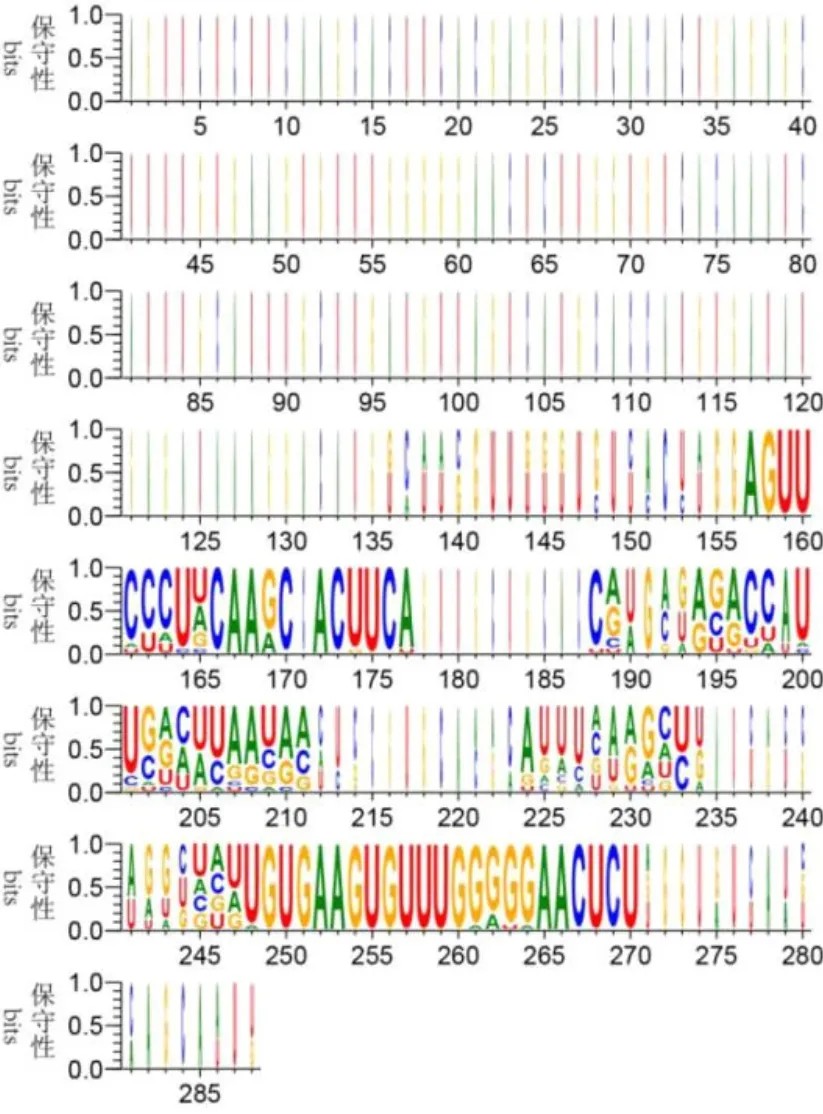
图2 前体序列的碱基位置
2.3 zma-miR395系统发育进化树
根据图3可知,两株进化树均分为3枝,A图构建的前体进化树每分枝数量相近,不同分支之间的分化程度有差异,位于同一条染色体上的zma-miR395前体基因并没有位于同一分支,表现出更近的亲缘关系。例如,图A染色体Chr10上第二个簇3个成员(zmamiR395n,zma-miR395o,zma-miR395p)位于2个不同的分支中。此外,B图构建的成熟体进化树中成熟体的分类情况更为特别,3’端的成熟体在同一分区内,而5’端的成熟体却分为两类,zma-miR395d-5p和zmamiR395g-5p单独分离出来,推测可能是存在特殊的进化机制。

续表1
2.4 zma-miR395基因顺式作用原件分析
运用PlantCARE对上述zma-miR395启动子序列上的胁迫相关元件进行分析,结果见表2。zmamiR395基因家族上游启动子元件有12类,包括脱落酸响应元件、生长素响应元件、干旱响应元件、光响应元件等。其中数量最多的ABRE类元件,主要调节ABA信号传导。其次是MYB元件、AC-II元件和STRE元件,MYB元件是植物最大的转录因子家族之一,广泛参与植物代谢调控,功能十分多样;AC-II元件参与木质部特异性表达;STRE元件与植物非生物胁迫相应相关。G-box元件主要参与调节植物的光反应,其他元件的数量相对较少。
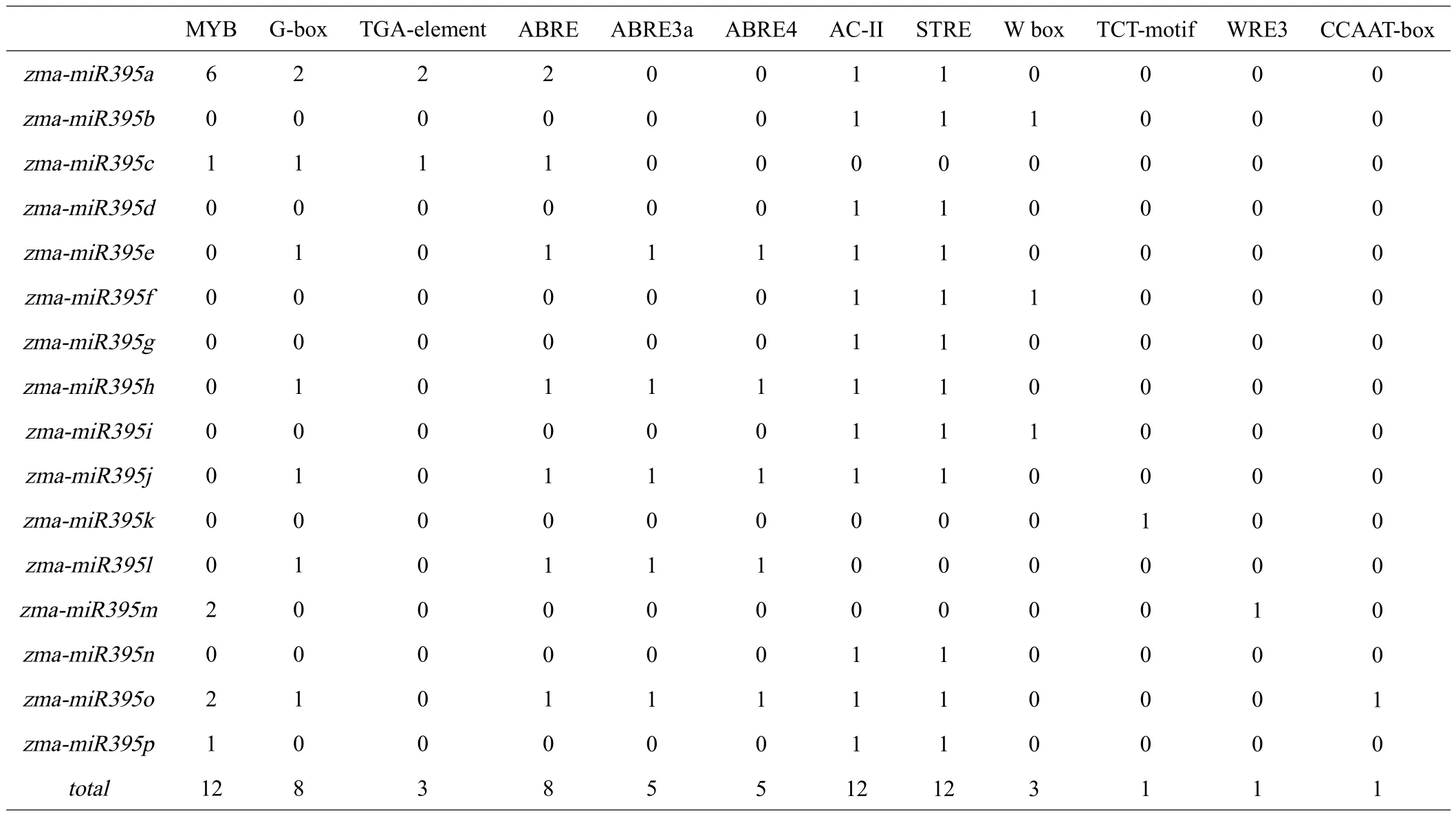
表2 zma-miR395基因顺式作用原件
2.5 前体二级结构分析
由二级结构预测分析和成熟体定位分析(图4)可知,zma-miR395前体二级结构为十分典型的发卡状结构。最小折叠自由能为-28.00 kcal/mol。其中大量碱基均能互补配对,miR395前体序列原本5’和3’两端A-U碱基结合形成稳定氢键,前体中间成环,2个成熟体产生于靠近5’端的位置。提示了该结构可能提高了其在遗传进化过程中的稳定性,发挥了重要的作用,从而不易造成碱基的缺失,也佐证了其遗传的保守性。

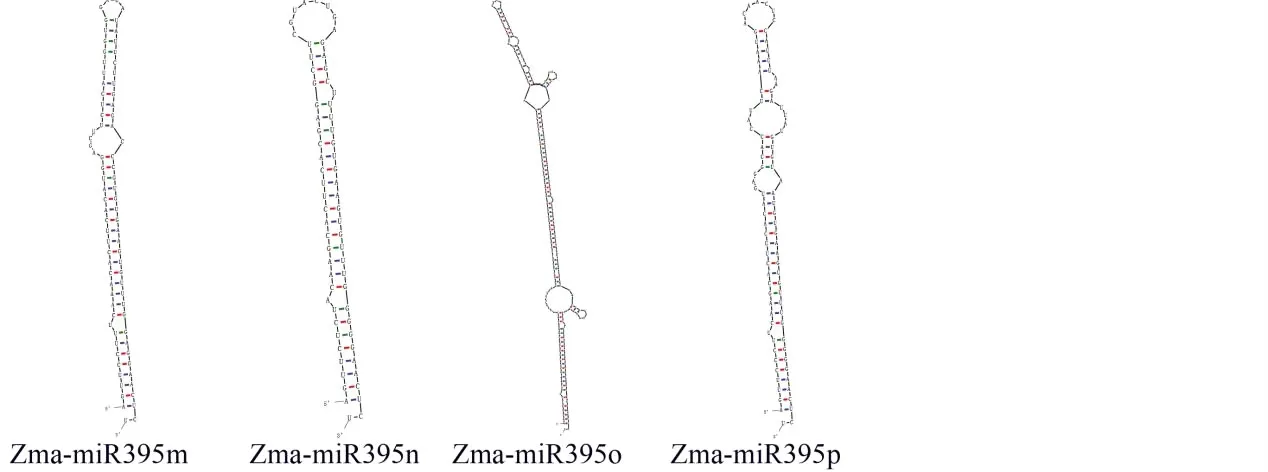
图4 zma-miR395前体二级结构
2.6 zma-miR395基因家族的靶基因预测
对zma-miR395基因家族的16个成员进行靶基因预测(E≤3),发现所有的zma-miR395成员都靶向参与硫酸盐同化的ATP硫酰化酶,这也验证了miR395通过调控ATP来控制植物的生长及发育。其他靶向基因与交替氧化酶,光系统I反应中心亚基VI相关,参与调控玉米呼吸和光合作用(表3)。

表3 zma-miR395靶基因预测
2.7 zma-miR395基因家族表达模式分析
zma-miR395基因家族16个成员表达模式情况复杂 ,如 图 5,其 中zma-miR395a/b/d/e/g/h/j、zmamiR395n/o/p、zma-miR395f/i分别具有相同的表达模式,而zma-miR395基因家族16个成员在叶片和种子中表达情况完全相反。此外,zma-miR395基因家族16个成员在各组织中多数处于下调状态,推测zmamiR395成员可能在不同的组织中发挥调控作用。

图5 zma-miR395基因家族成员表达模式
3 讨论
miRNA介导的基因调控是一种古老的基因调控机制,在陆地植物的所有世系中都得到保留,甚至早于动、植物界的分化[26]。目前,未见有zma-miR395基因家族相关研究报道,所以对zma-miR395基因家族进行鉴定和研究可以进一步了解zma-miR395对于玉米生长发育的作用。本研究通过生物信息学分析方法可知:zma-miR395基因家族进化树结果表明,由于进化选择的积极性,zma-miR395基因家族在基因组中进行串联重复形成3个基因簇,这些基因簇在基因调控方面普遍优于零散基因;zma-miR395基因家族成员之间的序列相似性极高(其中一些甚至相同)表明zmamiR395基因在进化过程中的不同时间进行了串联重复,个别成员的差异可能由于外界环境原因导致单个碱基突变,外界环境的改变,例如重金属,低温,盐碱度和干旱等已被证明可以调节miRNA在植物组织中的表达[27];启动子是基因表达调控的关键区域,分析zma-miR395的响应元件时,发现虽然响应元件的种类多,但只有个别种类数量多,说明zma-miR395功能的单一性,这一点在后面的靶基因预测时也得到了证实;zma-miR395主要靶向参与硫酸盐同化的ATP硫酰化酶,低硫条件下,miR395被证实调节低亲和力的硫酸盐转运体(SULTR2;1)和两种ATP硫化酶(APS1和APS4)[28-29];转录组数据表明16个zma-miR395基因家族成员在玉米各组织中多数处于下调状态,实验证明在硫酸盐、砷酸盐、镉和铜胁迫下,拟南芥植株中miR395表达量有所增加[30],在SO2胁迫下,拟南芥中miR395d和miR395e的表达量增加,而在低硫酸盐处理过程中,所有6个成员(miR395a、miR395b、miR395c、miR395d、miR395e、miR395f)表达量均上调[31]。不同植物基因组中miR395基因家族成员组织表达多样性为miR395基因的不同时空表达模式佐证,miR395基因的多样化分布解释了组织特异性甚至细胞类型特异性表达。对本文中预测到的zma-miR395基因家族的调控功能还需要进行进一步的实验验证,未来的研究应预测并验证miR395基因家族的基因组差异对靶基因调控的影响,了解植物miR395基因家族的进化将有助于人们更好地理解这些小RNA分子所强调的基因调控机制的复杂性。
4 结论
通过生物信息学方法鉴定到16个zma-miR395基因,均分布在Chr2和Chr10染色体上,形成3个基因簇。zma-miR395基因成熟序列的区域碱基高度保守;zma-miR395前体基因进化树及成熟体进化树均分为3枝;zma-miR395基因上游启动子元件包括12类,其中数量最多的是ABRE类,占比超过25%;zma-miR395前体二级结构为十分典型的发卡状结构,最小折叠自由能仅为-28.00 kcal/mol;zma-miR395基因靶向参与硫酸盐同化的ATP硫酰化酶;16个zma-miR395基因家族成员在多种组织中处于下调状态,推测zmamiR395基因可能反向调控基因表达。

