NaCl胁迫对野生大豆幼苗生理及叶绿素荧光特性的影响
赵如皓,丁俊男,于少鹏,王 慧,史传奇,张 志,3,孟 博
(1黑龙江湿地生态与环境研究重点实验室,哈尔滨 150086;2黑龙江大学现代农业与生态环境学院,哈尔滨 150080;3广东工业大学先进制造学院,广东揭阳 515231)
0 引言
植物的生长过程中不仅受到生物胁迫,同时还会受到多种环境胁迫,包括盐碱、干旱、高温、有毒金属、涝渍等。众多非生物胁迫中,土壤盐分含量过高是一个广泛存在并严重影响农业生产的世界性环境难题。据联合国粮农组织2021年发布的世界土壤地图显示全球盐渍化土壤面积已超过8.33×109hm2。中国盐渍化土地面积约为1.72×107hm2,其中盐渍化耕地约有9.21×106hm2,且面积呈逐年增加的趋势[1]。仅东北地区的土壤盐碱化面积约为3.84×106hm2,占东北地区土地总面积的3.1%[2]。研究表明,土壤NaCl胁迫会严重影响作物植株的生长发育[3]、干物质累积[4]、光合作用[5]、细胞渗透调节[6]等生理代谢活动,其中光合作用被认为是植物受NaCl胁迫影响最显著的生理过程[7]。
大豆是原产于中国的重要经济油料作物,是中国人民重要的植物蛋白来源。而野生大豆分布广泛且类型丰富,具有高含硫氨基酸、高蛋白、多荚和抗逆性强等优点。作为栽培大豆(Glycine max)的野生近缘种可为豆科植物的育种提供珍贵的基因资源[8]。挖掘利用耐盐碱植物可以有效提高盐碱地作物种植的产量,避免土壤次生盐碱化改善土壤环境[1],有着不可估量的生态效益和广阔的应用发展前景。
在具体作物中,NaCl胁迫诱导的抗性机制往往互相促进并具有协同作用,这也反映了植物抗盐机制的复杂性[9],目前对野生大豆或栽培大豆耐盐性鉴定的研究已有许多报道,但对野生大豆抗盐机制的研究并没有形成统一的结论,且以往研究中少量指标不能全面反映野生大豆的耐盐机制响应情况[10],NaCl胁迫条件下野生大豆生长发育及光合特性的响应还需进一步研究。本实验研究了0%、0.2%、0.4%、0.6%、0.8%NaCl胁迫对野生大豆的生长发育和光合特性的影响。旨在了解野生大豆幼苗的耐盐机制,为野生大豆耐盐机制的阐明、耐盐大豆品种的选育以及盐碱地的开发与利用供理论依据。
1 材料与方法
1.1 试验材料与处理
本试验于2020年10—12月在哈尔滨学院黑龙江省寒区湿地生态与环境研究重点实验室进行。供试野生大豆材料(编号:LY-10-25)由黑龙江省农业科学院耕作与栽培研究所大豆室提供。将精选成熟饱满、大小相对一致的野生大豆种子经含量为0.5%的NaClO溶液浸泡消毒后,于无菌培养皿中泡种10 h,并置于28℃、光照12 h的恒温培养箱中催芽后,均匀播种到培养瓶中,每瓶5株;在培养瓶中加入质量分数为0%(CK)、0.2%、0.4%,0.6%和0.8%共5个浓度梯度的NaCl溶液,每天更换NaCl溶液。将培养瓶置于光照强度200~300 μmol/(m2·s)、光周期 12/12 h(光/暗)的培养室内培养,播种45天后进行生长指标和光合参数的测定。
1.2 测定项目与方法
生长指标的测定:将培养幼苗洗净后测定地上部株高,将地上部与地下部分别放铝盒内杀青(105℃,30 min)、烘干(60℃,30 h)至恒重后称其生物量,得到植株地上部、地下部生物量和总生物量(地下部生物量与地下部生物量之和),均以单株为标准计算。采用乙醇浸泡提取法测定野生大豆叶片的叶绿素a(Chl a)、叶绿素b(Chl b)含量[11],并计算总叶绿素含量(总Chl=Chl a+Chl b)和叶绿素a/b(Chl a/b),测定5次重复。
叶绿素荧光参数的测定:用暗适应夹对各处理组野生大豆幼苗叶片进行0.5 h暗适应,然后采用便携式脉冲调制荧光仪FMS-2(Hansatch公司,英国),参照Hu等方法[12]测定PSⅡ最大光化学效率(Fv/Fm)和电子传递速率(ETR)、光化学淬灭系数(qP)和非光化学淬灭系数(NPQ);测定不同浓度处理野生大豆幼苗叶片ФPSⅡ,ETR,qP和NPQ等叶绿素荧光参数的光响应曲线[13],由FMS-2仪器施加不同光强,其中不同光强下各叶绿素荧光参数值的计算方法见公式(1)~(4)。

式中PFD代表光强,单位为μmol/(m2·s)。
分别采用硫代巴比妥酸比色法和磺基水杨酸-酸性茚三酮法测定大豆叶片中的丙二醛(MDA)和脯氨酸含量[14-15]。
1.3 数据处理
采用单因素方差分析方法和最小显著差异法,分析数据之间的差异。利用Excel 2014软件和SPSS 22.0软件,对数据进行统计分析。
2 结果与分析
2.1 NaCl胁迫对野生大豆幼苗生长特性的影响
整体来看,NaCl胁迫明显抑制了野生大豆的生长(见表1)。野生大豆的株高、地上部分生物量、地下部分生物量以及总生物量均随盐浓度的升高呈下降趋势。0.2%NaCl浓度处理组各指标与CK组差异不显著(P<0.05),0.4%、0.6%、0.8%NaCl浓度处理组各指标与CK组差异显著。不同浓度处理组之间,0.2%NaCl胁迫浓度处理组与0.4%、0.6%、0.8%NaCl浓度处理组各指标差异显著,0.8%NaCl浓度处理组除株高外各指标均与其他浓度组差异显著。

表1 NaCl胁迫对野生大豆幼苗生长特性的影响
株高是植物受胁迫后表现最直观的因子。当NaCl浓度为0.2%时,野生大豆株高的下降不显著,约为对照组的2.69%,在NaCl浓度为0.8%,野生大豆株高比对照组显著下降27.53%。
NaCl胁迫处理下,野生大豆幼苗的地上部生物量随胁迫浓度的升高而呈现降低的趋势。NaCl浓度为0.2%时,野生大豆地上部生物量比对照组下降9.52%,地下部分生物量比对照组下降11.11%;0.8%NaCl浓度处理组与对照组相比地上生物量下降约33.33%;地下部分生物量比对照组下降55.56%。同等浓度NaCl胁迫下,野生大豆地下部分生物量受NaCl胁迫的抑制更强。
2.2 NaCl胁迫对野生大豆幼苗叶绿素含量的影响
如图1所示,在NaCl胁迫处理下,供试材料野生大豆的叶绿素总含量、叶绿素a含量以及叶绿素b含量均呈现随胁迫浓度升高而降低的趋势。与对照组相比0.2%NaCl处理组叶绿素含量下降不显著,其中叶绿素a下降12.66%,叶绿素b下降2.56%,总叶绿素含量下降10.22%。0.8%NaCl处理组叶绿素含量则显著低于对照组;其中叶绿素a和叶绿素b分别较对照组下降了31.72%、18.54%(P<0.05)。叶绿素含量a/b随浓度的增高降低后小幅升高。在浓度为0.4%时达到最低值2.54。

图1 NaCl胁迫对野生大豆叶片叶绿素含量的影响
2.3 NaCl胁迫对野生大豆幼苗叶片丙二醛和脯氨酸的影响
由图2可知,丙二醛含量随胁迫浓度的升高而升高,在0%、0.2%、0.4%、0.6%、0.8%时,丙二醛含量分别为2.04、2.13、2.34、2.67、2.86 μmol/g。当 NaCl浓度为0.2%时,丙二醛含量增长不显著,增幅约为对照组的4.41%;胁迫浓度为0.8%时,丙二醛含量达到最高值2.86 μmol/g,较对照组的显著增长40.20%。当NaCl浓度为0.2%时,脯氨酸含量增长幅度不显著(P<0.05),约为对照组9.31%;NaCl浓度为0.8%时,脯氨酸含量达到最高值21.69 μg/g,较空白组的显著增长132.23%。
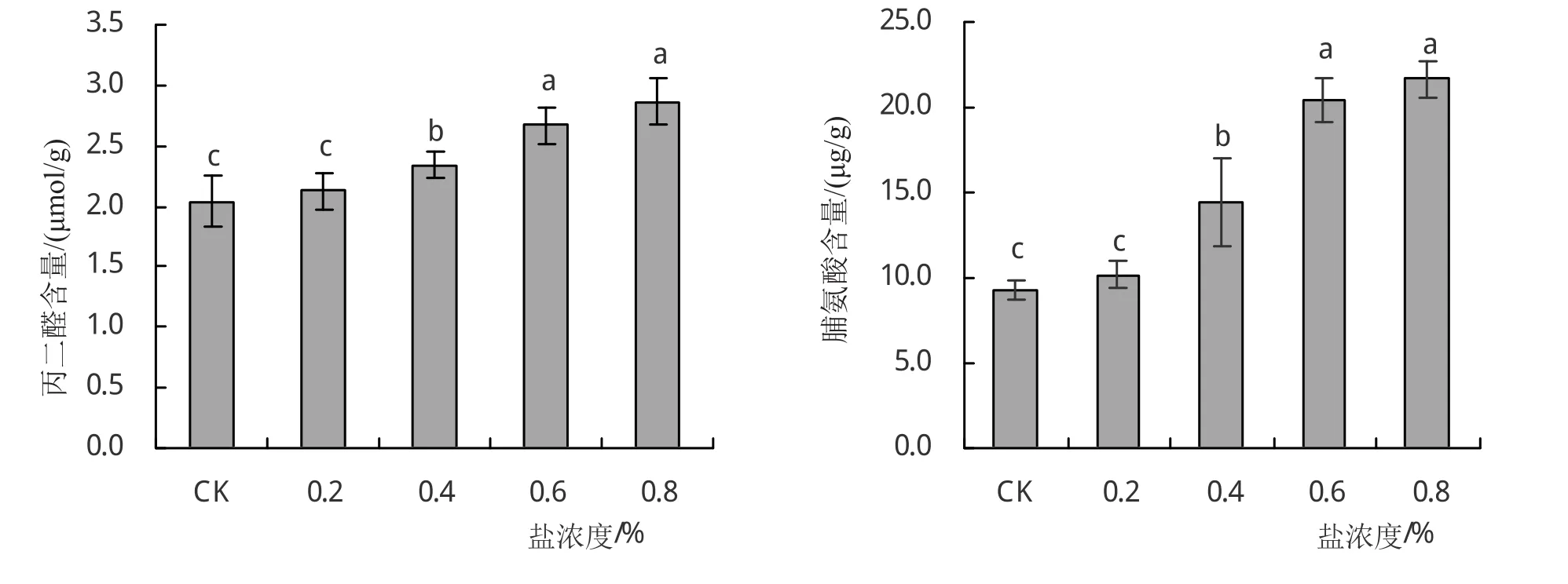
图2 NaCl对大豆叶片丙二醛和脯氨酸的影响
2.4 NaCl胁迫对野生大豆幼苗叶片叶绿素荧光特性的影响
本试验中,供试材料野生大豆最大光化学效率随NaCl胁迫浓度的升高先上升后下降(表2)。在NaCl浓度为0.2%时,最大光合效率上升1.24%,但差异不显著(P<0.05)。NaCl浓度为0.4%时,野生大豆的最大光合效率较对照组下降0.25%。当NaCl浓度为0.6%时,最大光合效率下降1.49%。NaCl浓度达到最大0.8%时最大光化学效率降至最低值,较对照组下降6.26%。表明较低浓度(0.2%及以下)的NaCl胁迫对野生大豆的光合效率有轻微的促进作用;高浓度(0.4%及以上)NaCl胁迫则显著抑制了野生大豆的光化学效率。

表2 NaCl胁迫对野生大豆幼苗叶片叶绿素荧光特性的影响
电子传递速率是体现植物叶片PSII反应中心的电子捕获效率的重要指标[16]。本实验中,野生大豆的电子传递速率随NaCl浓度的升高而降低。NaCl浓度为0.2%时,电子传递速率较空白组下降2.27%,差异不显著(P<0.05)。NaCl浓度为0.8%时,电子传递速率较空白组显著下降47.21%。表明0.2%及以下的低浓度的NaCl对野生大豆的电子传递速率的抑制不显著;0.4%及以上高浓度NaCl则显著抑制了野生大豆的电子传递速率。
光化学猝灭系数是体现植株光合中心将捕获的光能用于光化学反应的能力的重要指标,非光化学猝灭系数则反映了植株将过剩光能转化为热能释放的能力,是光合系统的自我保护机制[17]。叶片光化学淬灭系数随NaCl浓度的升高而降低,0.8%浓度处理组qP值最低,较对照组下显著下降36.65%。非光化学淬灭系数随NaCl浓度的升高呈现先降低后升高的趋势,0.2%NaCl胁迫时NPQ小幅度下降但与对照组差异不显著,胁迫浓度进一步提升后NPQ开始上升,在0.8%NaCl胁迫时NPQ较对照组显著升高74.76%。
2.5 NaCl胁迫对野生大豆幼苗叶片叶绿素荧光响应曲线的影响
由图3可以看出,在光照强度为0~400 μmol/(m2·s)间时,各浓度NaCl胁迫对植株叶绿素荧光响应曲线影响差异相对较小,随着光照强度的增强不同处理组间各项指标的差异逐渐增大。同一浓度下ФPSⅡ随光照强度的增大而下降。光照强度增至1200 μmol/(m2·s)时各处理ФPSⅡ降至最低值。在低光照强度(0~400 μmol/(m2·s))、NaCl浓度为0.2%时,ФPSⅡ高于空白对照。光强进一步增加后,各浓度NaCl胁迫处理组ФPSⅡ均低于空白对照。在光照强度 1200 μmol/(m2·s)、NaCl浓度0.8时,植株ФPSⅡ显著下降,约为对照组的63.19%。qP方面,除0.2%NaCl浓度处理组出现先小幅增高后下降的趋势外,其他各组随光照强度的增大而下降并均在光照强度为1200 μmol/(m2·s)时达到最低值。在低光照强度(0~400 μmol/(m2·s))内、NaCl浓度为0.2%时,qP高于空白对照,光强进一步增加后各浓度NaCl胁迫处理组qP均低于空白对照。NPQ呈现与其相反的趋势,随光照的增强而升高。在较低光照强度(0~400 μmol/(m2·s))时,各处理组NPQ随着光照强度的增加而缓慢的上升。当光照强度进一步增加,NPQ增长速率加快。同一NaCl浓度下ETR随光照强度的增加呈上升趋势。对照组的ETR增长幅度大于各浓度胁迫组,各组在光强达到800 μmol/(m2·s)后,增长速度减缓,其中0.8%NaCl胁迫组在光照强度达到800 μmol/(m2·s)后,ETR值趋于稳定。

图3 NaCl胁迫对野生大豆幼苗叶片叶绿素荧光响应曲线的影响
3 讨论
NaCl胁迫是植物遭受的常见非生物胁迫之一,会对植物的多种生理过程造成伤害[18]。本研究表明,NaCl胁迫影响下野生大豆的株高降低、地上地下干物重以及总干物重积累减少。低浓度NaCl胁迫对野生大豆的抑制作用不显著,高浓度时则显著抑制了野大豆的生长发育。在本实验中地下部分干物质累积与地上部分相比受到的影响更大,可能在于地下根际部分是最直接接触NaCl胁迫的部分,因此受NaCl抑制更显著。
叶绿素含量能直接影响作物碳水化合物的合成,是光合特性的重要量度,也是反映叶片质量的主要指标之一[19]。本研究中随盐浓度升高,总叶绿素含量、叶绿素a含量及叶绿素b含量均下降,表明NaCl胁迫对叶绿素的合成具有抑制作用,且同等NaCl浓度下,叶绿素a含量较叶绿素b下降幅度更大。其原因可能是叶绿素a较叶绿素b更不稳定,易受到活性氧作用分解[20],导致NaCl胁迫对叶绿素a的影响更显著。
NaCl胁迫条件下,植物光合作用受到抑制,碳同化能力下降产生活性氧自由基,造成膜脂过氧化并生成MDA[21],故MDA含量可反映植物细胞膜脂过氧化的程度[22]。大量研究表明,植物叶片MDA含量会随盐浓度升高而增加[23-24]。在本实验中,不同浓度处理组的野生大豆叶片MDA含量均高于空白对照,说明NaCl胁迫导致野生大豆不同程度的膜质过氧化,但0.2%NaCl胁迫下,MDA含量升高不显著,胁迫浓度进一步升高后,MDA含量也显著升高,0.6%~0.8%NaCl胁迫下MDA含量显著高于对照组以及其他处理组,表明该浓度NaCl胁迫对野大豆造成严重膜损伤,使野大豆膜质过氧化程度显著加剧,MDA作为植物过氧化的产物随之增加,这与贺莉等[19]的研究结果一致。
NaCl胁迫会造成植物脱水,细胞渗透失衡,而脯氨酸能参与植物细胞内渗透调节过程,是维持细胞渗透平衡的保护剂[12]。相关学者认为在逆境条件下水稻、绿豆等植物会累积脯氨酸[25]。本研究中,野生大豆的脯氨酸含量随NaCl胁迫浓度的升高而升高,表明NaCl胁迫下野生大豆会增加幼苗叶片中脯氨酸含量,以提高细胞吸水保水的能力,减轻NaCl胁迫对自身的影响。这与王丽燕等[26]的研究结果一致。
叶绿素荧光分析得到的诸多PSII光化学效率参数,与光合作用过程紧密相关,可快速、直接反映植物对不同环境条件的响应,并判断植物光体系受胁迫的严重程度[27]。最大光化学效率代表了植物光合机构最大光能转化效率,是植物发生光抑制的敏感指标,体现了植株叶片的光合能力与PSII受伤害的程度[28]。本研究结果表明,低浓度的NaCl胁迫对野大豆光合效率的影响不显著。NPQ在0.2%NaCl胁迫下达到了最低值,表明植株内过剩光能转化为热能释放的生理活动减少,其原因可能是0.2%以下的低浓度NaCl胁迫使电子传送速率受到轻微抑制,而最大光化学效率小幅提升,使叶片内过剩光能减少,最终导致NPQ降低。有研究表明,植物的叶绿素荧光特性在NaCl胁迫下易受到光照强度的影响[29],探究植物在NaCl胁迫下对光强的适应能力,能为盐碱化耕地实际生产提供部分参考[30]。本研究中,各浓度处理组实际光合效率随光照强度的增加而下降。在光照强度为0~200 μmol/(m2·s)时,0.2%NaCl胁迫处理组野生大豆叶片ФPSⅡ略高于空白对照组;但随光照强度进一步增加,各盐浓度处理组ФPSⅡ显著下降并低于空白组,且光照越强,不同浓度NaCl胁迫导致的ФPSⅡ下降幅度越大,表明过强的光照会加剧NaCl胁迫对野生大豆光合作用的抑制。其原因可能是强光会损伤野大豆光合机构的活性[31],NaCl胁迫抑制PSll的修复[32],因此较高的光照强度会加剧盐分毒害的程度,这与朱新广等[33]的研究结果一致。
本实验中,0.4%NaCl胁迫条件下,野生大豆的多数参数指标与对照组差异显著,这说明0.4%的盐浓度可能是其生长发育、生理及光合NaCl胁迫的临界盐浓度,0.4%以及以上浓度的NaCl胁迫超出了野大豆的自我调节能力,会对其生长造成严重抑制,对光合反应中心造成严重的胁迫损害。
受试验周期限制,本次实验亦有不足之处,仅展示了NaCl胁迫对光合特性主要指标的影响,未涉及气孔导度、蒸腾速率等反应,后续实验将补充检测指标,进一步加入胁迫相关基因表达量的检测与分析。此外,尽管已有的研究显示强光会加剧NaCl胁迫对野大豆的迫害,但两者的协同关系及作用区别并不明确,且本实验中弱光条件下0.2%NaCl胁迫对野生大豆ФPSⅡ有促进作用,其背后原因需进一步研究。
4 结论
本实验中,0.2%及以下的低浓度NaCl胁迫对野生大豆生长发育抑制不显著,且野大豆能通过自身的调节机制保持略高于对照组的光化学效率,体现了野大豆的耐盐性。0.4%及以上的高浓度NaCl胁迫导致野生大豆株高显著下降,干物质累计显著减少,幼苗叶片光化学效率显著降低,并影响各荧光参数对光的响应。野生大豆的生长发育及光合特性中多数指标在0.4%NaCl胁迫条件下大幅改变,推测0.4%的盐浓度可能是其生长发育、生理及光合NaCl胁迫的临界盐浓度。同浓度NaCl胁迫处理下野大豆地上部分较地上部分受到的抑制作用更大,叶绿素a较叶绿素b受NaCl胁迫抑制作用更大。
在低光照强度(0~200 μmol/(m2·s))下 ,低浓度(0.2%)NaCl胁迫处理组实际光化学效率高于对照,但光照强度进一步加剧后,对照组高于各浓度NaCl胁迫处理组,且光照越强不同浓度NaCl胁迫导致的ФPSⅡ下降幅度越大,证明低光照环境中0.2%以下的低浓度NaCl胁迫能促进植物的光化学效率,但强光会加剧NaCl胁迫对野生大豆植株损害。

