鸡miR-10b-5p生物信息学及组织表达分析
黄正洋,赵振华,黄华云,李春苗,王钱保,穆春宇,黎寿丰
(中国农业科学院家禽研究所,扬州 225009)
在表观遗传学研究领域,microRNA研究是一个越来越受到关注的研究热点。microRNA是一种序列高度保守的单链非编码小分子RNA,长度19~25个核苷酸[1-2],主要是通过与靶基因的3′-非翻译区结合形成RNA诱导沉默复合体,从而抑制靶基因翻译,起着负调控的作用。研究表明,miRNA参与了动物生长发育过程中大量基因的表达调控,如细胞的增殖、分化、凋亡等,进而调控动物的肌肉发育以及繁殖等过程[3-4]。
miR-10家族是一个非编码RNA家族,主要包括miR-10a、miR-10b和miR-10c这3个大类,每个大类同时还会有来自前体序列5′-端臂和3′-端臂加工而来的成熟体miRNA。miR-10位于HOX(homeobox family)基因簇内,HOX基因是一类编码高度保守、含有同源结构域的DNA结合转录因子,在生物形态发育过程中起着重要作用。miR-10b-5p是来自miR-10b的5′-端臂的成熟体形式,在调控细胞增殖凋亡中起着重要的功能。目前,已经对miR-10在小鼠[5]、山羊[6-8]、猪[9-11]和鹅[12]等物种上的功能进行了研究,主要研究了在组织间的表达差异、肌肉生长发育、对卵巢颗粒细胞的影响以及对精子发生过程的调控。
鉴于miR-10b-5p与肌肉生长、细胞增殖分化和颗粒细胞凋亡密切关系,以苏禽3号肉鸡为试验动物,通过检索获得常见脊椎动物的miR-10b-5p序列,并进行相应分析;利用数据库比对确定miR-10b-5p在基因组中的位置,根据成熟序列构建系统进化树;使用多个在线软件预测miR-10b-5p靶基因,并进行GO功能和KEGG通路分析;利用实时荧光定量PCR技术检测不同生长时期miR-10b-5p组织表达变化,为进一步揭示miR-10b-5p在鸡肌肉生长及细胞增殖分化中的功能奠定基础。
1 材料与方法
1.1 材料
试验选取中国农业科学院家禽研究所邵伯试验基地选育的苏禽3号肉鸡。选取体重接近的1日龄健康个体600只,佩戴翅号,组建试验群体。在相同管理条件下饲养,自由采食及饮水,常规程序免疫接种。3日龄(生长初期)和90日龄(上市前)时,随机选取5只进行放血屠宰,分别采集心脏、肝脏、脾脏、肺脏、肾脏、胸肌、腿肌、卵巢、大脑、小脑、垂体和下丘脑等组织样品,立即置于液氮中,带回实验室后-70 ℃保存,用于总RNA提取。
1.2 主要试剂和仪器
miRcute miRNA提取分离试剂盒(DP501)、miRcute增强型miRNA cDNA第一链合成试剂盒(KR211)、增强型miRNA荧光定量检测试剂盒(FP411)均购自天根生化科技(北京)有限公司。Applied Biosystems 7500荧光定量PCR系统购自赛默飞世尔科技(中国)有限公司。
1.3 miR-10b-5p序列的获得
从miRBase 22.1(http:∥www.mirbase.org/)[13]中下载全部物种miRNA成熟序列,筛选miR-10b-5p序列,去除植物等物种的序列,只保留脊椎动物的成熟序列及前体序列。经过筛选,选取以下物种的miR-10b-5p序列:牛(Bostaurus,登录号:MIMAT0003839)、家犬(Canisfamiliaris,登录号:MIMAT0009837)、山羊(Caprahircus,登录号:MIMAT0035913)、豚鼠(Caviaporcellus,登录号:MIMAT0046847)、锦龟(Chrysemyspicta,登录号:MIMAT0037627)、原鸽(Columbalivia,登录号:MIMAT0038406)、灰仓鼠(Cricetulusgriseus,登录号:MIMAT0023737)、鲤鱼(Cyprinuscarpio,登录号:MIMAT0026200)、斑马鱼(Daniorerio,登录号:MIMAT0001268)、马(Equuscaballus,MIMAT0013090)、大西洋鳕鱼(Gadusmorhua,MIMAT0044188)、红色原鸡(Gallusgallus,登录号:MIMAT0001148)、大猩猩(Gorillagorilla,登录号:MIMAT0002491)、人(Homosapiens,登录号:MIMAT0000254)、猕猴(Macacamulatta,登录号:MIMAT0006162)、小鼠(Musmusculus,登录号:MIMAT0000208)、鸭嘴兽(Ornithorhynchusanatinus,登录号:MIMAT0007218)、家兔(Oryctolaguscuniculus,登录号:MIMAT0048099)、绵羊(Ovisaries,登录号:MIMAT0030031)、黑猩猩(Pantroglodytes,登录号:MIMAT0007945)、狐蝠(Pteropusalecto,登录号:MIMAT0039899)、褐家鼠(Rattusnorvegicus,登录号:MIMAT0000783)、大西洋鲑鱼(Salmosalar,登录号:MIMAT0032295)、野猪(Susscrofa,登录号:MIMAT0013885)。
1.4 miR-10b-5p基因定位及序列分析
由于成熟序列较短,可能在基因组中有多个定位,因此,采用Ensembl数据库的BLAST程序(http:∥asia.ensembl.org/index.html),以鸡、山羊、家兔、野猪、牛和斑马鱼等12个物种的miR-10b-5p前体序列作为查询序列,对其基因组数据库进行搜索,以确定miR-10b-5p在基因组染色体上中的位置。 选取24种典型物种的24条miR-10b-5p的成熟序列,使用Mega 11.0软件[14](https:∥www.megasoftware.net/)中Clustal W程序对miR-10b-5p基因的成熟序列进行多序列比对(multiple sequences alignment,MSA),分析序列特点。
1.5 系统发生分析
为使得构建的系统进化树更加准确,选取24种典型物种的24条miR-10b-5p的前体序列,使用Mega 11.0软件中Clustal W程序进行多序列比对分析,采用基于距离参数的邻接法(Neighbor-joining,NJ),并自展分析(Bootstrap)1 000次,构建miR-10b-5p基因的系统进化树。
1.6 miR-10b-5p靶基因预测及功能分析
利用3个在线软件microT[15](http:∥diana.imis.athena-innovation.gr/DianaTools/index.php?r=microtv4/index)、miRDB[16](http:∥www.mirdb.org)和TargetScan[17](http:∥www.targetscan.org/vert_71/)预测gga-miR-10b-5p的靶基因,取3个软件的交集以降低预测结果的假阳性。对获得的靶基因使用在线工具DAVID[18](https:∥david.ncifcrf.gov/)进行GO功能和KEGG通路富集分析。
1.7 引物设计与合成
根据NCBI上红色原鸡gga-miR-10b-5p序列(登录号:NR_031440.1),利用miRNA Design v.1.01软件采用加尾法设计引物进行定量分析,以U6为内参基因,引物信息见表1。引物均由生工生物工程(上海)股份有限公司合成。
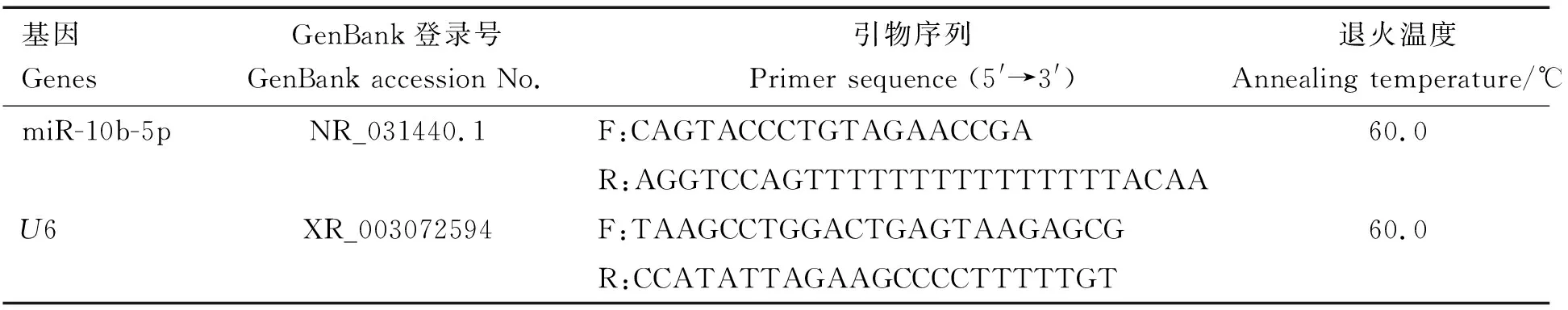
表1 miR-10b-5p 实时荧光定量PCR引物Table 1 Sequences of the oligonucleotide primers for Real-time quantitative PCR
1.8 miRNA提取及反转录
采用miRcute miRNA提取分离试剂盒提取各组织样品miRNA。每个样品取3 μL总RNA,使用miRcute增强型miRNA cDNA第一链合成试剂盒,进行miRNA第一链cDNA的反转录(采用加A法)。反应体系:Total RNA 2 μg,2×miRNA RT Reaction Buffer 10 μL,1×miRNA RT Enzyme Mix 2 μL,RNase-free ddH2O补至20 μL。反应程序:42 ℃ 60 min;95 ℃ 3 min。合成的cDNA反应液置于-20 ℃保存备用。
1.9 miR-10b-5p在鸡不同组织内的定量表达检测
采用SYBR Green Ⅰ嵌合荧光法检测心脏、肝脏、脾脏、肺脏、肾脏、胸肌、腿肌、卵巢、大脑、小脑、垂体和下丘脑等组织样品中miR-10b-5p表达量,反应条件和程序按照miRcute增强型miRNA荧光定量检测试剂盒说明书操作。PCR反应在Applied Biosystems 7500荧光定量PCR系统中进行,U6基因作为内参。
1.10 统计分析
采用2-ΔΔCt法分析miR-10b-5p在鸡不同组织中的相对表达量,每个样品重复3次。试验结果以平均值±标准差表示。用SPSS 26.0软件独立样本t检验进行统计分析,以P<0.05作为差异显著性判断标准。
2 结 果
2.1 miR-10b-5p家族分析
通过文献和miRBase检索共获得59种动物的59条miR-10b-5p序列,即所查到的每种动物中都只有1种miR-10b-5p形式。由于miR-10b家族基因数量的不同,导致miR-10b-5p呈现出以下2种形式:miR-10b和miR-10b-5p。在鸡中miR-10b的成熟体形式为miR-10b-5p。选取了常见的红色原鸡、山羊、兔、人、斑马鱼等12个物种的miR-10b-5p前体序列作为查询序列(query sequence),通过BLAST搜索确定各序列在基因组中的位置,如表2所示。基因定位显示,与其他miRNA类似,miR-10b-5p大部分都位于基因的间隔区(intergenic region,IGR),鸡miR-10b-5p定位在7号染色体上,位于HOX基因家族基因间隔区。

表2 miR-10b-5p基因家族在基因组中的定位Table 2 Genomic location of miR-10b-5p gene family
2.2 miR-10b-5p序列分析
选取24种典型物种的24条miR-10b-5p的成熟序列进行多序列比对分析,结果如图1所示,miR-10b-5p的成熟序列相似性很高,序列长度(22~24 nt)相近,保守的碱基数19个,分别为第3-18和20-22位碱基,说明miR-10b-5p在不同物种间具有高度保守性。比对结果显示,miR-10b-5p在部分物种在前两位和最后两位碱基存在不同程度缺失,在大西洋鳕鱼第19位碱基出现了U>G的突变。
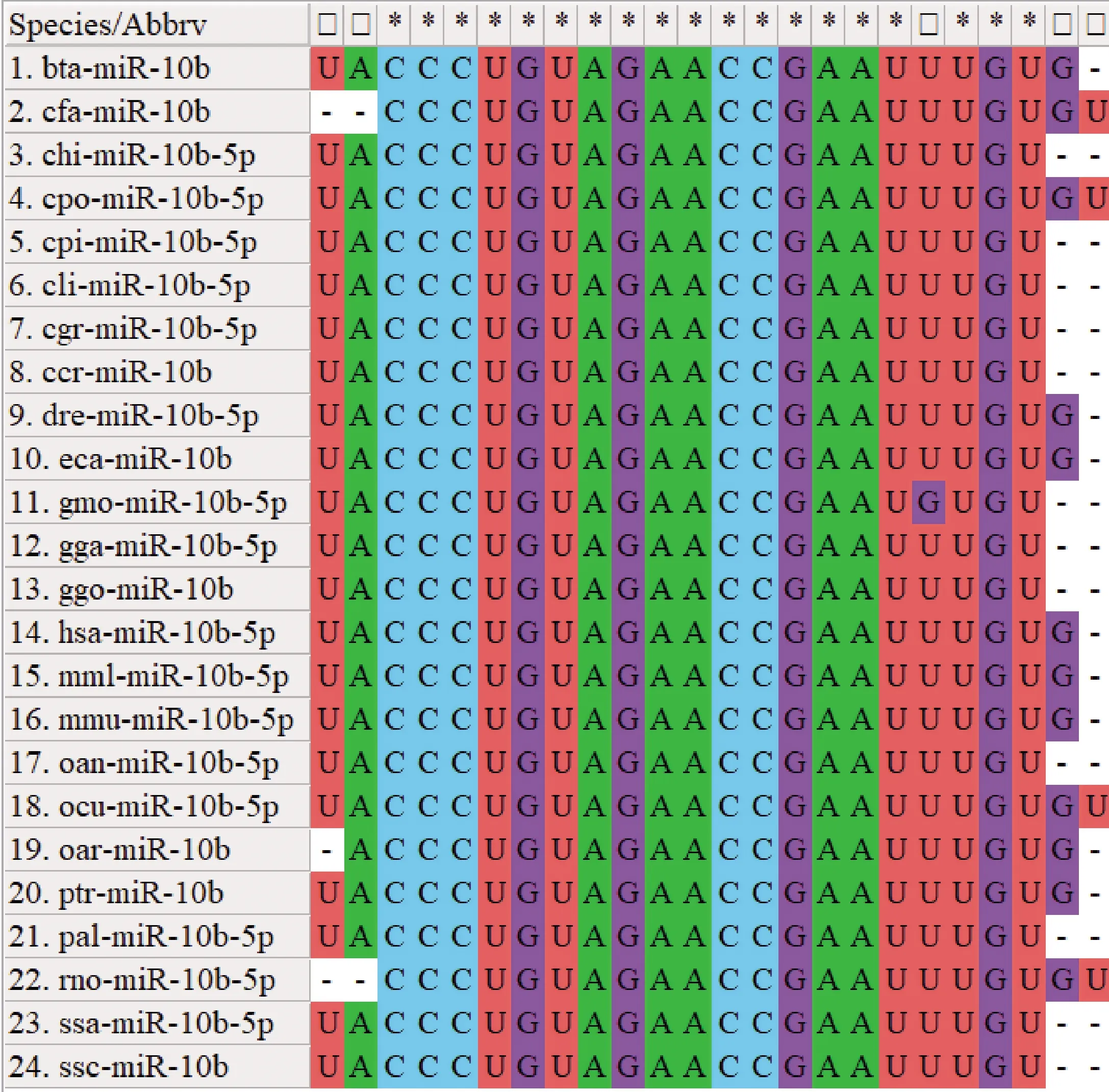
*,表示序列一致;-,表示碱基缺失*,Represent highly conserved bases;-,Indicate base deletion图1 miR-10b-5p基因家族的成熟序列比对Fig.1 Multiple sequence alignment of mature sequence of miR-10b-5p gene family
2.3 miR-10b-5p系统进化树的构建
采用Mega 11.0软件,以代表性物种的miR-10b-5p序列的前体序列miR-10b构建基于距离参数的邻接法系统发育进化树,结果如图2所示,miR-10b前体序列在哺乳类中的灵长目、啮齿目、 鸟类、 鱼类中各自先聚为一支, 然后再共同聚为一类。这表明miR-10b基因在各个物种内是保守的。
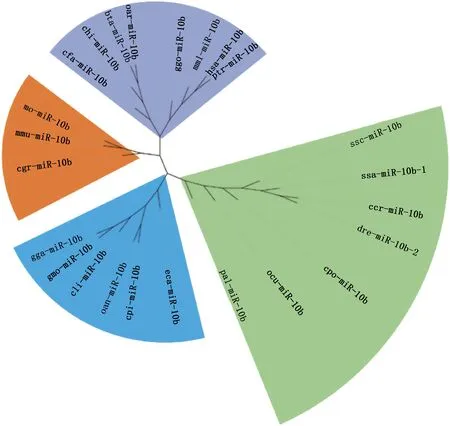
图2 miR-10b基因家族系统发育进化树Fig.2 Phylogenetic tree of the miR-10b gene family
2.4 miR-10b-5p靶基因预测及功能分析
使用3种miRNA在线靶基因预测软件microT、miRDB和TargetScan分别预测到67、107和228个鸡miR-10b-5p靶基因,取3个软件的并集共得到300个靶基因(图3)。
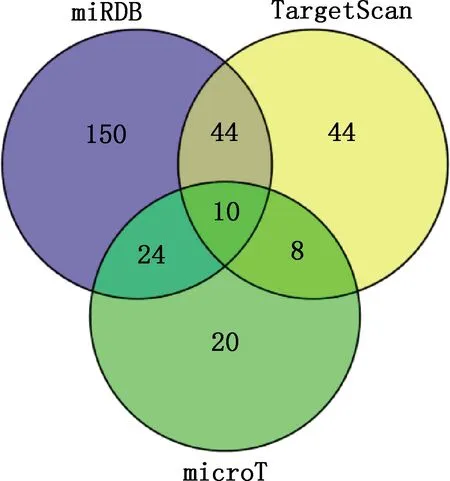
图3 鸡miR-10b-5p靶基因预测结果Fig.3 Prediction results of target genes of miR-10b-5p in chickens
对预测获得的靶基因使用在线工具DAVID进行GO功能分析,结果如图4所示,在生物过程分类中,靶基因主要富集到端粒异染色质组装、染色体凝聚负调控、着丝粒复合体组装的调控、心周异染色质组装和基因表达的转录后调控等;在细胞组分分类中,靶基因主要富集到组蛋白甲基转移酶复合物、转录因子复合物、细胞质核周区和细胞质膜;在分子功能分类中,靶基因主要富集到电压门控钠通道活性,RNA聚合酶Ⅱ转录因子活性、配体激活序列特异性DNA结合,转录抑制物活性、RNA聚合酶Ⅱ转录调控区序列特异性结合,RNA聚合酶Ⅱ远端增强子序列特异性DNA结合,类固醇激素受体。
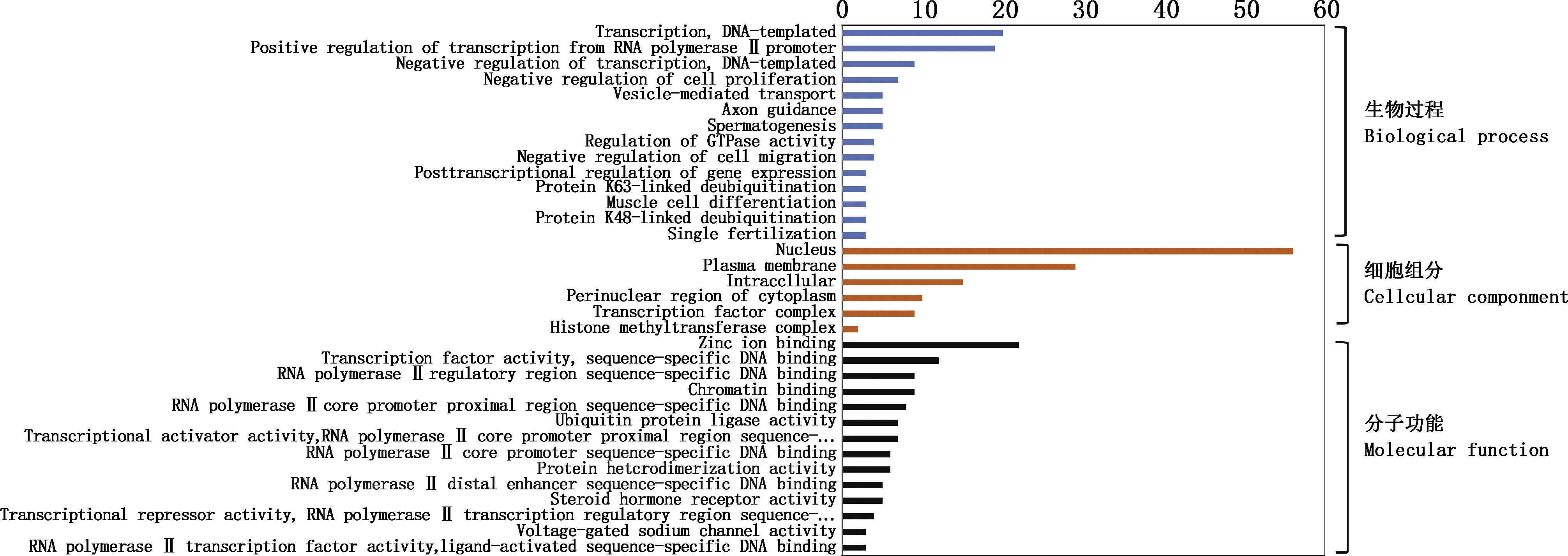
图4 靶基因GO功能富集分析Fig.4 GO function enrichment analysis of target genes
对靶基因进行KEGG通路富集分析,结果如表3所示,靶基因主要富集到Wnt信号通路(Wnt signaling pathway)、RNA转运(RNA transport)和p53信号通路(p53 signaling pathway)。 多个与肌肉生长及细胞增殖等相关的基因富集到相关通路之上,如细胞周期蛋白D3(Cyclin D3,CCND3)、WNT9A(wingless-type MMTV integration site family,member 9A,WNT9A)、BTRC(Beta-transducin repeat containing E3 ubiquitin protein ligase,BTRC)和S相激酶相关蛋白1(S-phase kinase-associated protein 1,SKP1)等。
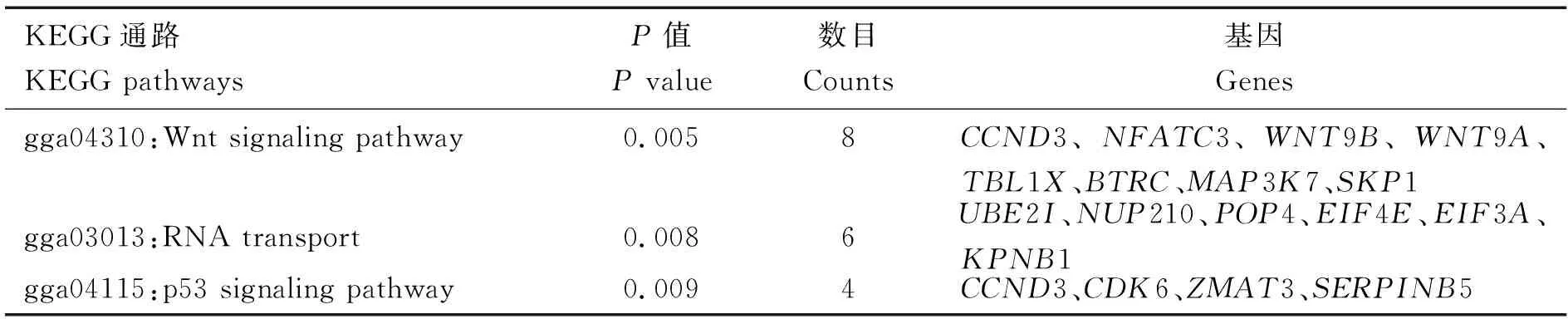
表3 miR-10b-5p家族预测靶基因的KEGG信号通路数据库富集分析结果Table 3 KEGG pathway exrichment results of miR-10b-5p predicted target genes
2.5 miR-10b-5p在鸡不同日龄和不同组织中的相对表达量
对心脏、肝脏、卵巢和胸肌等不同组织miR-10b-5p进行了检测,结果如图5所示,miR-10b-5p在检测的各个组织中均有表达;3日龄时大脑、小脑、垂体、胸肌和腿肌中miR-10b-5p表达量显著高于心脏、下丘脑、肾脏和肺脏等组织(P<0.05);90日龄时,垂体、胸肌、腿肌和大脑中miR-10b-5p表达量显著高于其他组织(P<0.05)。与3日龄雏鸡相比,90日龄鸡垂体、胸肌和腿肌中miR-10b-5p表达量均显著上升(P<0.05)。
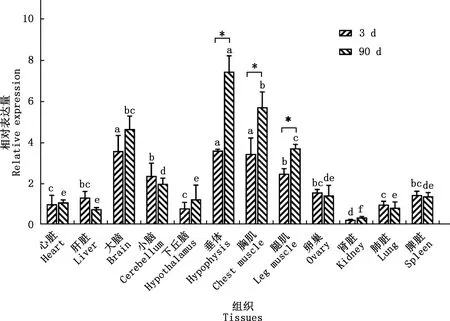
①同一日龄不同组织间比较,肩标不同字母表示差异显著(P<0.05);肩标相同字母表示差异不显著(P>0.05)。②同一组织不同日龄间比较,*,差异显著(P<0.05);无*,差异不显著(P>0.05)①Comparison between different tissues at the same age,values with different letter superscripts mean significant difference (P<0.05);While with the same letter superscripts mean no significant difference (P>0.05).②Comparison between different ages of the same tissue,*,Significant difference (P<0.05);No *,No significant difference (P>0.05)图5 miR-10b-5p在不同日龄鸡组织中的相对表达量Fig.5 Relative expression of miR-10b-5p in different tissues of chickens at the different age
3 讨 论
miRNA作为一种内源性调控因子,参与了畜禽多种生物调控,如细胞增殖、分化及凋亡等。miRNA要发挥其调控作用,主要是作用在靶基因3′-UTR区,形成沉默复合物,使得靶基因翻译受到抑制,从而发挥调控功能。准确找到miRNA的靶基因,对于研究miRNA功能至关重要。而目前的研究方法主要是前期通过生物信息学方法进行预测,后期通过敲除或者干扰试验来验证其靶向关系。
miR-10b-5p是miR-10b的5′-端成熟miRNA,在人类中,miR-10b定位于2号染色体上,位于HOXD4与HOXD8基因间隔区。 而在鸡中,miR-10b定位于7号染色体上,位于HOXD3与HOXD13基因间隔区。在其他物种中也发现miR-10b都在HOX基因簇中,这说明miR-10b和HOX基因关系密切,HOX基因在动物发育过程中发挥着重要作用,miR-10b和HOX基因可能共同参与调控动物的发育过程。方芳[6]对多羔和单羔奶山羊发情期卵巢组织差异表达的miRNAs进行筛选,对获得的差异表达显著的miR-10b靶基因以及在卵巢颗粒细胞中的表达进行分析,通过荧光素酶报告载体和实时荧光定量PCR验证BDNF是miR-10b的靶基因,miR-10b通过抑制BDNF基因的表达从而抑制卵巢颗粒细胞活性。郭乐薇等[19]将miR-10b模拟物和miRNA模拟物转染到牛卵巢颗粒细胞中发现,凋亡相关蛋白Caspase-3、Bcl-2和Bax表达量显著下降,说明miR-10b可促进牛卵巢颗粒细胞凋亡。因此,miR-10b-5p在颗粒细胞中主要是抑制某些基因的表达,促进细胞凋亡。目前在多个繁殖相关组织中都筛选出了miR-10b-5p[7,10,11,20-22]。本研究对miR-10b-5p进行组织表达分析,发现在大脑、小脑、垂体、胸肌、腿肌和卵巢中表达量均较高。 对3和90日龄的组织器官中miR-10b-5p表达变化进行检测,发现90日龄垂体、胸肌和腿肌中miR-10b-5p表达量均显著高于3日龄。其原因可能是在生长后期miR-10b-5p同样会抑制生长相关基因的表达,使得生长速度减慢,这在一定程度上说明miR-10b-5p可作为评价鸡生长速度的一个标志物,进而指导肉鸡选育工作。
在对miR-10b-5p进行基因定位分析发现,鸡miR-10b-5p位于7号染色体上的基因间隔区,这与以往的研究类似[12,23-24]。推测可能是由于其位于基因间隔区,在不破坏附近基因结构的情况下可以调控上下游基因的表达,提高了调控效率。通过对常见物种miR-10b-5p成熟序列比对分析发现,不同物种miR-10b-5p的成熟序列物种间较为保守。进化树分析发现,miR-10b前体序列在灵长类、啮齿类、鱼类和鸟类中各自先聚为一支,然后再共同聚为一类,这也证明了miR-10b基因在各个物种内是保守的。目前,通过对以往的文献[25-26]分析可知,对miRNA靶基因的预测和生物信息学分析主要是通过JASPAR、PROMO、miRanda、RNAhybrid、miRDB、miRWalk和TargetScan等生物信息学软件进行,本研究选取了其中3个常用的在线软件进行了预测。 靶基因预测和功能分析发现,miR-10b-5p共有300个靶基因。GO功能分析结果表明,靶基因主要富集到染色质组装和基因表达的转录后调控、组蛋白甲基转移酶复合物、转录因子复合物、RNA聚合酶Ⅱ转录因子活性和RNA聚合酶Ⅱ远端增强子序列特异性DNA结合等功能。KEGG通路富集分析表明,靶基因主要富集到Wnt和p53信号通路,这些信号通路与肌肉生长发育、细胞增殖分化密切相关。
4 结 论
本试验研究了miR-10b-5p在苏禽3号鸡不同生长阶段组织中的表达规律,发现miR-10b-5p在鸡各组织中都广泛表达,在垂体、胸肌、腿肌中高表达;miR-10b进化过程是保守的;其可能通过Wnt及p53信号通路调控肌肉细胞增殖分化,进而调控鸡肌肉生长发育。

