牛妊娠相关蛋白19真核表达载体的构建及生物信息学分析
董 媛,于鸿绪,陈国良,鲍东博,崔嘉芮,3,刘 磊,王会岩,4
(1.吉林医药学院检验学院,吉林 132013;2.动物疫病预防控制中心,吉林 136600;3.吉林农业大学生命科学学院,长春 130700;4.吉林医药学院抗体工程科技协同创新中心,吉林 132013)
妊娠相关糖蛋白(pregnancy-associated glycoprotein,PAG)隶属于天冬氨酸蛋白酶家族[1],最初是在妊娠后母牛的胎盘中作为母体血液中的妊娠特异性抗原而被发现的。目前已从牛胎盘中克隆出21个不同的牛妊娠相关糖蛋白(bovine pregnancy-associated glycoproteins,BoPAGs) cDNA,核苷酸序列差异在5%[2],不同BoPAGs的表达存在时空差异,如BoPAG1、BoPAG9和BoPAG21仅在滋养外胚层的双核细胞中表达,BoPAG2、BoPAG8、BoPAG10、BoPAG11和BoPAG12则在整个滋养外胚层细胞中产生[3]。BoPAGs基因编码375~389个氨基酸(少数为258~342个氨基酸)的多肽链,结构上与胃蛋白酶、凝乳酶等有50%的相似性,但因催化中心关键氨基酸突变,导致大多数BoPAGs失去了蛋白水解活性[4]。相对于传统的妊娠诊断方法,BoPAGs作为一种妊娠动物体液中能检测出的特异性蛋白,因具有检出率高、对检测设备和方法要求不高等优点而倍受人们的关注[5]。Frickep等[6]研究发现,在妊娠21 d左右的母牛血液中能够检测到BoPAGs,分娩时达到高峰,受精27 d后的检测准确率达到93.7%,比超声诊断法提前了几天,这有利于及早且准确地诊断牛的妊娠状况,缩短出栏时间,降低养殖成本。目前对于BoPAGs的功能研究较少,推测其在胎盘-子宫界面潜在生长因子的生化处理中起作用,同时参与了胎盘的发生、胎儿生长、母婴物质传递等[7],但PAG在维持妊娠时发挥的具体功能尚不清楚。限制BoPAGs研究的主要原因就是天然的BoPAGs浓度低、种类繁多,难于纯化。通常多采用磷酸钾缓冲液提取、饱和硫酸铵沉淀、离子交换层析等传统方法从母畜胎盘子叶中分离纯化天然PAG蛋白,但步骤繁琐复杂,且大多数PAGs蛋白不稳定,在纯化过程中稍有不慎容易导致蛋白降解[8]。此外,成熟的BoPAGs要经过糖基化等修饰过程,导致与BoPAGs前体差异较大[9],所以人们常采用重组表达的方式获得BoPAGs蛋白。早期妊娠检测蛋白主要有PAG1、PAG4、PAG6、PAG9、PAG16、PAG18、PAG19等,目前BoPAG1[10-11]、BoPAG2[12]、BoPAG6[13]、BoPAG4[14]、BoPAG7、BoPAG8[15]、BoPAG9[16-17]和BoPAG16[18]表达载体的构建已有报道,如杨亚军等[12,15]先对PAG的密码子进行了优化,后通过基因工程技术获得了高表达的PAG2、PAG7和PAG8蛋白,并分析了其生物信息学特征;刘长彬等[10,17-18]在中国仓鼠卵巢细胞中瞬时转染并成功表达了PAG1、PAG9和PAG16蛋白;而BoPAG19蛋白的研究鲜见报道。鉴于此,本研究选取BoPAG19作为研究对象,通过其氨基酸序列体外合成核苷酸序列,用常规PCR获得目的片段,构建pcMV3-BoPAG19真核表达载体,并在真核细胞HEK-293F中诱导表达并纯化重组BoPAG19蛋白,分析其生物信息学特征,以期为研究BoPAG19的生物学功能和研发新的早期妊娠诊断方法奠定基础。
1 材料与方法
1.1 材料
1.1.1 细胞株和载体 pcMV3-Entry Vector和大肠杆菌DH5α感受态细胞均购自上海易汇生物科技有限公司;人胚肾细胞HEK-293F购自上海弘顺生物科技有限公司。
1.1.2 主要试剂及仪器 质粒小提试剂盒、BCA蛋白定量试剂盒、蛋白质分子质量标准、DL2000 DNA Marker、DL10000 DNA Marker和无内毒素质粒大提试剂盒均购自北京冬璞泰和科技有限责任公司;Lipofectamine®2000转染试剂购自北京明阳科华生物科技有限公司;T4 DNA连接酶、KpnⅠ和XbaⅠ限制性内切酶均购自北京NEB生物科技有限公司;细胞基础培养基和血清均购自北京同立海源生物科技有限公司。
组氨酸标签蛋白纯化磁珠和磁性分离器均购自苏州海狸生物医学工程有限公司;JL-PZY96BT型PCR扩增仪购自上海靳澜仪器制造有限公司;D180-P型CO2培养箱购自深圳市瑞沃德生命科技有限公司。
1.2 方法
1.2.1 pcMV3-BoPAG19重组质粒的构建 在GenBank数据库中查找BoPAG19基因序列(NM_176628),于5′-端加入KpnⅠ酶切位点,去掉原有信号肽序列加入增强分泌型信号肽和Kozak序列;于3′-端加入6个His序列和XbaⅠ酶切位点,质粒图谱见图1。BoPAG19基因由南京金斯瑞基因公司合成。针对合成基因序列,利用Primer Premier 5.0软件设计引物,引物序列为:上游引物:5′-GCCGCCACCAAGCTTGGTACCATGAAGTG-GCTGGTGGTGC-3′;下游引物:5′-TCGGCGGCC-GCTCTAGATTTAATGGTGATGATGGTGGTG-ATGGTGG-3′。引物由南京金斯瑞基因公司合成。
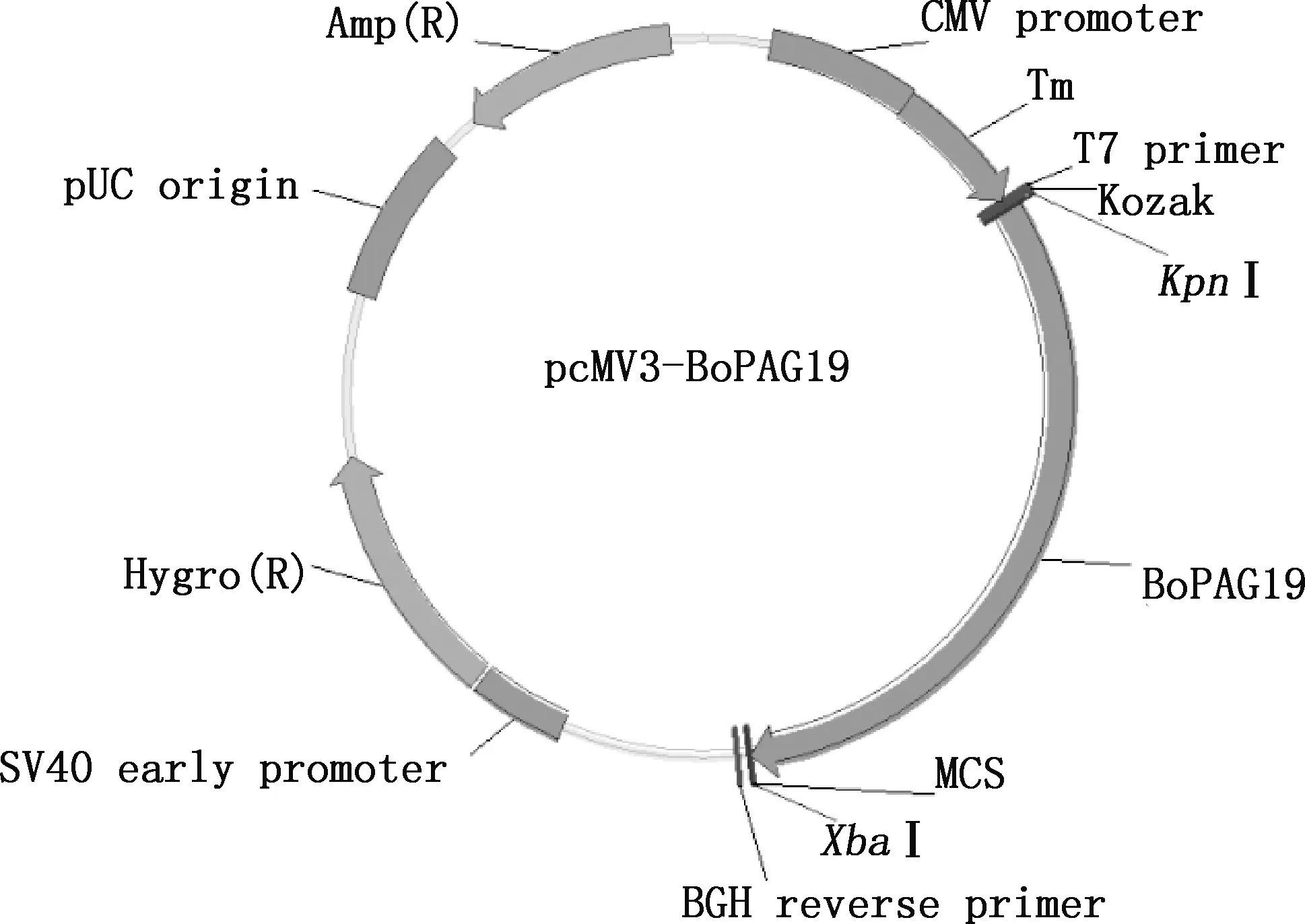
图1 pcMV3-BoPAG19载体构建图Fig.1 Construction diagram of pcMV3-BoPAG19 vector
PCR反应体系25 μL:10×ExTaqBuffer 2.5 μL,dNTP Mix 1 μL,引物各0.5 μL,模板0.5 μL,ExTaq酶0.5 μL,ddH2O 19.5 μL。PCR反应条件:95 ℃预变性5 min;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min,共30个循环;72 ℃延伸10 min。PCR产物经1.0%琼脂糖凝胶电泳检测后,对鉴定正确的PCR产物与pcMV3表达载体进行双酶切。 双酶切反应体系10 μL:目的片段/载体8 μL,KpnⅠ酶0.5 μL,XbaⅠ酶0.5 μL,10×Buffer 1 μL。胶回收双酶切产物,T4 DNA连接酶连接,连接产物转化大肠杆菌DH5α感受态细胞,涂板,37 ℃倒置培养。
1.2.2 pcMV3-BoPAG19重组质粒鉴定 挑取单菌落,接种于LB培养基,37 ℃、180 r/min振荡培养24 h,提取质粒进行双酶切验证,双酶切反应体系10 μL:质粒8 μL,KpnⅠ酶0.5 μL,XbaⅠ酶0.5 μL,10×Buffer 1 μL。37 ℃酶切1 h,酶切产物经1.0%琼脂糖凝胶电泳检测。采用无内毒素质粒大提试剂盒进行质粒的大量提取,-20 ℃保存备用。
1.2.3 pcMV3-BoPAG19瞬时转染及表达 37 ℃复苏HEK-293F细胞,800 r/min离心5 min,弃上清,加30 mL无血清培养基重悬,37 ℃、5% CO2培养箱中175 r/min振荡培养约18 h;当细胞密度达到1×104/mL、细胞汇合度>95%时,以0.5×104/mL密度进行传代;当细胞密度再次达到3.0×106/mL时进行转染。取30 μg pcMV3-BoPAG19重组质粒与120 μL Lipofectamine®2000转染试剂混合,室温静置15 min,缓慢滴加到细胞中,37 ℃、5% CO2培养箱中175 r/min振荡培养,18~22 h后加入5%补料培养基Transpro feed 1。当细胞汇合度<60%时停止培养(6 d),收集培养物并离心,取上清备用。
1.2.4 BoPAG19重组蛋白纯化 将收集到的10 mL HEK-293F细胞上清,12 000 r/min离心30 min,备用。根据磁珠使用说明,取10 mL磁珠悬液置于15 mL离心管中,置于磁性分离器上进行磁性分离,弃上清;将离心后的细胞上清加入含有磁珠的离心管中,4 ℃旋转混合1 h,置于磁性分离器上进行磁性分离,弃上清;向磁珠中加入10 mL Washing Buffer(PBS缓冲液,pH 7.4)洗涤2次,再次磁性分离,分别采用20、100和200 mmol/L咪唑的Elution Buffer(2 mL)洗脱磁珠,磁性分离后,收集洗脱液;采用截留分子质量为10 ku的超滤管将洗脱液浓缩50倍,SDS-PAGE和Western blotting法鉴定纯化蛋白,并通过BCA法测定纯化后的蛋白浓度[14]。
1.2.5 结构和功能预测分析 通过ProtParam在线软件(https:∥web.expasy.org/protparam/)预测BoPAG19蛋白的理化性质;通过SignalP 5.0 Server在线软件(https:∥services.healthtech.dtu.dk/service.php?SignalP-5.0)预测BoPAG19蛋白的信号肽;通过TMHMM v.2.0 Server在线软件(http:∥www.cbs.dtu.dk/services/TMHMM/)预测BoPAG19蛋白的跨膜结构;通过YinOYang v.1.2 Server在线软件(http:∥www.cbs.dtu.dk/services/YinOYang/)预测BoPAG19蛋白糖基化位点;通过IEDB在线数据库预测BoPAG19蛋白的线性B细胞抗原表位;通过SOPMA(https:∥npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopma.html)和Phyre2(http:∥www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)等在线软件预测BoPAG19蛋白的二级结构和三级结构;通过STRING在线工具(https:∥cn.string-db.org/)预测BoPAG19蛋白-蛋白相互作用[15]。
2 结 果
2.1 pcMV3-BoPAG19载体鉴定
对构建的重组载体pcMV3-BoPAG19进行PCR和双酶切鉴定,结果见图2。由图2可知,目的基因片段长约1 200 bp,与预期大小一致;双酶切后获得2条线性片段,分别为目的基因和载体片段,其中目的基因片段大小与BoPAG19基因大小相符,且酶切条带单一,表明重组载体构建成功。

M1,DL2000 DNA Marker;1,BoPAG19基因PCR扩增;M2,DL10000 DNA Marker;2,重组质粒pcMV3-BoPAG19 PCR扩增;3,重组质粒pcMV3-BoPAG19双酶切鉴定M1,DL2000 DNA Marker;1,PCR amplification of BoPAG19 gene;M2,DL10000 DNA Marker;2,PCR amplification of recombinant plasmid pcMV3-BoPAG19;3,Double digestion identification of recombinant plasmid pcMV3-BoPAG19图2 BoPAG19基因PCR扩增和pcMV3-BoPAG19双酶切鉴定Fig.2 PCR amplification of BoPAG19 gene and double restriction digestion of pcMV3-BoPAG19
2.2 BoPAG19重组蛋白的纯化
瞬时转染后取HEK-293F细胞上清进行磁珠纯化,洗脱液浓缩50倍后经SDS-PAGE分析,结果显示,100 mmol/L咪唑洗脱时BoPAG19蛋白纯度和浓度最高,BoPAG19蛋白分子质量约60 ku(图3),与预期大小相符。Gel-Pro Analyzer软件灰度分析结果显示,BoPAG19蛋白纯度高达98.4%;BCA蛋白浓度检测结果显示蛋白浓度为1.27 mg/mL;纯化蛋白经Western blotting分析发现,能够与抗PAG19抗体发生特异性结合(图4)。
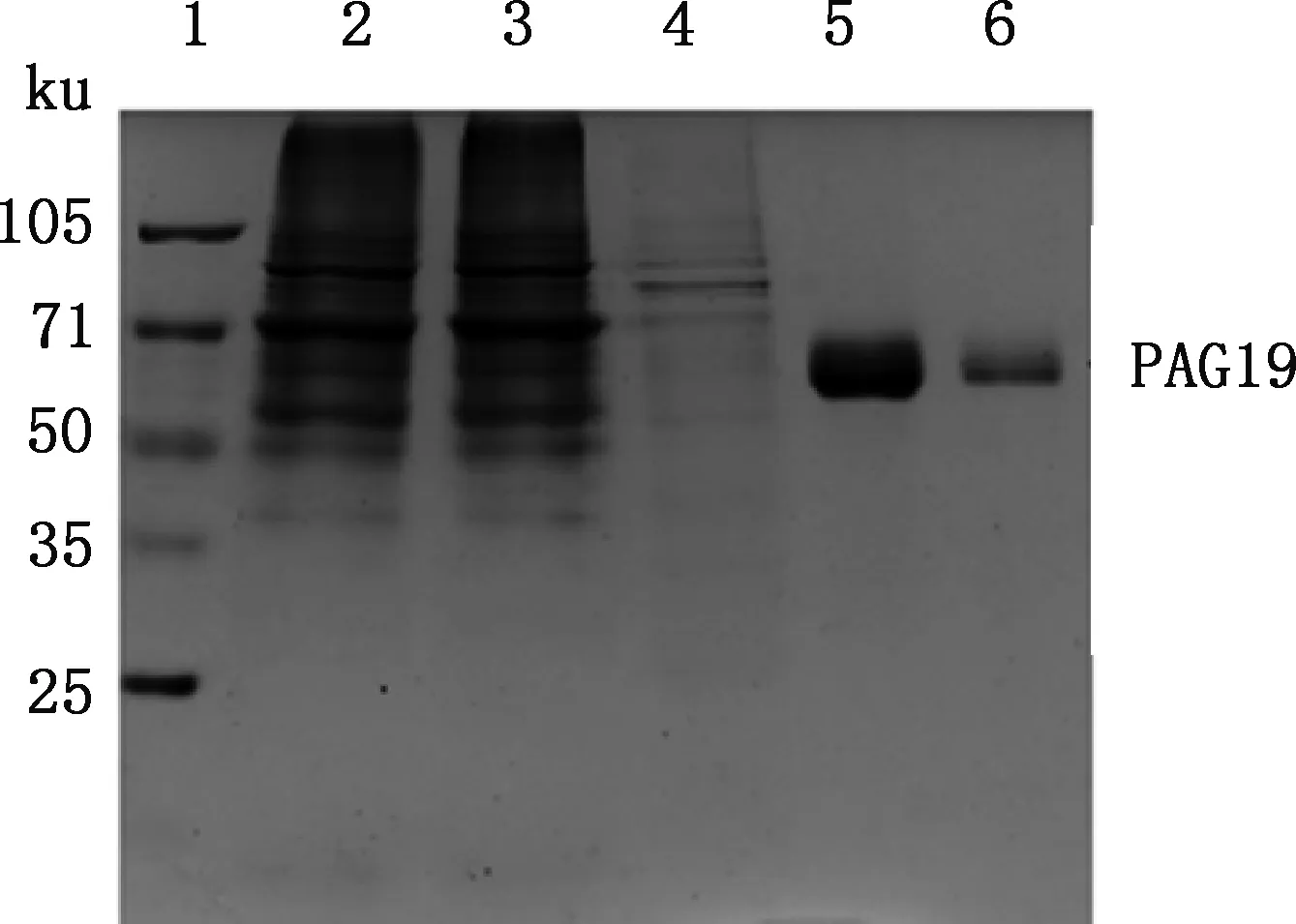
1,蛋白质分子质量标准;2,纯化前细胞上清;3,洗涤液;4~6,20、100及200 mmol/L咪唑1,Protein Marker;2,Cell supernatant;3,Washing buffer;4-6,20,100 and 200 mmol/L imidazole,respectively图3 SDS-PAGE分析BoPAG19蛋白Fig.3 SDS-PAGE analysis of BoPAG19 protein

1,蛋白质分子质量标准;2,商用BoPAG19蛋白;3,纯化BoPAG19蛋白1,Protein Marker;2,Commercial BoPAG19 protein;3,Purified BoPAG19 protein图4 Western blotting分析BoPAG19蛋白Fig.4 Western blotting analysis of BoPAG19 protein
2.3 生物信息学分析
2.3.1 理化性质 利用ProtParam软件对BoPAG19蛋白进行分析发现,该蛋白分子式为C1937H3028N524O532S15,分子质量为41.8 ku,等电点为9.62,亲水性平均值(grand average of hydropathicity,GRAVY)为-0.03,为两性蛋白,蛋白质不稳定指数为40.75,在水中不稳定;含有380个氨基酸,其中含量最高的是丝氨酸(9.2%),含量最低的是色氨酸(1.6%)(表1)。脂肪系数为91.53,消光系数为52 370 mol-1·cm-1,半衰期为30 h。
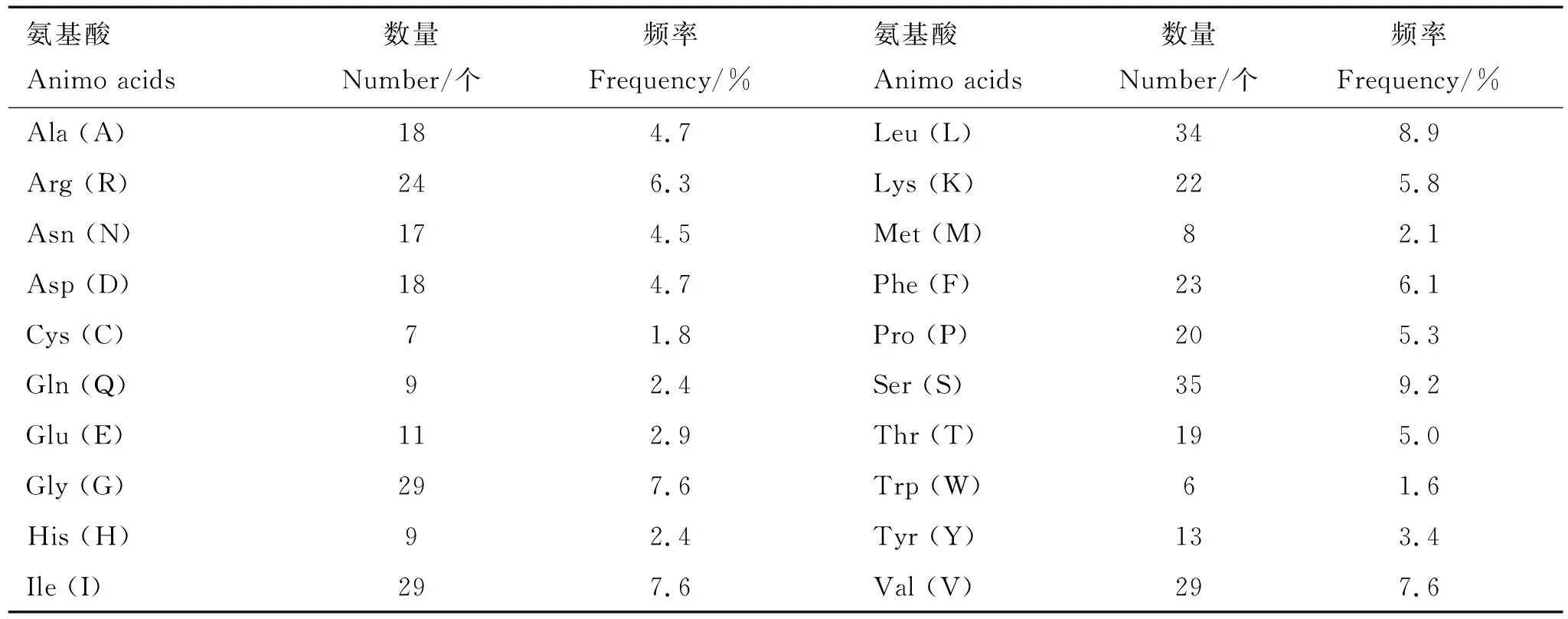
表1 BoPAG19蛋白的氨基酸组成Table 1 Animo acid composition of BoPAG19 protein
2.3.2 信号肽和跨膜结构预测 经SignalP 5.0 Server软件对BoPAG19蛋白信号肽进行预测,该蛋白N-端前15个氨基酸为信号肽(图5)。经TMHMM v.2.0 Server软件对BoPAG19蛋白的跨膜结构区进行预测,BoPAG19蛋白无跨膜区域(图6)。

图5 BoPAG19蛋白信号肽预测Fig.5 Signal peptide prediction of BoPAG19 protein
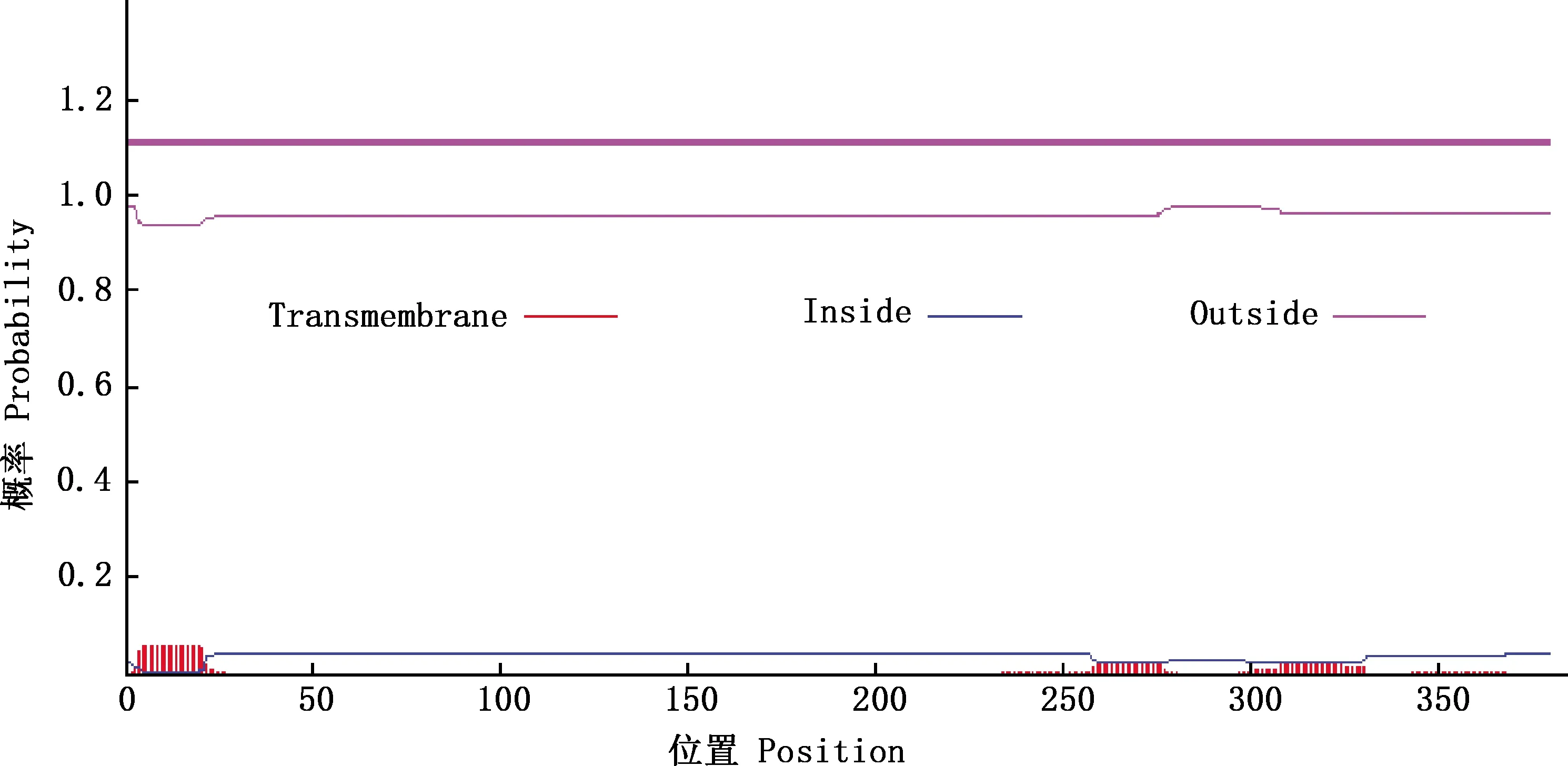
图6 BoPAG19蛋白跨膜结构预测Fig.6 Transmembrane prediction of BoPAG19 protein
2.3.3 糖基化位点预测 经YinOYang 1.2 Server在线软件对蛋白糖基化位点进行分析,结果显示,该蛋白共存在6处糖基化位点,分别为Ser92、Thr127、Thr154、Ser184、Ser185和Ser297(图7)。
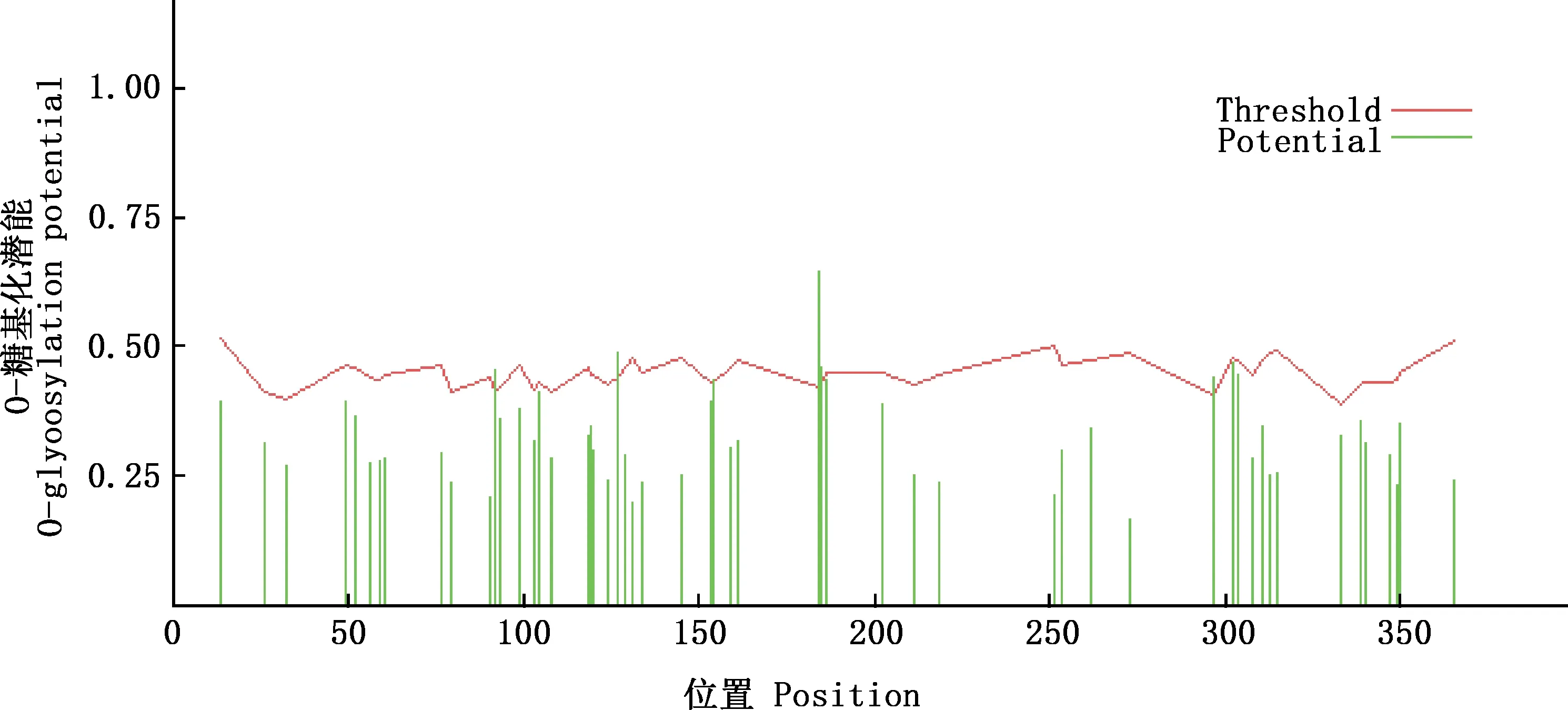
图7 BoPAG19蛋白O-糖基化位点预测Fig.7 O-glycosylation prediction of BoPAG19 protein
2.3.4 抗原表位预测 经IEDB在线数据库对BoPAG19蛋白的线性B细胞抗原表位进行预测,结果显示,该蛋白共发现11段优势区段(图8),具体抗原表位序列见表2。
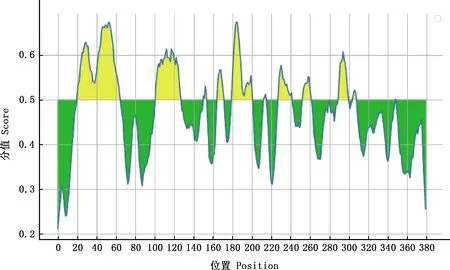
图8 BoPAG19蛋白的线性B细胞表位预测Fig.8 Linear B cell epitopes prediction of BoPAG19 protein

表2 抗原表位序列Table 2 Antigenic epitope sequence
2.3.5 二级结构和三级结构 经SOPMA在线软件对BoPAG19蛋白的二级结构进行预测,结果显示,该蛋白主要以α-螺旋、β-转角、无规则卷曲和延伸链组成,占比分别为18.95%、6.32%、42.37%和32.37%(图9)。 经Phyre2在线软件对BoPAG19蛋白的三级结构进行预测,结果与二级结构一致(图10)。

h,α-螺旋;t,β-转角;c,无规则卷曲;e,延伸链h,Alpha helix;t,Beta turn;c,Random coil;e,Extended chain图9 BoPAG19蛋白的二级结构预测Fig.9 Secondary structure prediction of BoPAG19 protein
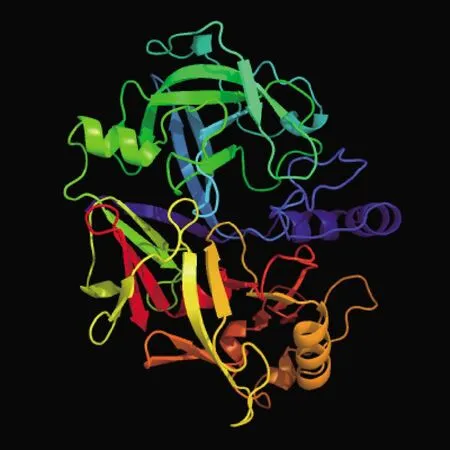
图10 BoPAG19蛋白的三级结构预测Fig.10 Tertiary structure prediction of BoPAG19protein
2.3.6 蛋白相互作用分析 通过STRING在线软件预测BoPAG19蛋白的相互作用,结果显示,与BoPAG19互作的蛋白包括β-淀粉样前体样蛋白2(amyloid beta (A4) precursor-like protein 2,APLP2)和β-淀粉样蛋白(amyloid-beta A4 protein,APP)(图11、表3)。
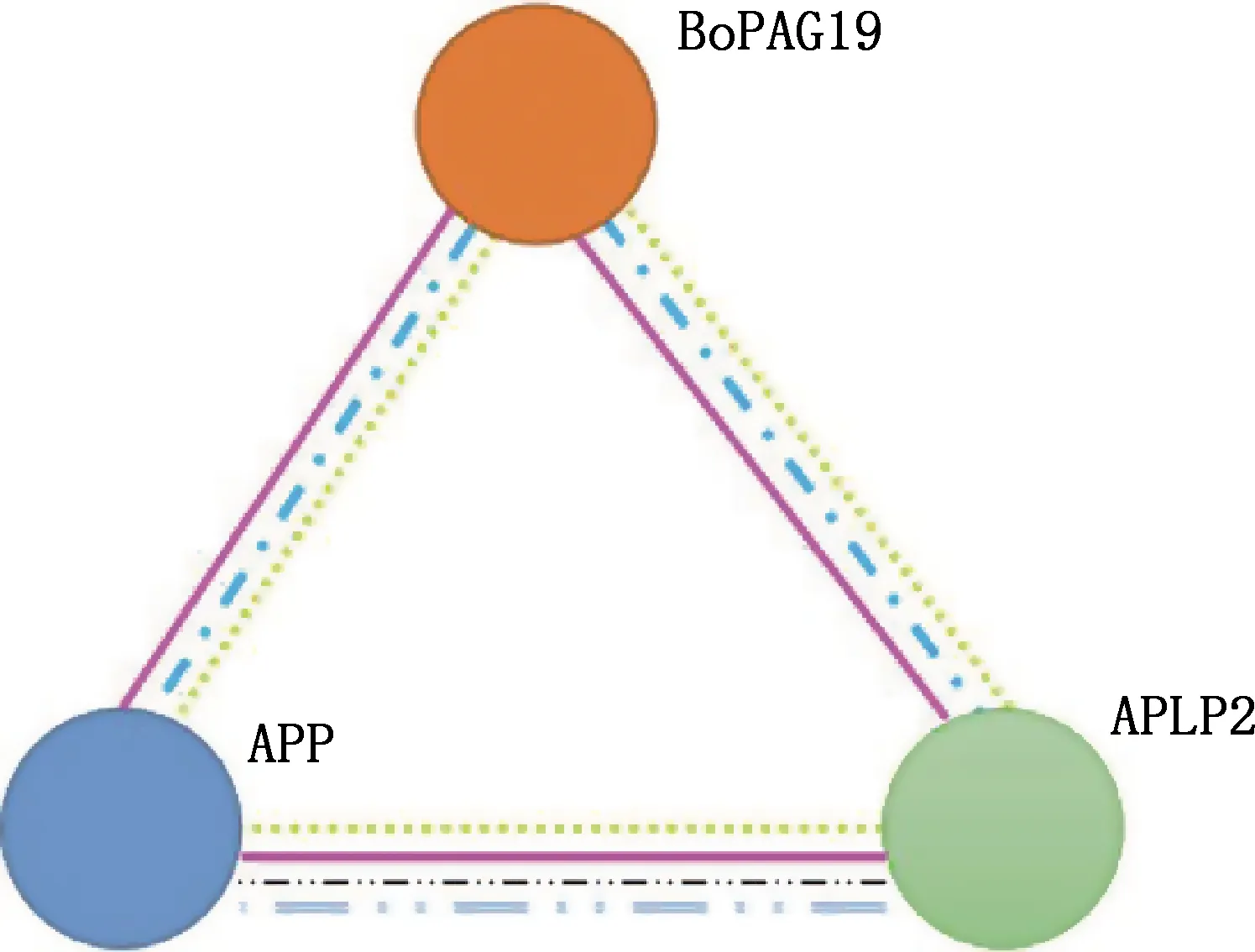
图11 BoPAG19蛋白相互作用Fig.11 Interactions of BoPAG19 protein

表3 BoPAG19蛋白功能预测及结构域Table 3 Functional prediction and domain of BoPAG19 protein
3 讨 论
目前,在牛、羊、鹿等多种偶蹄动物的胎盘上皮细胞层中发现了100多种编码PAG的基因,其中BoPAGs有21种,它们的序列差异至少5%[2],根据PAG蛋白是否保留了蛋白水解活性,将BoPAGs蛋白分成“古代组”和“现代组”[19-20],“现代组”包括了大多数BoPAGs,它们的催化中心发生了碱基突变,因此失去了蛋白水解酶活性,PAG19就是结构中DTG模体羧基端常为苏氨酸的位置突变为异亮氨酸,因此PAG19属于“现代组”[2]。“现代组”如BoPAG1、BoPAG9和BoPAG21,因仅在滋养层细胞亚群(也叫双核细胞)中表达,被认为在着床和胎盘形成过程中发挥了重要的作用[21],也可能具有免疫调节活性和催乳活性[22]。PAGs和孕促性腺激素受体存在相互作用,可能参与了黄体保护与妊娠维持的调节[23]。尽管对PAG蛋白有着不同的研究和推测,但PAG真正的功能目前尚不清楚,关于PAG19更是鲜有报道,在NCBI数据库中仅能查询到在水牛(Bubalusbubalis)和奶牛(Bostaurus)中有PAG19的表达。
在目的基因和蛋白缺少足够的试验依据的情况下,可利用生物信息学技术对研究的蛋白进行预测,并与其他物种进行比对分析,这对后续的功能性试验有一定的指导作用[12]。成熟的PAGs约有330个氨基酸,其理论分子质量为37 ku,但是糖基化后的PAGs蛋白分子质量几乎翻倍(约67 ku),糖基化对蛋白分泌、防止蛋白水解、抗原识别和生物学功能等方面均发挥重要作用[24]。杨亚军等[12]制备的分泌型BoPAG2蛋白,分子质量为68 ku,含有5个糖基化位点,有7个互作蛋白,通过互作蛋白预测,BoPAG2可能参与了消化吸收和妊娠期调节功能。刘长斌等[17]制备的BoPAG9也采用了HEK-293F真核表达系统,获得了分子质量约68 ku、纯度为90%的蛋白。本试验在HEK-293F细胞表达并纯化后的BoPAG19分子质量约60 ku,大于其理论值44 ku,说明蛋白糖基化修饰和磷酸化修饰是分子质量大于理论值的主要原因。
最新的结构建模研究表明,“现代组”PAGs虽然失去了蛋白水解酶活性,但是可能保留了短肽结合能力[25]。PAGs蛋白结构中有一个肽/底物结合裂隙及N-和O-连接的糖基侧链,可以结合类似于植物凝血素和整合素的蛋白,甚至可以作为某些蛋白的对接位点,隔绝或运输蛋白,发挥免疫调节的作用[4],只是这些底物结合位点的功能目前还不明确。结构域预测显示,PAG19含有与APP结合的结构域,能与肽结合,且具有天冬氨酸型内肽酶活性,而APP在细胞基质沉积后具有很强的神经毒性作用,能够诱导海马神经细胞凋亡[26-27]。有报道显示,APP沉积与阿尔茨海默疾病等神经退行性疾病的发生有关[28]。PAG19可能通过在胎盘-子宫界面与APP结合,减少妊娠期APP的沉积和分泌,保护和调节神经系统发育。但PAG19是否调节了神经发育的相关过程,以及是否能用于牛早期妊娠诊断,还缺乏试验依据,仍有待进一步研究。
4 结 论
本研究成功克隆了BoPAG19基因,全长1 200 bp,编码380个氨基酸,无跨膜结构,有1个信号肽,属于不稳定、亲水分泌型蛋白质,具有6个糖基化位点和11个B细胞表位;α-螺旋、β-转角、无规则卷曲和延伸链所占比例分别为18.95%、6.32%、42.37%和32.37%;BoPAG19蛋白与APLP2和APP蛋白有相互作用;成功构建了pcMV3-BoPAG19重组质粒,并在HEK-293F细胞中表达,纯化获得的BoPAG19蛋白纯度高达98.4%,为BoPAG19蛋白的功能研究和临床诊断提供参考。
——一道江苏高考题的奥秘解读和拓展

