Piezo1/JAK2信号通路与膝骨关节炎大鼠软骨细胞凋亡的关系
王勇,王强,邢宇庆,刘芙君,苏日亮,马金健
1 山东第一医科大学附属省立医院推拿科,济南 250021;2 山东中医药大学附属医院推拿科
膝骨关节炎(KOA)是临床常见的一类骨关节疾病,是引起中老年人膝痛的最常见原因,严重影响人们的生活和工作。60 岁以上的人群中,有症状的KOA 可达 50%[1]。软骨细胞凋亡被认为是 KOA 重要的病理机制之一。软骨细胞凋亡的数量与KOA的严重程度密切相关[2]。Piezo1 通道蛋白是 2010 年被发现的[3],是一种机械敏感性离子通道蛋白,也是一种非常重要的膜通道。细胞学研究发现,Piezo1可以介导软骨细胞膜受到牵张力所形成的内电流,从而证实了其在软骨细胞力学传导中的作用[4]。KOA 患者膝关节力的传导和分布出现异常,可使软骨细胞受到异常的机械牵张应力,从而导致膝关节软骨细胞的过度凋亡[5-6]。细胞学研究发现,对软骨细胞施加不同时长的机械牵张应力,可以激活Piezo1 通道,从而介导软骨细胞的凋亡[7-8]。但是目前并无动物实验对此加以印证。研究发现,蛋白酪氨酸激酶2/信号转导子与激活子3(JAK2-STAT3)信号通路与软骨细胞凋亡密切相关[9-12],但是目前Piezo1 与JAK2 在软骨细胞凋亡过程中的作用鲜见相关报道。2021 年1 月—7 月,我们观察了Piezo1/JAK2 信号通路与KOA 大鼠软骨细胞凋亡的关系。现报告如下。
1 材料与方法
1.1 动物、试剂及仪器 清洁级成年雄性SD 大鼠50 只,体质量(120 ± 10)g,购于山东大学实验动物中心,合格证号:SCXK(鲁)20110014。普通饮食饲养于山东第一医科大学附属省立医院动物实验中心,适应性喂养1 周,饲养环境温度20~25 ℃,昼夜明暗交替时间为12 h/12 h。苏木精染色试剂盒(杭州昊鑫生物科技股份有限公司),小鼠抗大鼠Piezo1一抗、小鼠抗大鼠JAK2 一抗、小鼠抗大鼠p-JAK2 一抗、Caspase-3 抗体试剂盒、BCA 蛋白定量试剂盒(美国领先化学公司),HRP 标记的二抗、DAB 染色试剂盒、抗地高辛抗体、蛋白电泳Marker(济南柠檬生物技术有限公司),固绿染色液、番红O染色液、酶标仪(杭州昊鑫生物科技股份有限公司),照相显微镜(日本佳能公司),Image-Pro plus6.0 系统(美国Media Cybernetics公司)。
1.2 动物分组与模型构建 将大鼠随机分为假手术组(10只)和模型组(40只)。模型组采用Hulth 法建立大鼠KOA 模型[13],手术当天大鼠禁食不禁水,将其仰卧固定于手术台上,经腹腔注射氯胺酮(100~200 mg/kg)麻醉后剪除其右后肢膝关节内侧绒毛,于髌骨内侧剪开皮肤,手术切口约1 cm长,逐层寻找膝关节内侧副韧带,充分暴露内侧副韧带后将其剪断;切开关节囊,观察大鼠是否存在原发性膝关节病变,剔除存在膝关节病变大鼠。将整个内侧半月板完整切除,采用虹膜剪将大鼠前后交叉韧带剪断。常规缝合手术切口,无菌包扎固定。术后肌注青霉素80 000 U,1 次/天,连续肌注3 d。伤口每日换药1次,连续换药7 d。术后第2 天正常饮食饮水,每天观察大鼠伤口有无感染和动物跛行情况,并强迫驱赶动物活动30 min。假手术组充分麻醉后立即取出右后肢膝关节软骨组织,再断颈处死。模型组分别于术后7、30、60、90 d 各取10 只断颈处死,分别取出右后肢膝关节软骨组织。所有软骨组织置于10%甲醛以及-80°C冰箱中备用。
1.3 膝关节软骨组织病理变化观察 采用番红O-固绿染色法[14-15]。切除的关节软骨组织用生理盐水洗涤,拭干后用10%甲醛溶液固定24 h,以防抗原丢失;将软骨组织放入混合酸脱钙液中脱钙24 h;常规石蜡包埋,切片(厚度5 µm)。石蜡切片65 ℃脱水4 h,用不同浓度二甲苯和乙醇自动脱蜡至水;滴加苏木精,细胞核染色1~3 min,镜下观察染色深浅情况以调整染色时间;用自来水洗涤残留的苏木精;滴加盐酸乙醇分化液,分化20 s,自来水洗涤;滴加0.02%固绿水溶液,使细胞外基质染色3 min,1%冰醋酸洗涤3 次,滴加0.1%番红水溶液,3 min 后95%乙醇浸洗,无水乙醇脱水;二甲苯透明3 次,每次2 min,中性树胶封片。用显微镜(×200)观察关节软骨的结构、色泽及各层软骨细胞的形状、数量、排列、坏死程度等。
1.4 膝关节软骨细胞凋亡检测 采用TUNEL 染色法。在烤片机将待染色切片在65 ℃烘烤2 h,常规二甲苯脱蜡剂脱蜡2 次;分别用无水乙醇、90%乙醇、85%乙醇和75%乙醇脱水,直至脱蜡水化完全,PBS 浸 泡 5 min。 滴 加 3% H2O2,10 min 后 滴 加Proteinase K 工作液,37 ℃恒温消化10 min。每张切片滴加Labeling buffer标记的缓冲液20µL以保持其湿润,配制工作液后甩去多余液体,然后每张切片加工作液20 µL,湿盒内37 ℃恒温孵育2 h;滴加封闭液50µL,封闭30 min;滴加稀释的生物素化的抗地高辛抗体(1∶100 稀释)50 µL,湿盒37 ℃恒温孵育2 h。滴加SABC 抗体稀释液(1∶100 稀释)10 µL,湿盒37 ℃恒温孵育2 h。滴加DAB 显色工作液(试剂A、B、C 各50 µL,溶于 1 000 µL 蒸馏水),显色10~15 min,呈棕黄色颗粒状时显色完全,苏木精复染3 s。梯度脱水透明处理后,室温晾干后中性树胶小心封片,注意避免留气泡和溢胶,晾干。200 倍光学显微镜下观察,用Image-Pro plus6.0 软件分析阳性染色面积,并根据阳性染色情况判断软骨细胞凋亡程度。TUNEL 染色阳性区域范围越大,软骨细胞凋亡程度越严重。
1.5 膝关节软骨细胞破坏程度评价 采用Mankin's 评分,通过膝关节软骨组织病理变化的情况评价大鼠 KOA 模型[16]。Mankin's 评分越高,软骨细胞破坏越严重。
1.6 膝关节软骨组织中Piezo1、JAK2、p-JAK2、Caspase-3 蛋白表达检测 采用Western blotting 法。将膝关节软骨组织置冰上,用显微剪将组织剪碎,按20 mg 组 织 加 入 200 µL 裂 解 液 和 PMSF 混 合 液(100∶1),研磨器研磨组织;组织裂解完全后,转移至EP管中,15 000 r/min离心30 min(离心半径10 cm);吸取上清液2 µL,用蒸馏水稀释,检测蛋白浓度。BCA法测定蛋白浓度,缓慢加入电泳缓冲液,用70 V恒压预电泳30 min。向侧孔中加入标准Marker 蛋白,首先30 V 恒压电泳,待样品浓缩在浓缩胶与分离胶之间并呈一条线后,调整电压为100 V,溴酚蓝条至胶板下缘时,停止电泳。将大小适宜的PVDF膜浸泡于甲醇中10 min,按顺序安装后闭合夹子,将夹子置转膜槽,电压100 V,电流220 mA 进行转膜。将转膜的PVDF 膜在含5%脱脂牛奶的TBST 缓冲液浸泡,室温封闭1 h,倾去封闭液,然后将PVDF 膜浸泡在稀释好的小鼠抗大鼠Piezo1、JAK2、p-JAK2 及Caspase-3 一抗(稀释比均为 1∶100)中,水平摇床4 ℃过夜,第2 天回收。加入HRP 标记的山羊抗小鼠IgG 荧光二抗(稀释比1∶100),室温孵育1 h,弃去二抗加入ECL 发光液,以GAPDH 为内参照。Image J 软件分析蛋白电泳条带灰度值。蛋白相对表达量=目的蛋白电泳条带灰度值/内参照蛋白电泳条带灰度值。
1.7 统计学方法 采用SPSS20.0 统计软件。符合正态分布的计量资料用表示,多组比较采用方差分析,进一步两两比较采用LSD-t检验;指标间的相关性分析采用Pearson 相关法。P<0.05 为差异有统计学意义。
2 结果
2.1 两组膝关节软骨组织病理变化比较 假手术组软骨正常呈红色,软骨下骨呈蓝色。番红O-固绿染色可见软骨纵切片潮线,潮线上方透明软骨,潮线下方钙化层,钙化层底部粘合线界限明显。潮线与粘合线口间可见齿梳样结构钙化软骨,厚度可达300µm,薄处不足10µm,结构致密,潮线附近可见少量肥大软骨细胞。术后7~90 d,模型组膝关节关节软骨破坏逐渐加重。术后7 d,关节软骨变为粉红色,出现多条潮线,钙化层增厚;术后30 d,钙化层进一步变宽,伴少量血管显现;术后60~90 d,钙化层及非钙化层进一步退变,表现为局部有纤维样增生潮线距离进一步增大,软骨细胞明显减少并集中在潮线附近。
2.2 两组软骨细胞凋亡情况 假手术组及术后7、30、60、90 d 模型组 TUNEL 染色阳性区域分别为(3.17 ± 0.05)% 、(10.98 ± 2.01)% 、(18.62 ±4.37)%、(25.34 ± 6.81)%、(47.55 ± 7.10)%。与假手术组比较,术后7、30、60、90 d模型组TUNEL 染色阳性区域均增大(P均<0.05),且随时间延长TUNEL染色阳性区域逐渐增大。
2.3 两组软骨破坏情况比较 假手术组及术后7、30、60、90 d 模型组 Mankin's 评分分别为(0.36 ±0.08)、(4.75 ± 0.72)、(7.67 ± 0.22)、(9.07 ±0.32)、(10.67 ± 0.22)分。与假手术组比较,术后7、30、60、90 d 模型组 Mankin's 评分均高(P均<0.05),且随时间延长Mankin's评分逐渐升高。
2.4 两组膝关节软骨组织内Piezo1、JAK2、p-JAK2及Caspase-3蛋白表达比较 与假手术组比较,术后7、30、60、90 d 模型组 Piezo1、JAK2、p-JAK2 及 Caspase-3 蛋白表达均高(P<0.05),且随时间延长各蛋白表达逐渐升高。见表1。
表1 两组膝关节软骨组织Piezo1、JAK2、p-JAK2及Caspase-3蛋白表达比较()
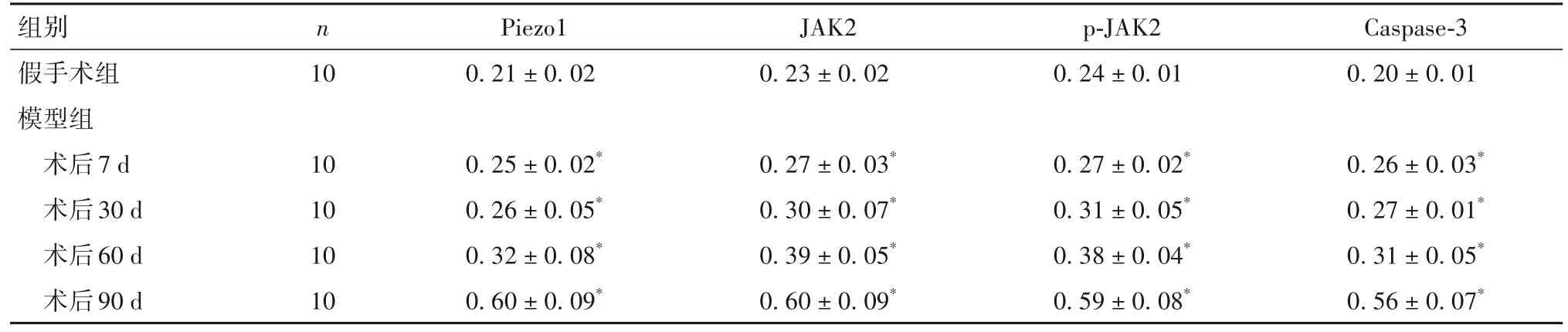
表1 两组膝关节软骨组织Piezo1、JAK2、p-JAK2及Caspase-3蛋白表达比较()
注:与假手术组比较,P<0.05。
组别假手术组模型组术后7 d术后30 d术后60 d术后90 d n 10 Piezo1 0.21±0.02 JAK2 0.23±0.02 p-JAK2 0.24±0.01 Caspase-3 0.20±0.01 0.26±0.03*0.27±0.01*0.31±0.05*0.56±0.07*10 10 10 10 0.25±0.02*0.26±0.05*0.32±0.08*0.60±0.09*0.27±0.03*0.30±0.07*0.39±0.05*0.60±0.09*0.27±0.02*0.31±0.05*0.38±0.04*0.59±0.08*
2.5 软骨细胞凋亡情况与Mankin's 评分及Piezo1、JAK2、p-JAK2 及 Caspase-3 蛋白表达的关系 Pear-son 相关分析结果显示,关节软骨TUNEL 染色阳性区域与 Mankin's 评分(r=0.781,P<0.05)、Piezo1 蛋白表达(r=0.577,P<0.05)、JAK2 蛋白表达(r=0.725,P<0.05)、p-JAK2 蛋白表达(r=0.798,P<0.05)以及Caspase-3 蛋白表达(r=0.691,P<0.05)存在正相关关系。
3 讨论
KOA 是临床最常见的一种无菌性炎症性骨关节病,是由多种因素导致的一种以软骨破坏、软骨下骨骨化或囊性变、滑膜炎症、关节囊挛缩、肌无力等为特征的慢性疾病。目前,大多数研究者认为,生物力学因素在KOA 的发生发展中起着至关重要的作用[17]。膝关节软骨细胞能够感受力学的变化,通过力敏感离子通道激活相关的信号传导通路影响软骨细胞的分化、凋亡等,从而影响KOA 的病程发展与变化[18]。
KOA 的发生发展与软骨细胞凋亡密切相关,是KOA 发生发展的重要病理机制之一,已经成为了目前研究的热点。KOA 软骨细胞凋亡的机制与信号通路的研究越来越受到重视。Piezo 离子通道属于机械敏感性离子通道,可将细胞膜接收到的机械力学信号、电信号或化学信号,传递至胞内,引起一系列 生化 反应[19],并 能 调节 细胞 体积 的稳 态[20]。Piezo1 在哺乳动物细胞中几乎无处不在,是一种非常重要的膜通道,软骨细胞受到细胞外界环境中的力学刺激后通过Piezo1影响其增殖、分化及凋亡[21]。软骨细胞中Piezo1、Piezo2 高表达,在软骨细胞中应用 siRNA 能够抑制 Piezo1 和 Piezo2 表达,从而消除机械反应。同时,通过原子力显微镜/Ca2+成像平台检测Ca2+流入的机械响应发现,Piezo1 和Piezo2 均可导致软骨细胞在超生理压迫下的机械转导[22]。因此,本研究复制了大鼠KOA 模型,围绕不同时间节点大鼠软骨细胞Piezo1的变化展开研究。有实验发现,对细胞膜施以不同的牵张力可以激活Piezo1,加快膝关节软骨细胞的凋亡[7-8]。本实验中,我们观察了不同时间节点大鼠膝关节软骨细胞Piezo1 的表达,并与软骨细胞凋亡进行相关性分析,发现二者具有正相关性,与文献[7-8]报道一致。
JAK 蛋白包括 JAK1、JAK2、JAK3 以及 Tyk2。JAK 包含 1 个 FERM 域、1 个 SH2 相关域、1 个激酶结构域和1 个假激酶域。其中激酶域对JAK 活性至关重要,因为只有通过激酶域才能使JAK 磷酸化。JAK-STAT通路的研究主要集中在炎症性疾病、影响免疫系统的疾病及肿瘤性疾病,关于关节软骨凋亡的研究较少,目前主要集中在JAK2-STAT3 这个通路。通过检索共发现4 篇文献认为JAK2-STAT3 信号通路与软骨细胞凋亡密切相关[9-12]。我们研究发现,随着KOA 的进展,JAK2 蛋白表达升高,这与以上文献[9-12]结果一致。同时我们还发现,JAK2 蛋白表达升高与软骨细胞的凋亡密切相关,JAK2蛋白表达越高,软骨细胞凋亡越严重。Caspase途径是细胞凋亡的主要途径[23],Caspase-3 在细胞凋亡中起至关重要的作用,是细胞凋亡过程中最重要的终末剪切酶,被称为“死亡蛋白酶”,主要在凋亡的执行阶段发挥重要作用,损伤DNA,导致其复制、转录及修复受到严重损害[24-25]。陈喜德等[26]用大鼠制作 KOA 模型,采集不同时间段模型鼠的软骨组织,并检测Caspase-3蛋白的表达,结果发现,Caspase-3与软骨细胞凋亡程度呈正比。本研究结果与文献[26]报道一致。
本研究构建了KOA 大鼠模型,随着时间延长,模型大鼠膝关节软骨TUNEL 染色的阳性区域也随之增加,Mankin's评分逐渐升高,提示大鼠膝关节的病理性破坏程度逐渐加重,KOA 逐渐进展。本研究发现,随着骨关节病变的进展,KOA 大鼠膝关节软骨内Piezo1蛋白表达也随之升高,并伴有JAK2的激活。Pearson相关性分析显示,关节软骨TUNEL染色的阳性区域与 Piezo1、JAK2、p-JAK2 及 Caspase-3 蛋白表达存在明显的正相关关系。说明Piezo1/JAK2信号通路可能参与了KOA 膝关节软骨细胞的凋亡过程。
在研究过程中,因考虑雌性大鼠性别或体内激素水平可能对本实验造成的影响,本实验未选用雌性大鼠。同时,因实验条件受限,样本量较少;也未能对JAK2 的下游信号STAT3 做进一步研究,这将是我们未来研究的方向。

