洛哌丁胺诱导慢传输型便秘小鼠结肠肌间神经元的变化
付思齐,任冰冰,刘勇,姚志伟,王博,孙大庆
天津医科大学总医院小儿外科,天津 300052
慢传输型便秘(STC)属于功能性便秘的一种,是指一类由结肠传输减慢,内容物通过延迟导致的顽固性便秘,主要表现为排便困难,排便次数减少,排便不尽感。最新资料显示,我国总体慢性便秘的患病率为10.9%,欧美患病率为10.1%,儿童和青少年高达30%,且便秘症状随年龄进行性加重,但其发生机制未明。大量研究表明,肠神经系统(ENS)功能紊乱、神经递质分泌失调与STC 的发病机制相关[1-2]。ENS 分为肌间神经丛和黏膜下神经丛,前者主要调控肠道平滑肌运动功能,后者调节肠道血流及黏膜分泌[3]。消化道全层铺片技术可直观地观察肠道肌间神经丛的变化,但目前相关的研究较少[4-5]。2021 年 4 月—11 月,本研究采用洛哌丁胺诱导的STC 小鼠模型,通过改良肠神经铺片技术和免疫荧光染色观察STC 模型小鼠结肠肌间神经元变化。
1 材料与方法
1.1 材料 SPF 级8 周龄雄性C57BL/6J 小鼠20只,体质量为20~23 g,均购于北京维通利华实验动物有限公司。小鼠饲养于天津医科大学总医院普外科研究所恒温动物房内,保证充足的进食和饮水,并严格遵守天津医科大学相关的动物使用规定。主要试剂仪器有:洛哌丁胺(美国Sigma-Aldrich 公司)、神经元特异性标志物HuC/D 抗体(Thermo Fisher Scientific 公司,1∶500)、神经纤维标志物 PGP9.5 抗体(Novus Biologicals 公司,1∶500)、神经型一氧化氮合酶(nNOS)抗体(Thermo Fisher Scientific 公司,1∶300)及 Caspase3 抗体(Cell Signaling Technology 公司,1∶300)、山羊抗兔红色荧光二抗(上海生工生物工程股份有限公司,1∶500)、山羊抗小鼠绿色荧光二抗(上海爱必信生物科技有限公司,1∶300)、驴抗鸡绿色荧光二抗(上海爱必信生物科技有限公司,1∶300),解剖显微镜(S7/OPMISensera,德国蔡司公司)、显微手术器械(中国美斯诺医疗器械有限公司)、正置荧光显微镜(日本OLYMPUS公司)。
1.2 动物分组及模型构建 将20 只8 周龄雄性C57BL/6J 小鼠适应性饲养1 周后随机分为对照组(CON 组)、慢传输型便秘组(STC 组),每组10 只。STC 组给予洛哌丁胺溶液(10 mg/kg)灌胃,每日2次,持续12 d;CON 组给予等量生理盐水灌胃,每日2次,持续12 d[6-7]。
1.3 小鼠一般情况、粪便性状观察 每天观察小鼠皮毛色泽、精神状态及活动度,并对小鼠体质量、摄食量进行监测。造模结束后禁食不禁水16 h,次日收集每只小鼠6 h 内粪便,记录粒数,然后对其称重并记录为粪便湿重。将粪便置于50 ℃恒温箱烘烤后称粪便干重,计算粪便含水量,粪便含水量(%)=(粪便湿重-粪便干重)/粪便湿重×100%。
1.4 肠道传输时间检测 造模结束后禁食不禁水16 h,次日将每只小鼠分单笼,给予印度墨水0.2 mL灌胃。每10 min 观察1 次,记录首粒黑便的排出时间,用于评估肠道传输时间。
1.5 改良肠神经全层铺片制备 粪便性状观察及肠道传输时间检测完成后,采用颈椎脱臼法处死小鼠,留取长约4 cm 的近端、远端结肠组织,使用生理盐水反复冲洗肠腔直至无残存粪便。取10 cm 培养皿在其底部铺放硅胶垫,将清洁后的结肠使用昆虫针固定其两端,使肠管稍有张力,加入冰生理盐水浸没肠管。在解剖显微镜下去除肠系膜缘残留的脂肪组织,从结肠任意端开始,使用两个眼科镊轻轻钳夹肠管浆膜及系膜缘,仔细轻柔的分离,使黏膜和纵行肌撕裂,但环形肌及内部的黏膜完整,缓慢的剥取结肠外纵行肌层。剥取完成以后剪成适当大小结肠全层铺片于4%多聚甲醛溶液中固定。
1.6 结肠HuC/D+、PGP9.5+和nNOS+神经元数目检测 采用免疫荧光染色法。将制备好的结肠全层铺片标本在0.5% Triton X-100 溶液中,室温破膜1 h,用 PBS 漂洗 3 次,每次 5 min;5%BSA 室温封闭2 h,降低非特异性染色;滴加适宜浓度的一抗,分别为HuC/D抗体(1∶500)、PGP9.5抗体(1∶500)、nNOS抗体(1∶300),4 ℃过夜;次日用PBS 漂洗3 次,每次5 min,滴加二抗,分别为山羊抗小鼠绿色荧光二抗(1∶300)、驴抗鸡绿色荧光二抗(1∶300)、山羊抗兔红色荧光二抗(1∶500),室温避光孵育1 h;再次用PBS漂洗3次,每次5 min,将铺片组织用眼科镊缓慢平铺于载玻片上,滴加含DAPI抗荧光衰减封片剂进行封片,室温放置30 min,于正置荧光显微镜下进行观察。HuC/D+信号、PGP9.5+信号均显绿色,nNOS+信号显红色。每张标本随机取5个不重合的高倍视野,分别计数HuC/D+和nNOS+神经元的数目(个/高倍镜视野),取平均值。每张标本随机取5 个不重合的高倍视野,测定PGP9.5荧光强度(AU/H),取平均值。
1.7 结肠HuC/D+神经元凋亡检测 采用免疫荧光共定位法。按上述步骤处理好标本,同时滴加HuC/D抗体(1∶500)和Caspase3抗体(1∶300),4 ℃过夜,次日用PBS漂洗3次,每次5 min,滴加山羊抗小鼠绿色荧光二抗(1∶300)、山羊抗兔红色荧光二抗(1∶500),余下步骤同免疫荧光染色法,于正置荧光显微镜下进行观察。HuC/D+信号显绿色,Caspase3+信号显红色,双阳性信号显黄色。每张标本随机取5个不重合的高倍视野,分别计数HuC/D+神经元、Caspase3+细胞及Casepase3+HuC/D+神经元的数目(个/H),取平均值。
1.8 统计学方法 采用SPSS25.0 统计软件。计量数据符合正态分布以表示,组间比较采用两独立样本t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组一般情况 洛哌丁胺灌胃后,STC 组小鼠立即出现明显的进食量下降,第3天进食量达最低,之后稍恢复,与CON 组比较有统计学差异(P<0.05)。见图1。随着洛哌丁胺处理不断进行,STC组小鼠皮毛开始变暗,精神萎靡,活动减少,在第6天出现明显的体质量减轻,与CON 组比较有统计学差异(P<0.05)。见图2。
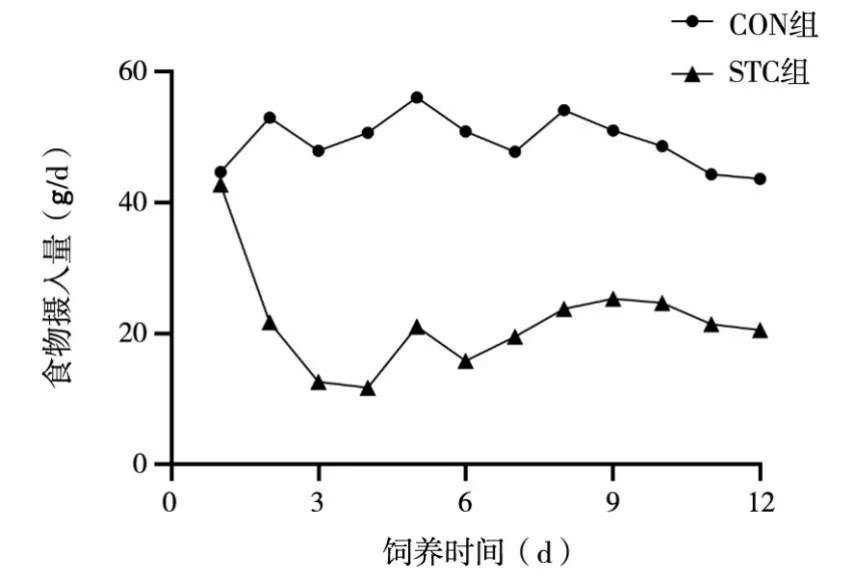
图1 两组食物摄入量变化

图2 两组体质量变化
2.2 两组粪便性状及肠道传输时间 与CON 组比较,STC 组粪便粒数减少、湿重减轻、含水量降低、黑便排出时间明显延长,差异均有统计学意义(P均< 0.05)。见表1。
表1 两组粪便性状及肠道传输时间比较()

表1 两组粪便性状及肠道传输时间比较()
注:与CON组比较,*P<0.05。
肠道传输时间(min)85.80±16.92 189.30±28.10*组别CON组STC组n 6 h粪便粒数(个)37.70±5.24 13.70±3.30*10 10湿重(mg)420.93±43.43 121.28±24.41*含水量(%)44.14±6.31 29.99±5.09*
2.3 两组结肠肌间神经元数目变化 与CON 组比较,STC 组全结肠肌间HuC/D+神经元数目减少,神经纤维荧光强度减弱(P均<0.05),而两组nNOS+神经元数目比较未见统计学差异(P>0.05)。见表2。
表2 两组结肠肌间神经丛神经元比较()

表2 两组结肠肌间神经丛神经元比较()
注:与CON组比较,*P<0.05。
组别CON组STC组n远端5.4±1.74 4.9±1.87远端26.2±4.28 14.5±3.96*PGP9.5荧光强度(AU/H)近端122.8±9.52 86.3±6.68*10 10 HuC/D+神经元(个/高倍镜视野)近端23.9±5.59 16.3±3.44*远端129.5±9.69 85.9±6.69*nNOS+神经元(个/高倍镜视野)近端5.0±1.86 5.4±1.66
2.4 两组结肠肌间神经元凋亡情况 与CON 组比较,STC 组 Casepase3+和 Casepase3+HuC/D+神经元数目增多(P均<0.05),结肠肌间神经元凋亡增加。见表3。
表3 两组结肠肌间Casepase3+和Casepase3+HuC/D+神经元数目比较(个/高倍镜视野,)

表3 两组结肠肌间Casepase3+和Casepase3+HuC/D+神经元数目比较(个/高倍镜视野,)
注:与CON组比较,*P<0.05。
组别CON组STC组Casepase3+HuC/D+神经元9.1±2.06 13.6±2.77*n 10 10 Casepase3+神经元12.3±2.80 26.0±3.70*
3 讨论
STC 是以肠道传输时间延长为特点的功能性便秘,严重者出现急性肠梗阻、肠坏死穿孔,可危及生命[8-9]。结肠推动力不足是STC 的主要表现,结肠传输试验是检测结肠推动力最重要的检查方式[10-11]。本研究使用洛哌丁胺诱导成功建立STC 小鼠模型,小鼠进食量下降,体质量减轻,皮毛变暗,精神萎靡,活动减少,且肠道传输时间延长,这些症状和体征明显符合STC的特点。
肠道动力调控的关键是ENS、平滑肌细胞和Cajal 间质细胞(ICC)[3]。ENS 是胃肠道特有的自主神经系统,可独立于交感神经系统和副交感神经系统调节肠道运动、分泌、新陈代谢等功能,故有“肠脑”之称。肠道平滑肌运动功能主要由ENS 肌间神经丛调控,因此本研究主要关注肌间神经丛的神经元变化。HuC/D 属于Hu 蛋白家族,是特异性神经元标志物,可标记肠道所有的神经元,而不是特定的亚群,因此被称为泛神经元标记物[12]。PGP9.5是一种存在于中枢和外周神经系统神经内分泌细胞中的神经元特异性蛋白,在细胞质和细胞核中均表达。PGP9.5能精准定位于神经元细胞质,用于分析神经纤维形态、分布和密度状况。相比于PGP9.5,HuC/D的优势在于适合标记和量化单个神经元。本研究发现,STC 小鼠全结肠肌间HuC/D+神经元数目减少,PGP9.5荧光强度降低,提示结肠肌间总神经元数目减少,神经纤维密度降低。肠道平滑肌收缩舒张受ENS 支配,肠神经元的减少可直接导致肠道平滑肌运动功能紊乱。
有研究显示,左半结肠传输时间延迟是STC 患者主要特征,尤其是降结肠和乙状结肠[13]。在STC患者中,始于结肠近端的高振幅传播收缩大多终止于横结肠中部[14];STC 患者结肠近端对胆碱能刺激的节段性收缩反应严重受损,并且常规收缩频率较正常人群降低约一半(即<3%)[15]。同时,本研究也发现HuC/D+神经元数目和PGP9.5荧光强度在STC小鼠近端和远端结肠均减少及降低,且近端和远端比较无统计学差异;证实近端和远端结肠均有肠神经元减少,可导致全结肠动力异常。目前大部分研究将远端结肠动力紊乱作为STC 的主要特征,可能是由于远端结肠的收缩活动较明显、易观察。
氮能神经元在ENS 肌间神经丛中密集分布。一氧化氮(NO)是ENS 氮能神经元最主要的抑制性递质,可舒张胃肠道平滑肌,使胃肠运动减弱[16]。nNOS 是肠神经系统NO 合成过程中的关键限速酶,在神经发育和突触可塑性中发挥重要作用,nNOS标志物常用来研究氮能神经。研究发现,在STC患者结肠肌间神经丛中 NOS+神经元占比升高[17],STC 患者结肠受NOS+神经元支配也较正常人结肠明显增强[18]。但也有报道STC患儿环形肌中的NOS+神经纤维密度并没有显著改变[19]。本研究显示,STC小鼠结肠肌间nNOS+神经元数目无明显变化,但HuC/D+神经元数目明显减少,这可能与本研究的样本量较少有关。目前STC小鼠结肠肌间nNOS+神经元变化研究成果存在差异,说明nNOS+神经元可能不是影响STC结肠动力的唯一因素。
有研究证实,严重STC 患者结肠肌间神经丛中神经节细胞、胶质细胞和ICC 明显减少,Bcl-2 的表达显著降低,可能存在凋亡[20]。Caspase-3 是半胱氨酸-天冬氨酸蛋白酶家族的一员,被认为是神经元凋亡的关键媒介[21-23]。我们通过免疫荧光共定位结肠肌间神经丛Caspase-3和HuC/D 标志物,发现STC小鼠结肠肌间神经丛中Casepase3+细胞数目增多,且Casepase3+HuC/D+神经元数目增多,证实STC 小鼠结肠肌间神经元凋亡增加,提示结肠肌间神经元的减少由凋亡导致。肠神经元凋亡造成ENS 神经元减少,神经网络稀疏,导致肠道平滑肌收缩舒张障碍,进而引发肠道传输功能紊乱。
综上所述,本研究成功建立洛哌丁胺诱导STC小鼠模型,通过改良肠神经全层铺片技术,证实STC小鼠结肠肌间神经丛神经元数目减少,神经纤维密度降低,且出现神经元凋亡,这可能是STC小鼠结肠慢传输的重要原因。

