神经节苷脂联合依达拉奉对急性重症颅脑损伤患者的保护作用
毋涛,汤明磊,朱从健
颅脑损伤是由外伤因素所致颅骨、脑组织、脑膜及脑血管等发生机械形变,进而诱发神经纤维损伤或断裂,神经功能损害、颅内压增高等[1]。重型颅脑损伤(severe traumatic brain injury,STBI)约占颅脑损伤总数的18%~20%,因病情严重、易变、多变,临床治疗难度较大,致残率及病死率均较高[2]。随着神经外科诊疗技术及医疗设施的不断完善,STBI的病死率已获得明显下降,但康复期仍可能遗留不同程度的神经功能障碍,且以认知功能损伤较突出,严重影响患者的康复效果及生存质量[3]。依达拉奉是临床常用脑保护剂及自由基清除剂,常用于脑梗死的辅助治疗,被证实可抑制脑水肿及迟发性神经元死亡[4]。神经节苷脂是一种重要的鞘糖脂,可促进突触结构形成及轴突生长,对于神经功能也具有较好的修复作用[5]。本研究在STBI患者中使用神经节苷脂联合依达拉奉治疗,观察其对患者神经功能及认知功能的保护作用,并检测神经功能相关因子表达变化,旨在初步揭示两药联用的效果及可能作用机制。
1 资料与方法
1.1 一般资料
本研究采用前瞻性、开放性、单中心随机对照研究方法设计。纳入2019年1月至2020年6月我院收治的STBI患者96例,纳入标准:STBI诊断符合《外科学》(第8版)[6]中相关诊断标准,经颅脑CT和(或)MRI检查等确诊;格拉斯哥昏迷量表(Glasgow coma scale,GCS)评分为3~8分,且伤后昏迷时间>12 h,意识障碍呈加重趋势或再次昏迷;受伤至入院时间<12 h。排除标准:合并胸、腹腔或四肢等其他部位严重损伤;合并恶性肿瘤、凝血功能障碍、免疫系统疾病;合并严重心、肝、肺、肾等重要脏器功能障碍或功能衰竭;既往脑部器质性疾病或脑部外伤史、脑部手术史;近1月内服用维生素C、维生素E及其他抗氧化药物;对本研究方案药物过敏或明确禁忌证。全部患者采用电脑随机数字表法分为2组,每组48例:①对照组,男30例,女18例;年龄25~55岁,平均(45.32±5.29)岁;吸烟史17例,合并糖尿病10例,高血压11例;受伤至入院时间1.5~9 h,平均(3.11±0.95)h;致伤原因为交通伤17例,坠落伤18例,击打伤8例,其他5例;损伤类型为脑挫裂伤23例,脑挫裂伤伴颅内血肿10例,硬膜下血肿11例,硬膜外血肿3例,蛛网膜下腔出血1例;②观察组,男27例,女21例;年龄25~55岁,平均(46.85±5.71)岁;吸烟史21例,合并糖尿病11例,高血压14例;受伤至入院时间2~10 h,平均(3.42±1.08)h;致伤原因为交通伤20例,坠落伤16例,击打伤9例,其他3例;损伤类型为脑挫裂伤22例,脑挫裂伤伴颅内血肿10例,硬膜下血肿10例,硬膜外血肿5例,弥散性脑肿胀1例。2组一般资料比较差异均无统计学意义(均P>0.05)。本研究经医院伦理委员会审核并批准通过,所有患者和(或)家属均自愿且签署知情同意书。
1.2 方法
1.2.1 治疗方法 2组患者入院后均接受急救护理、抗感染、纠正水电解质紊乱、清创、止血等常规治疗,均由同一组医生实施标准大骨瓣开颅减压术联合颅内血肿清除术。术后给予常规抗感染、脱水、营养支持等基础治疗,生命体征稳定后,2组均给予依达拉奉注射液30 mg+0.9%氯化钠注射液100 mL静脉滴注,2次/d,2周为1疗程,连续治疗4个疗程。观察组加用神经节苷脂钠注射液100 mg+0.9%氯化钠注射液100 mL静脉滴注,1次/d;2周后改为维持剂量继续治疗6周,即20~40 mg+0.9%氯化钠注射液100 mL静脉滴注,1次/d。
1.2.2 观察指标 2组患者均在治疗前及治疗4周、8周、12周结束后进行神经功能及认知功能评估。其中,神经功能采用美国国立卫生院神经功能缺损评分(National Institute of Health Stroke Scale,NIHSS)[7]评价,总分0~42分,0~1分为正常或几近正常,2~15分为轻度,16~20分为中度,21~42分为重度。认知功能采用蒙特利尔认知评估量表(Montreal cognitive assessment,MoCA)与简易精神状态检查量表(mini-mental state examination,MMSE)[8]评价,MoCA总分30分,<20分为明显认知功能障碍,20~24分为轻度认知功能障碍,≥25分为正常;MMSE总分30分,<24分为明显认知功能障碍,24~26分为轻度认知功能障碍,≥27分为正常。采用Barthel指数(Barthel index,BI)评价日常生活能力(activities of daily living,ADL),总分100分,得分越高表示功能恢复越好,ADL水平越高。分别于治疗前及治疗8周后,所有患者晨取空腹静脉血3.0 mL,3 000 r/min离心10 min,置于-20℃冰箱中保存统一测定。采用酶联免疫吸附法检测血清胶质细胞原纤维酸性蛋白(glial fiber acidic protein,GFAP)、神 经 元 特 异 性 烯 醇 化 酶(neuron-specific enolase,NSE)、神经生长因子(nerve growth factor,NGF)和脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)水平;检测血清超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)和髓过氧化物酶(malondialdehyde peroxidase,MPO)水平。
1.3 预后评价
随访3月,采用格拉斯哥预后评分(Glasgow outcome score,GOS)评价临床预后,分为恢复良好(5分)、轻度残疾(4分)、重度残疾(3分)、植物生存(2分)与死亡(1分),得分>3分表示预后良好,≤3分为预后不良。
1.4 统计学处理
采用SPSS22.0统计软件处理数据。计数资料以率(百分比)表示,χ2检验,计量资料以(±s)表示,t检验;P<0.05为差异有统计学意义。
2 结果
2.1 2组不同时间点NIHSS和BI评分比较
治疗前2组NIHSS和BI评分比较,差异无统计学意义(P>0.05);治疗4周、8周、12周后,2组NIHSS评分均显著降低,且观察组评分均低于对照组(P<0.05);2组BI评分均升高,且观察组均高于对照组(P<0.05)。末次随访时,观察组的NIHSS评分平均降低率为(67.16±6.11)%,显著高于对照组的(60.36±5.83)%(t=5.578,P<0.001),见表1。
表1 2组不同时间点NIHSS和BI评分比较(分,±s)
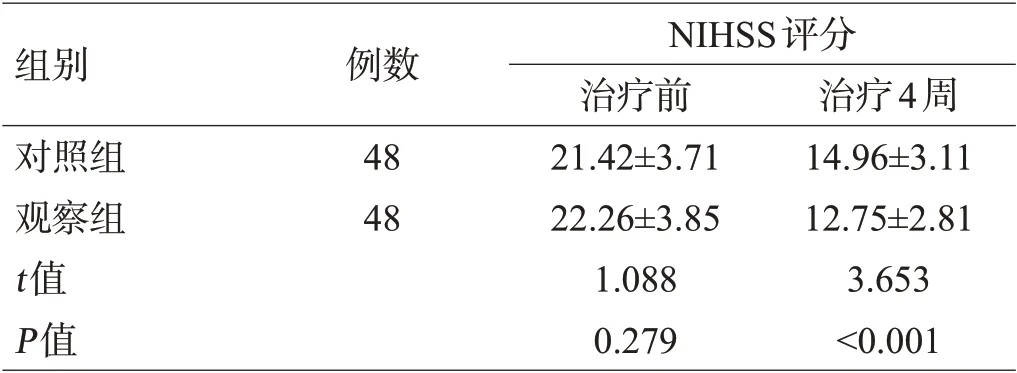
表1 2组不同时间点NIHSS和BI评分比较(分,±s)
组别对照组观察组t值P值例数48 48 NIHSS评分治疗前21.42±3.71 22.26±3.85 1.088 0.279治疗4周14.96±3.11 12.75±2.81 3.653<0.001
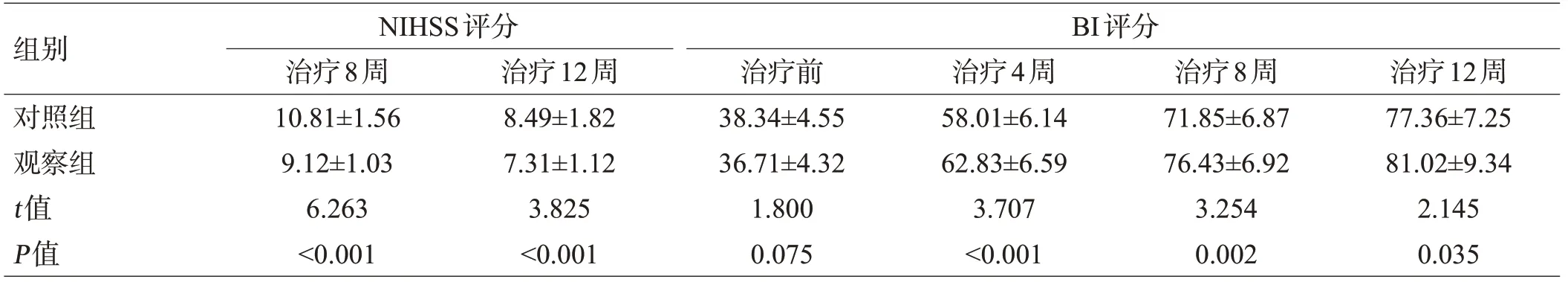
组别对照组观察组t值P值NIHSS评分治疗8周10.81±1.56 9.12±1.03 6.263<0.001 BI评分治疗12周8.49±1.82 7.31±1.12 3.825<0.001治疗前38.34±4.55 36.71±4.32 1.800 0.075治疗4周58.01±6.14 62.83±6.59 3.707<0.001治疗8周71.85±6.87 76.43±6.92 3.254 0.002治疗12周77.36±7.25 81.02±9.34 2.145 0.035
2.2 2组不同时间点MoCA、MMSE评分比较
治疗前2组MoCA、MMSE评分比较,差异无统计学意义(P>0.05);治疗4周、8周、12周后,2组MoCA、MMSE评分均升高,且观察组评分高于对照组(P<0.05),见表2。末次随访时评估,观察组认知功能障碍9例(18.75%),对照组认知功能障碍17例(35.42%),均为轻度,未达到临床痴呆水平,观察组的认知功能障碍率低于对照组(χ2=6.217,P=0.013)。
表2 2组不同时间点MoCA和MMSE评分比较(分,±s)
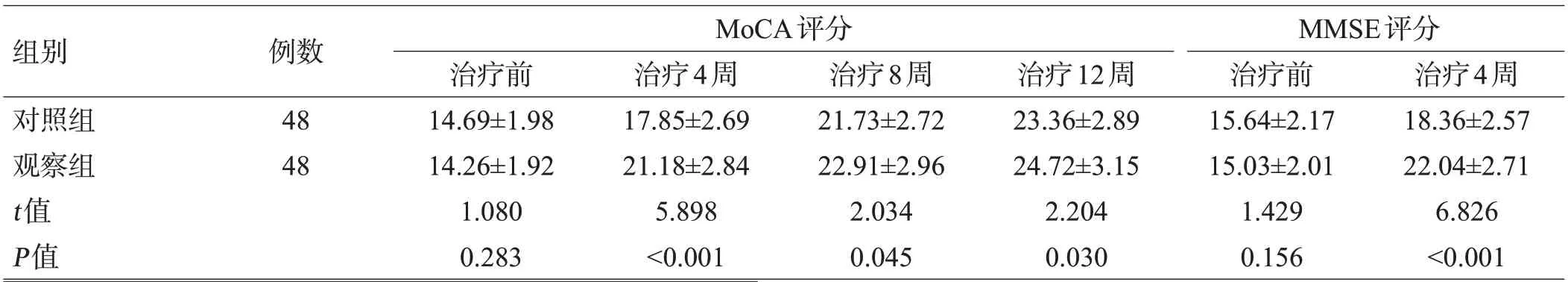
表2 2组不同时间点MoCA和MMSE评分比较(分,±s)
组别对照组观察组t值P值例数48 48 MoCA评分治疗前14.69±1.98 14.26±1.92 1.080 0.283治疗4周17.85±2.69 21.18±2.84 5.898<0.001治疗8周21.73±2.72 22.91±2.96 2.034 0.045治疗12周23.36±2.89 24.72±3.15 2.204 0.030 MMSE评分治疗前15.64±2.17 15.03±2.01 1.429 0.156治疗4周18.36±2.57 22.04±2.71 6.826<0.001

组别对照组观察组t值P值MMSE评分治疗8周22.28±2.55 25.21±2.69 5.477<0.001治疗12周25.01±3.48 26.66±3.71 2.247 0.027
2.3 2组治疗前后血液指标比较
治疗前,2组血清GFAP、NSE、NGF、BDNF水平比较,差异无统计学意义(P>0.05);治疗后,2组GFAP、NSE水平均降低,且观察组低于对照组(P<0.05);2组NGF、BDNF水平均升高,且观察组高于对照组(P<0.05),见表3。
表3 2组治疗前后血液指标比较(±s)
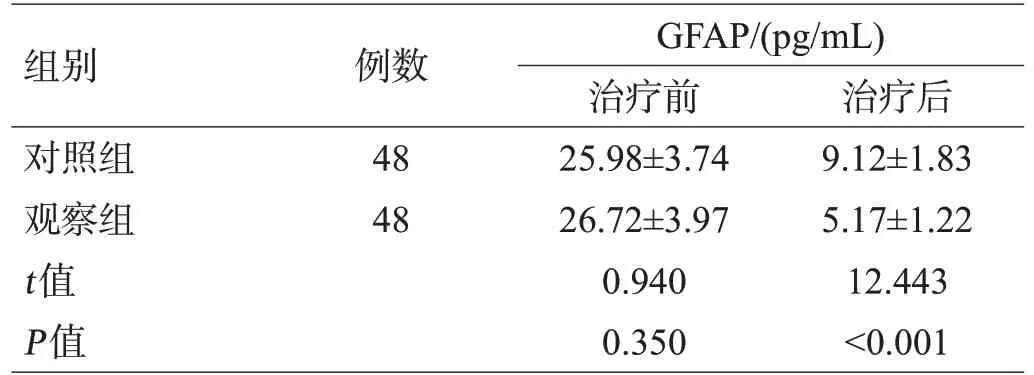
表3 2组治疗前后血液指标比较(±s)
组别对照组观察组t值P值例数48 48 GFAP/(pg/mL)治疗前25.98±3.74 26.72±3.97 0.940 0.350治疗后9.12±1.83 5.17±1.22 12.443<0.001
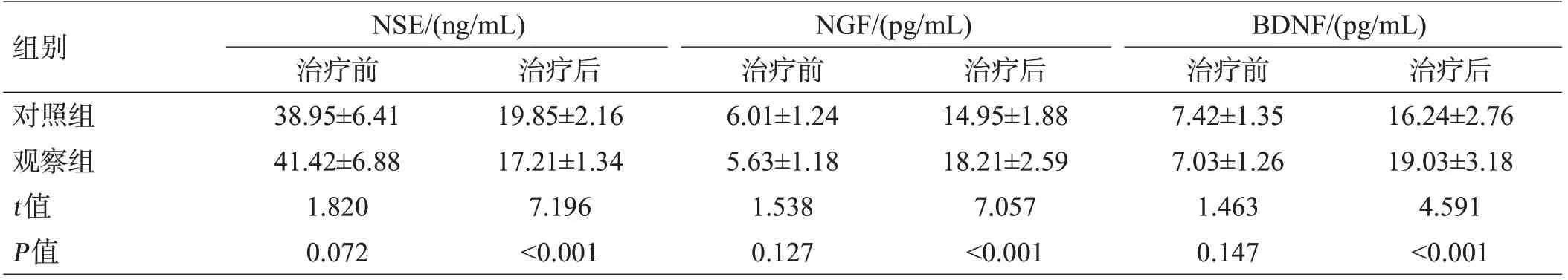
组别对照组观察组t值P值NSE/(ng/mL)治疗前38.95±6.41 41.42±6.88 1.820 0.072治疗后19.85±2.16 17.21±1.34 7.196<0.001 NGF/(pg/mL)治疗前6.01±1.24 5.63±1.18 1.538 0.127治疗后14.95±1.88 18.21±2.59 7.057<0.001 BDNF/(pg/mL)治疗前7.42±1.35 7.03±1.26 1.463 0.147治疗后16.24±2.76 19.03±3.18 4.591<0.001
2.4 2组治疗前后氧化应激指标比较
治疗前,2组SOD、MDA及MPO水平比较,差异无统计学意义(P>0.05);治疗后,2组SOD均升高,且观察组高于对照组(P<0.05);2组MDA及MPO水平均降低,且观察组低于对照组(P<0.05),见表4。
表4 2组治疗前后氧化应激指标比较(±s)
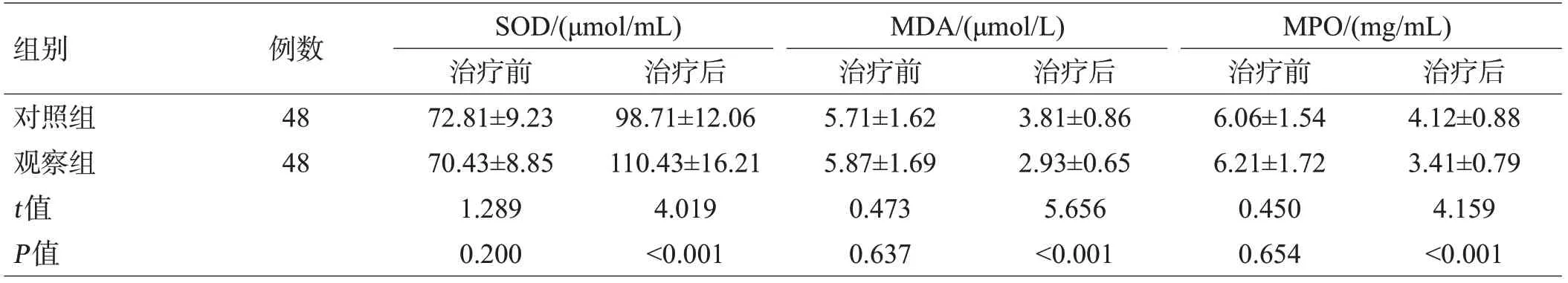
表4 2组治疗前后氧化应激指标比较(±s)
组别对照组观察组t值P值例数48 48 SOD/(μmol/mL)治疗前72.81±9.23 70.43±8.85 1.289 0.200治疗后98.71±12.06 110.43±16.21 4.019<0.001 MDA/(μmol/L)治疗前5.71±1.62 5.87±1.69 0.473 0.637治疗后3.81±0.86 2.93±0.65 5.656<0.001 MPO/(mg/mL)治疗前6.06±1.54 6.21±1.72 0.450 0.654治疗后4.12±0.88 3.41±0.79 4.159<0.001
2.5 安全性评价
用药期间,2组均未发生肝肾功能损害、心电图异常等严重不良反应。观察组恶心呕吐2例,轻度皮疹1例,不良反应率为6.25%;对照组恶心呕吐1例(2.08%),未见其他不良反应。2组间不良反应发生率比较,差异无统计学意义(χ2=1.259,P=0.262)。
2.6 2组临床预后比较
随访3月,均无失访病例。观察组预后良好率75.00%,高于对照组的60.42%,差异有统计学意义(χ2=4.217,P=0.040),见表5。

表5 2组GOS评分比较[例(%)]
3 讨论
STBI除原发性损伤外,其继发性脑损伤是影响临床预后的关键,伤后血脑屏障受损、神经递质紊乱、氧化应激损伤等均可诱发神经细胞自溶或神经元细胞非正常凋亡,进而发生脑水肿、颅内压升高等,诱发继发性脑损伤[9]。目前,临床对STBI的治疗主要为去骨瓣减压术、血肿清除术及常规内科治疗等综合治疗手段,虽能较大程度地降低死亡率,但难以彻底重建受损的神经功能,术后仍易出现神经功能缺损及认知功能损害等[10]。因此,如何控制继发性脑损伤、促进神经功能重建与恢复成为STBI治疗及研究的重点及难点。
研究证实,使用神经保护制剂能促进缺血性脑损伤患者的神经功能康复[11]。依达拉奉是目前唯一经Ⅲ期临床试验证实具有神经保护作用的自由基清除剂,其透过血脑屏障率可达60%左右,能有效清除自由基并抑制过氧化反应,减轻氧化应激引起或加重脑组织血管内皮细胞损伤[12]。同时,依达拉奉还可抑制花生四烯酸、白三烯的生成,缓解脑水肿,解除脑血管痉挛,保护血管内皮细胞功能,改善脑微血液循环,抑制缺血级联反应,从而缓解神经功能缺损症状[13]。此外,依达拉奉能减轻细胞内钙离子超载,抑制兴奋性氨基酸毒性作用,从而发挥神经保护作用[14]。脑内神经节苷脂参与维持神经细胞形态的稳定及神经细胞的传导等过程,这在脑组织细胞生长发育、认知功能发展中具有关键作用[15]。STBI患者由于内源性神经节苷脂水平降低,在一定程度上影响了神经功能及认知功能的恢复,故外源性补充神经节苷脂有利于促进受损神经细胞的修复,从而促进神经功能恢复[16]。已有研究显示,神经节苷脂能促进突触结构的形成与轴突生长,还可促进毒副代谢产物的清除,从而减轻其对神经功能的持续性损伤作用[17]。另有研究发现,神经节苷脂能够增强神经生长因子的活性,促进神经网络的建立,并能激活脑组织中Na+、K+-三磷酸腺苷(adenosine triphosphate,ATP)酶,从而减轻脑水肿,发挥脑神经保护作用[18]。但STBI继发性脑损伤的机制复杂,单一神经保护剂对STBI的神经保护作用仍有限,有学者认为联合应用神经保护剂可能使STBI患者获益更多,且这一观点逐步被广泛接受。
本研究结果显示,2组患者在用药4周后NIHSS评分即较治疗前明显下降,且随着时间推移呈进一步下降趋势,而观察组用药后各时间点的NIHSS评分均低于对照组,至12周时NIHSS评分降低率约达67.16%,高于对照组的60.36%,提示依达拉奉与神经节苷脂联用较单用依达拉奉能更好地促进神经功能的康复。脑组织对缺血、缺氧的敏感性极高,STBI后血肿压迫及缺血缺氧均可导致脑组织皮质损伤,导致认知功能损害,不影响脑功能的全面康复,且将增加痴呆及其他生理功能障碍发生风险[19]。文献显示,颅脑损伤患者尤其是外伤性颅脑损伤患者认知功能损害发生率可高达33.65%~67.81%[20,21]。本研究中,2组治疗后MoCA、MMSE评分均呈明显升高趋势,且观察组评分整体优于对照组,认知功能障碍发生率较对照组降低(18.75%v.s35.42%)。与此同时,观察组治疗后BI评分亦较对照组表现出明显优势,提示依达拉奉与神经节苷脂联用更有利于保护STBI患者的认知功能,促进脑功能的全面康复,提高ADL水平。
氧化应激损伤是STBI患者继发性脑损伤的重要标志,伤后氧代谢产物MPO和MDA大量释放,而MPO、MDA过表达又可加剧脂质过氧化反应,从而加重神经元损伤[22]。本研究中,2组治疗后氧自由基清除因子SOD水平明显升高,MDA及MPO水平均明显下降,而观察组的改善幅度优于对照组,认为依达拉奉与神经节苷脂联用更有利于减轻STBI患者的氧化应激反应程度,从而促进神经功能的恢复。GFAP是构成神经胶质细胞骨架的重要成分,在STBI后星形胶质细胞受损,大量GFAP渗漏并透过受损血脑屏障而进入血液循环,故外周血GFAP水平升高能反映神经元损伤[23]。NSE主要由神经细胞及神经内分泌细胞合成和分泌,在神经元糖酵解过程中具有关键性作用,故其水平能较敏感地反映神经细胞损伤情况[24]。BDNF是脑神经营养因子家族的重要成员,参与神经系统的发育、神经元群的形成及神经功能的维持等过程,且对脑损伤后神经干细胞的增殖、分化具有重要调节作用;而NGF则是参与受损神经再生及功能恢复的重要因子,可维持并促进交感神经、感觉神经细胞的生长、分化等,两者均是神经重建的重要因素[25]。本研究中,2组治疗后血清GFAP、NSE水平均降低,NGF、BDNF水平均升高,而观察组各指标的改善均优于对照组,进一步证实依达拉奉与神经节苷脂联用较单用依达拉奉更有利于促进受损神经的修复与神经功能的重建。预后评估显示,两组在死亡率方面差异不大,但观察组预后良好率较对照组明显提高(75.00%v.s60.42%),这或与联用神经保护剂的脑功能整体康复效果更理想有关。
综上所述,在STBI治疗中联用依达拉奉与神经节苷脂能有效抑制机体炎症应激反应,抑制GFAP、NSE表达并促进NGF、BDNF释放,促进神经功能康复,更好地保护认知功能,从而改善临床预后,且疗效的增加并非以安全性降低为代价,具有推广价值。
