心境稳定剂影响双相情感障碍躁狂发作患者肠道菌群变化
尚玲,李琪,杨栋,刘学军,张雪花
双相情感障碍(bipolar disorder,BD)是一种复杂的慢性疾病,严重影响患者的思维、情感和行为[1,2]。随着对肠道菌群研究的逐步深入,发现肠道菌群及其代谢产物通过促进BD的发生发展,成为BD的又一危险因素[3,4]。脑-肠-菌群轴(brain-gut-microbiota axis,BGMA)参与BD发病[5]。研究表明BD患者的肠道菌群丰度发生变化,从而导致肠道炎症,肠道通透性增高,从而加重BD患者症状[6-8]。研究证实心境稳定剂能明显缓解BD患者临床症状[9-11],但是心境稳定剂是否通过调整脑-肠轴稳态改善BD患者症状还不清楚,因此本研究选择42例BD躁狂发作患者,采用心理测验、16SrDNA高通量测序等方法,分析BD躁狂发作患者心境稳定剂治疗前、后肠道菌群的多样性变化,研究心境稳定剂对肠道菌群多样性的影响,为心境稳定剂治疗BD的脑肠轴机制提供新的理论依据。
1 资料与方法
1.1 一般资料
2020年11月在湖南省脑科医院治疗的BD患者42例为BD组,均经两名副主任医师进行确诊,入组标准:符合ICD-10双相情感障碍的诊断标准,入院前3月未服用精神药物;BD躁狂发作;近3月连续服用抗生素≤3 d;无特殊饮食习惯;2周内未进行抽搐电休克治疗;入组前1周未服用过酸奶等益生菌制剂;所有患者及家属对本研究知情同意。排除标准:有其他躯体疾病及遗传性疾病;快速循环的双相患者,躯体疾病所伴发的双相障碍,依据DSM-Ⅳ诊断边缘性人格障碍,在过去3月内有自杀企图及有严重精神病性症状。另纳入同期健康志愿者42例为健康对照(health control,HC)组。受试者均签订知情同意书。本研究通过湖南省脑科医院伦理委员会批准。
1.2 方法
1.2.1 治疗方案 BD组情绪稳定剂采用碳酸锂缓释片(购于江苏恩华药业股份有限公司,TS200101),第1天剂量为250 mg/d,其后在10 d内剂量增至600~1 000 mg/d(其中600 mg/d者18例,900 mg/d者24例);采用富马酸喹硫平片(购于阿斯利康公司,1011060)抗精神病治疗,第1天剂量为100 mg/d,其后在10 d内剂量增至200~600 mg/d(其中200 mg/d者8例,400 mg/d者26例,600 mg/d者8例)。在治疗前、治疗后2月进行量表评估及样本采集。
1.2.2 量表评估 BD患者的临床症状由两名主治医师使用杨氏躁狂量表(young manic rating scale,YMRS)进行评估。YMRS共包括心境高涨、活动-精力增加、性兴趣、睡眠、易激惹、语言-速度与数量、语言-思维形式障碍、思维内容、破坏-攻击行为、外表、自制力11项,以0~8级或0~4级进行评分。疗效指数=(治疗前YMRS评分-治疗后YMRS评分)/治疗后YMRS评分×100%,疗效指数>50%为显效,疗效指数25%~50%为有效,疗效指数<25%为无效。总有效包括显效和有效。
1.2.3 粪便样本采集及基因组DNA提取 由2名接受严格无菌操作培训的人员采集所有患者新鲜粪便样本约10 g于40 mL无菌采便盒内,迅速置于-80℃冰箱保存。粪便采集1周内按试剂盒(北京索莱宝科技有限公司)的操作说明提取粪便基因组DNA。DNA保存于-20℃冰箱中,避免反复冻融,以防降解。
1.2.4 PCR产物扩增及纯化 选择16SrRNA基因中V3~V4区域进行PCR扩增,引物为341F 5’-barcode-CCTACGGGNGGCWGCAG-3’和785R 5’-GACTACH VGGGTATCTAATCC-3’。PCR体系为2.5μL DNA模板、12.5μL Mix、0.25μL上下游引物、补H2O至25μL。按QIAquick Gel Extraction Kit操作说明进行PCR扩增产物纯化,收集PCR扩增产物。
1.2.5 文库构建、高通量测序及生物信息学分析 文库构建按照TruSeq®DNA PCR-Free Sample Preparation Kit操作说明进行。文库质检:检测DNA质量浓度、长度分布和摩尔浓度,要求DNA质量浓度大于1.0 ng/μL,符合目的片段长度、单一峰、无接头峰和大片段峰。文库质检合格后,加入到HiSeq2500 PE250测序平台(购于美国Illumina公司)进行高通量测序,获得各样品reads。根据barcode和PCR扩增引物序列,拼接各样品reads,经过严格过滤处理获得Clean Tags数据。具体过滤条件:引物序列要与barcode匹配;reads不允许存在模糊碱基;重叠区域错配碱基不超过5个,且错配率不超过0.05;不包括barcode和引物序列,reads长度在100~550 bp。利用Uparse软件聚类(http://drive5.com/uparse/),以97%的一致性将序列聚类成为操作分类单元(operational taxonomic units,OTUs),筛选频数最高序列作为代表序列,并进行物种注释。使用QIIME软件(http://qiime.org/)计算肠道菌群α多样性的指数,包括Chao1指数、Observed species指数、Shannon指数和Simpson指数。使用基于OTUs的Bray-Curtis距离进行PCoA分析,计算肠道菌群β多样性。使用LEfSe软件(http://huttenhower.sph.harvard.edu/galaxy/)分析组间相对丰度差异具有统计学意义的菌群。
1.2.6 观察指标检测 HC组和治疗前、后的BD组在粪便样本采集完成后,30 min内抽取空腹静脉血3 mL,2 000 rpm离心10 min后分离血清,置于-80℃保存。采用酶联免疫吸附(ELISA)法测定IL-1β和TNF-α含量,试剂盒购自武汉博士德生物有限公司。
1.3 统计学处理
采用SPSS19.0软件分析数据,计量资料以(均数±标准差)表示,t检验;计数资料以例表示,χ2检验;组间差异物种和丰度筛选通过LEf Se软件应用线性判别分析方法(linear discriminant analysis,LDA);相关性分析采用Pearson相关分析;P<0.05为差异有统计学意义。
2 结果
2.1 2组一般资料比较
治疗前BD组共纳入42例患者,治疗前BD组与HC组在性别、年龄、受教育年限、BMI、饮食结构及排便习惯、是否饮用乳酸制品、吸烟和饮酒状况等方面差异均无统计学意义(P>0.05),见表1。
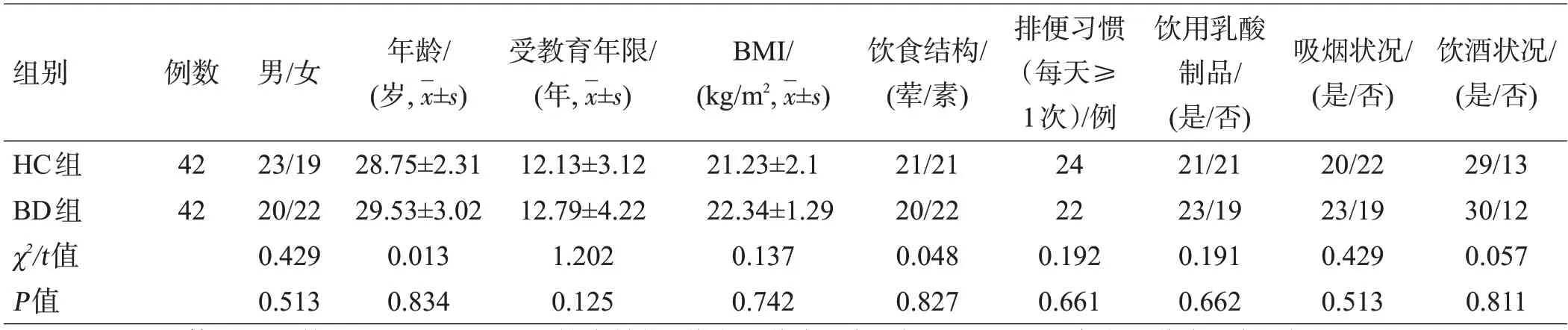
表1 2组一般资料比较
2.2 BD组疗效评价
BD组中,显效13例(31.0%),有效25例(59.5%),无效4例(9.5%),总有效38例(90.5%)。治疗前,BD组的YMRS总分为(31.82±7.34)分,治疗后BD组的YMRS总分为(18.95±6.23)分,低于治疗前,差异有统计学意义(t=8.663,P<0.05)。
2.3 肠道菌群物种α多样性比较
与HC组相比,治疗前BD组的Chao1指数、Observed species指数、Shannon指数和Simpson指数较低,差异均有统计学意义(t=4.043、6.850、3.706、4.887,均P<0.05),说明治疗前BD组肠道菌群的物种多样性低。与治疗前相比,治疗后BD组的Chao1指数和Observed species指数升高,差异有统计学意义(t=2.781、4.216,P<0.05),Shannon指数和Simpson指数与治疗前差异无统计学意义(t=2.054、2.424,P>0.05),说明治疗后BD组肠道菌群多样性高于治疗前BD组。同时治疗后BD组与HC组相比,Chao1指数、Observed species指数、Shannon指数和Simpson指数差异均无统计学意义(t=1.263、2.633、1.652、2.463,均P>0.05),见图1。
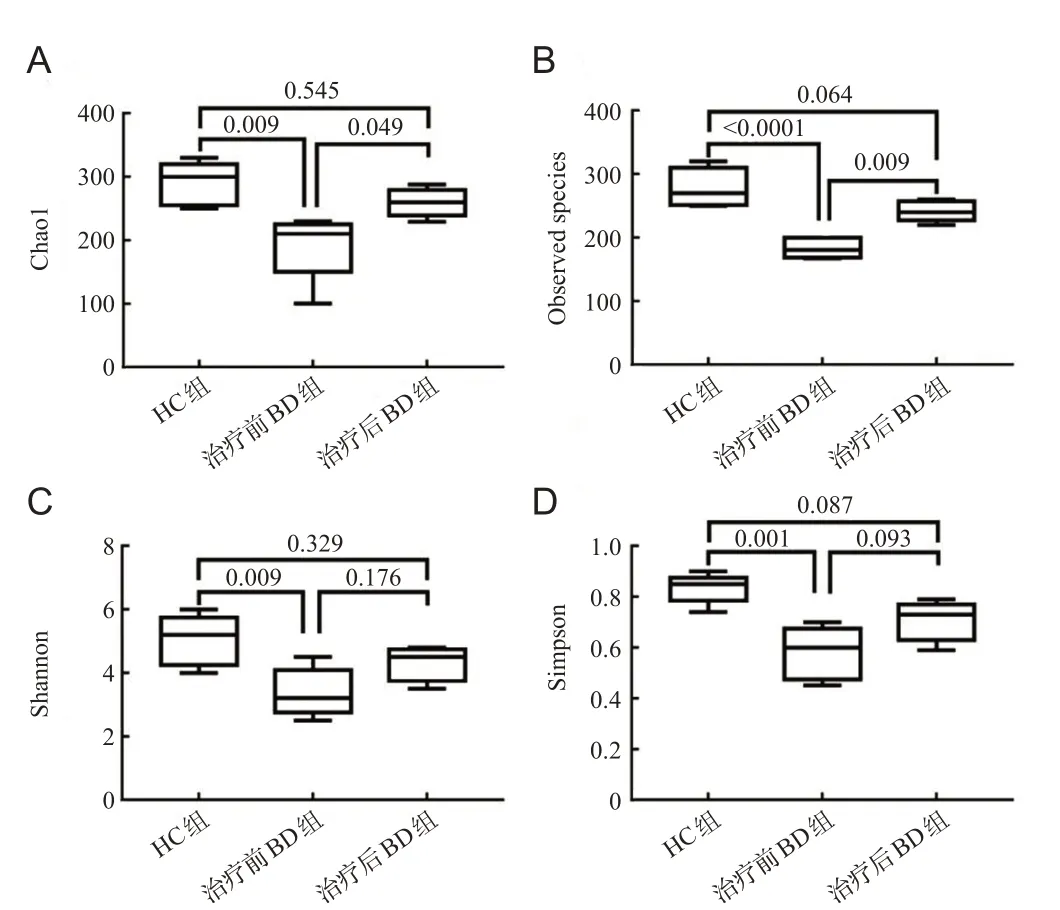
图1 肠道菌群物种α多样性比较
2.4 肠道菌群物种β多样性比较
与HC组相比,治疗前、后BD组的肠道菌群样本可被区分开,差异均有统计学意义(均P<0.05),而且治疗前BD组的肠道菌群样本较分散,HC组的肠道菌群样本较集中,提示BD组肠道菌群相对HC组相似性更低,见图2。
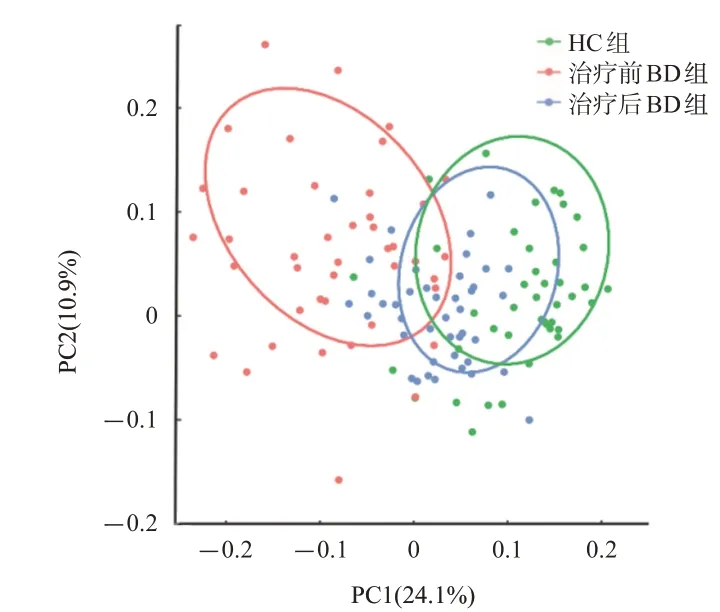
图2 肠道菌群物种β多样性比较
2.5 治疗前、后肠道菌群结构之间的差异比较
HC组中占优势的主要肠道菌群是拟杆菌门及其下的拟杆菌纲、拟杆菌目和厚壁菌门。与HC组相比,治疗前BD组厚壁菌门及其下的梭菌纲、梭菌目、瘤胃球菌科、韦荣菌科、变形菌门、放线菌门丰度较高,但是拟杆菌门及其下的拟杆菌纲、拟杆菌目的丰度较低,差异有统计学意义(t=3.570,P<0.05)。治疗后BD组的厚壁菌门及其下毛螺菌科、醋酸菌科、瘤胃球菌属的丰度高于HC组,差异有统计学意义(t=3.314,P<0.05);治疗后BD组的厚壁菌门及其下毛螺菌科、醋酸菌科和拟杆菌门的丰度高于治疗前BD组,差异有统计学意义(t=3.142,P<0.05),见图3。
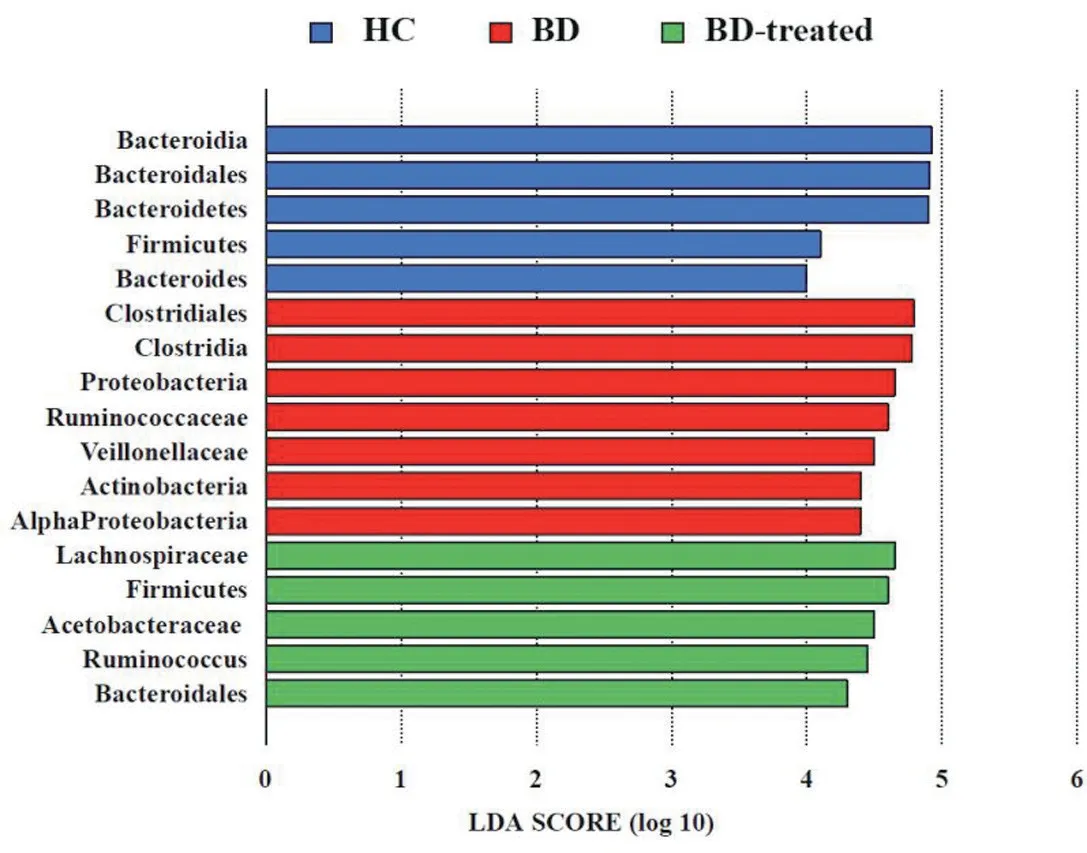
图3 治疗前、后肠道菌群结构的差异比较
2.6 治疗前、后肠道毛螺菌科相对丰度比较
与HC组相比,治疗前BD组毛螺菌科相对丰度低,差异有统计学意义(t=3.957,P<0.05),治疗后BD组毛螺菌科相对丰度差异无统计学意义(t=0.622,P>0.05);且治疗后BD组的毛螺菌科相对丰度高于治疗前,差异有统计学意义(t=3.334,P<0.05),见图4。
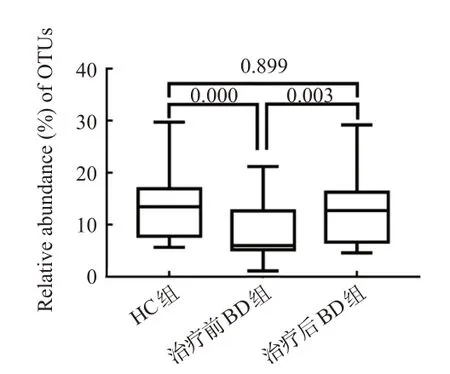
图4 治疗前、后肠道毛螺菌科相对丰度比较
2.7 肠道毛螺菌科相对丰度与YMRS总分相关性分析
对肠道毛螺菌科相对丰度与YMRS总分相关性分析表明,肠道毛螺菌科相对丰度与YMRS总分呈负相关(r=-0.322,P=0.038),见图5。
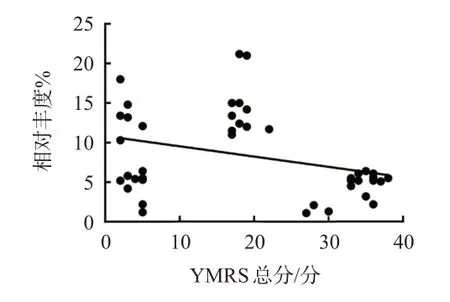
图5 肠道毛螺菌科相对丰度与YMRS总分相关性分析
2.8 肠道毛螺菌科相对丰度与IL-1β、TNF-α含量相关性分析
肠道毛螺菌科相对丰度与IL-1β含量呈显著负相关(r=-0.495,P=0.001),与TNF-α含量呈负相关(r=-0.309,P=0.046),见图6。
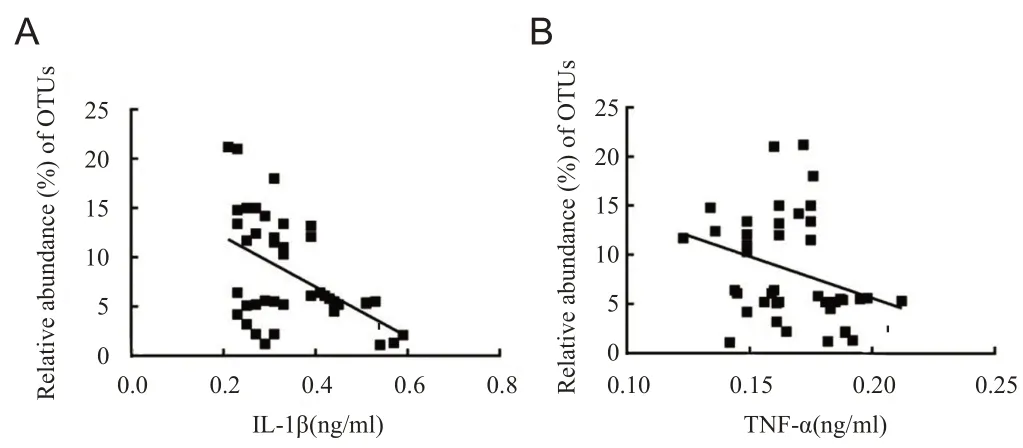
图6 肠道毛螺菌科相对丰度与IL-1β(A)、TNF-α(B)含量相关性分析
2.9 治疗前、后IL-1β、TNF-α含量比较
治疗前BD组的IL-1β和TNF-α含量高于HC组,差异有统计学意义(t=17.680、10.144,P<0.05)。治疗后BD组的IL-1β含量高于HC组,差异有统计学意义(t=9.040,P<0.05),而治疗后BD组的TNF-α含量与HC组差异无统计学意义(t=1.907,P>0.05)。治疗后BD组IL-1β和TNF-α含量高于治疗前,差异有统计学意义(t=11.678、4.583,P<0.05),见表2。
表2 治疗前、后BD组的IL-1β、TNF-α含量比较(ng/mL,±s)
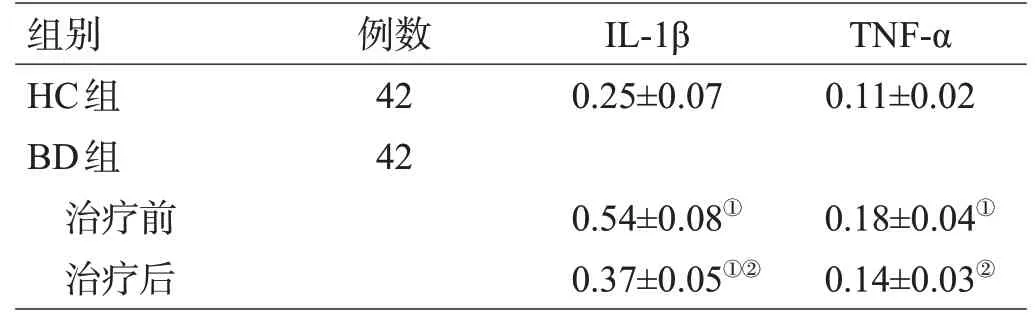
表2 治疗前、后BD组的IL-1β、TNF-α含量比较(ng/mL,±s)
注:与HC组比较,①P<0.05;与治疗前比较,②P<0.05
组别HC组BD组治疗前治疗后例数42 42 IL-1β 0.25±0.07 TNF-α 0.11±0.02 0.54±0.08①0.37±0.05①②0.18±0.04①0.14±0.03②
3 讨论
BD属于心境障碍的一种类型,其中BD躁狂发作治疗难度大,易复发,常发生于儿童或青少年时期[12],治疗面临着对药物治疗不耐受、复发率高等问题[11],因此找到更有效的治疗方法具有重要的意义。目前研究表明肠道菌群与BD密切相关,BD患者的肠道菌群在种群结构分类和多样性上与健康人相比变化十分明显[13]。Evans等[14]比较了健康对照组和BD患者肠道菌群后发现BD组的粪杆菌属丰度降低,且与BD患者患病程度负相关,而粪杆菌属有抗炎特征,在降低肠道炎症中起重要作用[15,16]。Painold等[6]对32例BD患者和10例健康者的粪便样本进行16SrDNA基因测序,结果表明BD患者的放线菌门及棒杆菌科丰度高于健康者,而BD患者的粪杆菌属丰度低于健康者,同时发现BD患者的病程时间与Observed species指数负相关,这说明BD患者病程时间越长,肠道菌群的多样性可能越低。本研究发现BD组的Chao1指数、Observed species指数、Shannon指数和Simpson指数低于HC组(P<0.05),表明BD患者的肠道菌群多样性低于HC组,这与Painold等[6]研究结果类似。Hu等[3]比较了HC组和服用喹硫平治疗前后BD患者的肠道菌群组成时发现,服用喹硫平治疗的BD患者中存在丰度更高的变形杆菌门及克雷伯氏菌属和乳杆菌属。本研究发现治疗后BD组的Chao1指数和Observed species指数高于BD组(P<0.05),表明心境稳定剂能影响肠道菌群的多样性。
筛选、量化和确定肠道菌群对BD发病的影响程度[16],有助于临床的精确诊疗,为诊断提供有力的依据。通过PCoA分析计算肠道菌群β多样性的结果表明,与HC组相比,治疗前、后BD组的肠道菌群样本可被区分开。LEf Se软件分析发现治疗前BD组厚壁菌门及其下的梭菌纲、梭菌目、瘤胃球菌科、韦荣菌科、变形菌门和放线菌门丰度高于HC组,这与Painold等[6]和郭丽阳等[17]的研究结果相吻合。治疗前BD组的厚壁菌门及其下毛螺菌科、醋酸菌科和拟杆菌目的丰度低于治疗后BD组,同时治疗前BD组毛螺菌科相对丰度低于HC组和治疗后BD组(P<0.05),而治疗后BD组毛螺菌科相对丰度与HC组差异无统计学意义(P>0.05)。Cussotto等[7]研究表明不同种类的心境稳定剂均影响毛螺菌科的丰度,提高了毛螺菌科的相对丰度。Flowers等[18]在研究非典型抗精神病药物(atypical antipsychotics,AAPs)与BD患者肠道微生物之间的相互作用时发现,服用AAPs的BD患者肠道中毛螺菌科的相对丰度显著高于未服用AAPs的BD患者,推测肠道毛螺菌科的相对丰度可能影响BD的发病。Pearson相关分析表明肠道毛螺菌科的相对丰度与BD患病程度呈负相关(P<0.05),同时也与IL-1β、TNF-α含量负相关(P<0.05)。毛螺菌科可产生短链脂肪酸(short-chain fatty acids,SCFA),而SCFA是维持肠道上皮以及调节免疫系统和炎症反应的重要物质,能改善肠道炎症,提高肠上皮屏障功能[19-21]。本研究发现治疗后BD组IL-1 β和TNF-α含量高于治疗前,这说明治疗后BD组的炎症有所改善。因此,治疗后BD组中肠道毛螺菌科相对丰度增加,推测可能是通过产生SCFA,降低炎性因子的产生,从而减少BD躁狂发作患者发病。
综上所述,本研究发现心境稳定剂可通过影响肠道菌群中毛螺菌科的相对丰度,改善BD患者的症状,为进一步研究肠道菌群在BD发生机制提供指导。未来将扩大样本量,在多个临床研究中来进一步验证该结果的可靠性。
