miR-218-5p改善帕金森病小鼠多巴胺能神经元变性
王丹蕾,薛峥,覃奇雄,李静怡,赵经纬,毛志娟
帕金森病(Parkinson’sdisease,PD)是一种神经退行性疾病,其主要特征是黑质酪氨酸羟化酶(tyrosine hydroxylase,TH)阳性的多巴胺(dopamine,DA)能神经元进行性死亡引起的纹状体多巴胺释放减少,导致运动迟缓、静止性震颤和肌强直等运动功能障碍及认知、情绪障碍和冲动控制障碍等非运动症状[1,2]。目前尚无有效的治疗方法减少DA神经元死亡或延缓PD进展。miRNA(miR)是长度约为22个核苷酸的短链非编码RNA,通过与mRNA的3’端非翻译区(3’Untranslated region,3’UTR)靶向结合调控mRNA的转录和翻译,参与调节哺乳动物多种生物学过程[3]。其中miR-218-5p在神经元中表达丰富,参与神经元的分化、发育[4,5],并在多种神经系统疾病中发挥重要作用[6-8]。本研究发现在1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-Methyl-4-phenyl-1,2,3,6-tetrahydropyridine,MPTP)诱导的急性PD小鼠模型中miR-218-5p表达显著下降,遂通过构建miR-218-5p过表达小鼠,并检测miR-218-5p下游信号通路,来进一步探究其对PD小鼠黑质DA神经元的保护作用及其相关机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 雄性8周C57BL/6J小鼠54只,体质量19~23 g,购于江苏集萃药康生物科技股份有限公司。
1.1.2 主要试剂 MPTP购于美国Sigma公司;mmu-miR-218-5p agomir,agomir NC#22和Bulge-Loop mmu-miR-218-5p Primer Set购于广州锐博生物技术有限公司;兔单克隆TH抗体购于英国Abcam公司;兔多克隆β-actin和鼠多克隆GAPDH抗体购于Proteintech公司;HiScriptⅢ1st Strand cDNA Synthesis Kit(+gDNA wiper)和ChamQ Universal SYBR qPCR Master Mix购于南京诺唯赞生物科技股份有限公司;qPCR引物购于北京擎科生物科技有限公司。
1.2 方法
1.2.1 构建急性PD小鼠模型 18只小鼠随机分配至MPTP组和PBS组,每组9只,分别腹腔注射20 mg/kg MPTP(用无菌PBS配制成4 mg/mL的溶液)或等体积无菌PBS,每2 h注射一次,共4次。造模后第14天处死,心脏灌注后取脑组织进行后续检测。
1.2.2 构建黑质miR-218-5p过表达小鼠模型 将36只小鼠随机平均分为(NCagomir+PBS)组(NCPBS组)、(NC agomir+MPTP)组(NCMPTP组)、(miR-218-5p agomir+PBS)组(218PBS组)、(miR-218-5p agomir+MPTP)组(218MPTP组),每组9只。miR-218-5p agomir和agomir NC粉末分别用无菌PBS溶解,终浓度为0.1 nmol/μL。小鼠经异氟烷麻醉(诱导浓度3%,维持浓度1.5%)后固定在脑立体定位仪上,剪开头顶皮肤,用过氧化氢剥离筋膜,暴露前囟。将前囟定为零点,定位双侧中脑黑质区(AP:-3.0 mm;ML:±1.2 mm;DV:-4.7 mm),颅骨钻将颅骨打通,但不伤及脑实质。使用微量注射泵,以0.5μL/min的速率将miR-218-5p agomir/agomir NC注入小鼠双侧黑质区,注射完成10 min后将针头缓慢抽出,缝合小鼠头皮。3 d后腹腔注射MPTP(或PBS)构建急性PD模型。
1.2.3 脑组织冰冻切片免疫荧光染色 造模后第14天,麻醉小鼠后用PBS和4%多聚甲醛(paraformaldehyde,PFA)溶液灌注,取完整脑组织,浸泡于4%PFA在4℃冰箱过夜固定,后用30%蔗糖脱水3 d。OCT包埋后,用Thermo冰冻切片机按照脑图谱中脑黑质区连续冠状切片(20μm),置于-80℃冰箱保存。染色时将脑片在室温环境复温10 min,用4%PFA固定10 min,用0.3%TritonX-100破膜后,10%胎牛血清室温封闭1 h,兔单克隆TH抗体(1∶200)4℃孵育过夜。第2天将玻片复温后,对应荧光二抗室温孵育1 h,用含DAPI的抗荧光淬灭剂封片。普通荧光显微镜拍照,ImageJ进行细胞计数。
1.2.4 Western blot检测蛋白 造模后第14天,麻醉小鼠后用预冷的PBS溶液灌注,按照图谱提取中脑黑质,匀浆,超声粉碎,12 000 g离心5 min后取上清。采用BCA法绘制标准曲线,测定蛋白浓度,并计算上样量。蛋白样品与缓冲液混合后,95℃水浴10 min变性,上样,进行聚丙烯酰胺凝胶电泳分离,转印至NC膜。NC膜经含5%脱脂奶粉的TBST封闭液37℃封闭1 h,加入一抗,4℃孵育过夜。TBST洗膜10 min×3次,加入HRP标记的相应二抗(1∶5 000稀释),室温孵育1 h;使用BLT GelView 6000 Pro化学发光成像系统扫描显影。ImageJ软件对条带进行灰度值定量。
1.2.5 qPCR法 提取黑质的方法同1.2.4。采用Trizol法提取中脑黑质总RNA,IMPLEN超微量分光光度计测量总RNA浓度,cDNA Synthesis Kit逆转录合成cDNA,再以cDNA为模板进行PCR反应。扩增反应条件:95℃预变性10 min,随后95℃变性15 s,60℃退火延伸1 min,40个循环。以循环阈值(Ct值)作为统计参数,采用2-ΔΔCT法进行数据分析。miR-218-5p的检测采用Bulge-Loop mmu-miR-218-5p Primer Set。其他引物序列见表1。
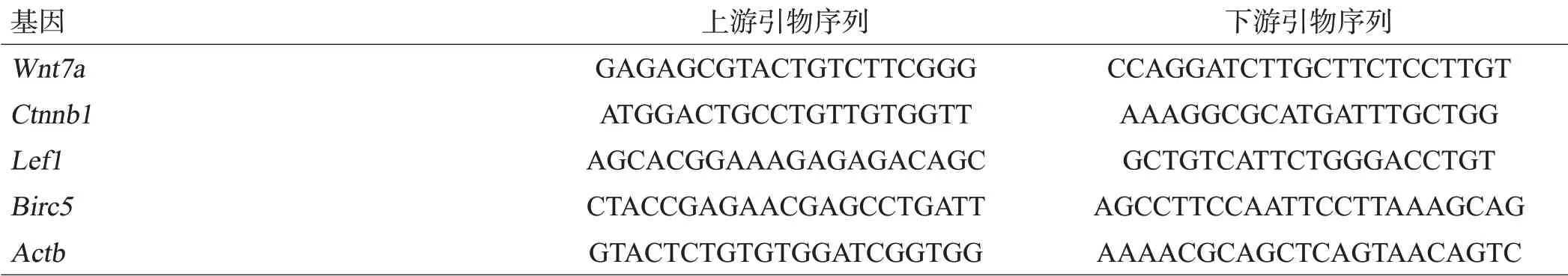
表1 引物序列
1.3 统计学处理
采用SPSS26.0软件处理数据,符合正态分布及方差齐性的计量资料以(±s)表示;两组间比较采用独立t检验,4组间比较采用双因素方差分析;P<0.05为差异有统计学意义。
2 结果
2.1 MPTP诱导的急性PD模型小鼠黑质miR-218-5p表达下降
免疫荧光染色结果显示,与PBS组相比,MPTP组黑质TH+神经元数目显著减少(P<0.001),见图1A;Western blot检测显示,MPTP组黑质TH蛋白表达显著下降(P<0.001),见图1B;qPCR结果显示,MPTP组的小鼠黑质miR-218-5p与PBS组相比下调,差异有统计学意义(P<0.05),见图1C。
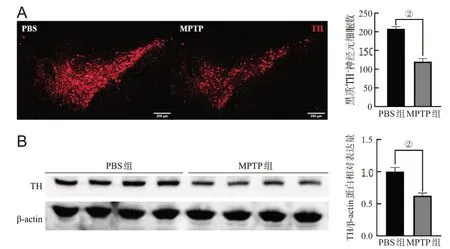
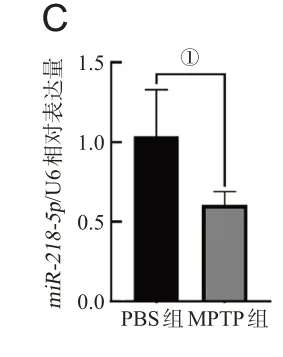
图1 急性PD小鼠黑质miR-218-5p的表达
2.2 miR-218-5p对MPTP小鼠黑质多巴胺能神经元变性的保护作用
qPCR结果显示,miR-218-5p成功过表达(P<0.001),见图2A;免疫荧光染色结果显示,NCMPTP组与NCPBS组相比黑质多巴胺能神经元数目显著减少(P<0.001),218MPTP组与NCMPTP组相比多巴胺能神经元数目显著增加(P<0.001),见图2B。Western blot结果显示,NCMPTP组的TH蛋白表达相较于NCPBS组下降(P<0.05);218MPTP组与NCMPTP组相比上调(P<0.05),见图2C。
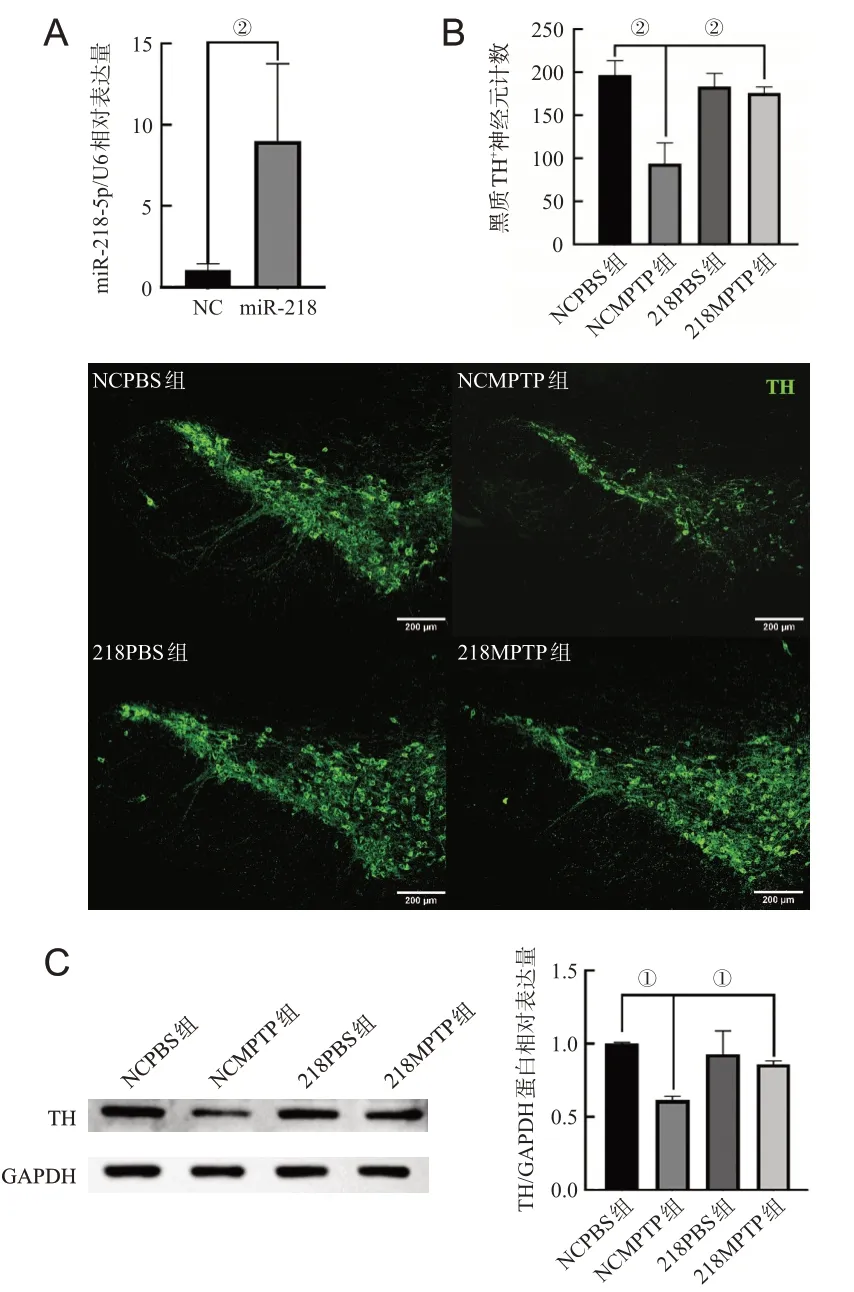
图2 急性PD小鼠黑质miR-218-5p过表达对多巴胺能神经元的影响
2.3 miR-218-5p对小鼠黑质Wnt7a/β-catenin信号通路表达的影响
qPCR结果显示,NCMPTP组与NCPBS组相比,Wnt7a、Ctnnb1、Lef1和Birc5mRNA水平下调(P<0.05),218MPTP组与NCMPTP组相比上调(P<0.05),见图3。
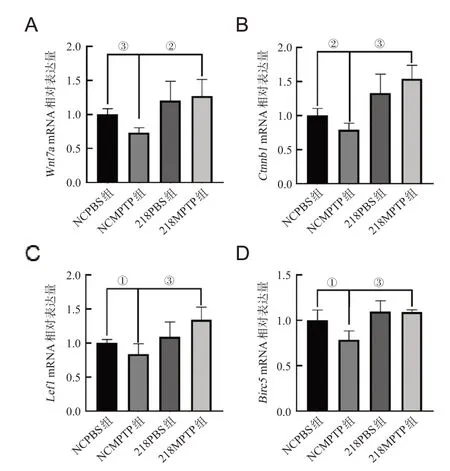
图3 急性PD小鼠黑质miR-218-5p过表达对Wnt/β-catenin信号的影响
3 讨论
PD是一种常见的神经退行性疾病,截至2016年全球已有600万人受累[9],给家庭和社会带来巨大负担。PD多见于中老年人群,主要临床症状为运动迟缓、静止性震颤和姿势步态障碍等运动症状[10],以及嗅觉减退、神经精神症状、自主神经功能障碍和睡眠障碍等非运动症状[11]。目前临床尚无治愈PD或延缓疾病进展的有效手段,因此寻找潜在的疾病修饰策略成为PD研究的热点和重点。PD的主要病理学特征是黑质多巴胺能神经元进行性变性死亡[12]。由于MPTP的代谢产物MPP+可通过破坏神经元线粒体复合物I导致黑质TH+多巴胺能神经元死亡[13],因此本研究采用MPTP急性腹腔注射C57小鼠模拟PD的病理学改变。本研究结果显示,MPTP诱导的急性PD小鼠黑质TH+多巴胺能神经元数目显著减少,并且黑质TH蛋白表达量显著下降,证明PD模型构建成功。
miR-218-5p可调控神经元功能,参与多种神经系统疾病的发生发展[6-8,14]。在抑郁患者以及慢性社交失败应激(chronic social defeat stress,CSDS)模型小鼠的内侧前额叶皮质(medial prefrontal cortex,mPFC)中miR-218表达下降[14],miR-218通过保护mPFC锥体神经元树突棘减轻CSDS诱导的抑郁样行为[7]。miR-218还通过靶向调控补体C3调节海马神经元的突触前功能,在认知功能中发挥重要作用[8]。miR-218在肌萎缩侧索硬化症患者的运动神经元中表达显著减少,通过靶向钾通道蛋白基因Kv10.1调控神经元兴奋性[6]。有研究表明,PD患者前额叶皮质的miR-218-5p表达下降,其表达水平与炎症因子TNF-α、IL-1β和IFN-γ的水平呈负相关[15]。此外,在6-OHDA诱导的PD模型大鼠黑质中miR-218-5p表达下降,过表达miR-218-5p通过靶向调节LASP1减轻多巴胺能神经元的氧化应激和炎症反应[16]。本研究结果显示,PD小鼠黑质miR-218-5p表达显著下降;与未过表达miR-218-5p的PD小鼠相比,过表达miR-218-5p的PD小鼠中黑质TH+多巴胺能神经元丢失减少和TH蛋白表达量增加,这提示miR-218-5p对MPTP诱导的多巴胺能神经元损伤有保护作用,与上述研究结果一致。但最近有研究显示晚期PD患者黑质miR-218-5p表达上调[17],与本研究结果矛盾,可能由于PD动物模型模拟的疾病状态与晚期PD患者存在差异,而且该研究未探讨miR-218-5p对PD病理学的影响。
Wnt/β-catenin信号通路是以β-catenin激活下游基因转录为标志的经典Wnt信号通路。分泌蛋白Wnt家族(如Wnt1、Wnt3a、Wnt5a、Wnt7a等)与跨膜蛋白Frizzled胞外段的富含半胱氨酸结构域CRD及LRP5/6相互作用,使下游促进β-catenin蛋白磷酸化降解的复合物解体,从而诱导β-catenin入核,与淋巴样增强因子和T细胞因子家族转录因子(lymphoid enhancer-binding factor/T-cell factor,LEF/TCF)形成复合物激活下游基因转录[18,19]。Wnt/β-catenin信号通路可参与PD的发生发展过程,有研究发现MPTP模型PD小鼠在早期出现腹侧中脑β-catenin和Frizzled的表达下降及星形胶质细胞Wnt1的增加,与多巴胺能神经元损伤和神经胶质细胞激活同步[20],敲低星形胶质细胞的Wnt1或拮抗多巴胺能神经元的β-catenin和Frizzled可促进多巴胺能神经元变性和反应性星形胶质细胞增多[21]。本研究结果显示,MPTP诱导的PD模型小鼠黑质Wnt家族基因Wnt7a,编码β-catenin的基因Ctnnb1以及转录因子基因Lef-1的表达均明显下降,与上述研究结果一致。此外,β-catenin下游的靶基因Birc5表达的Survivin蛋白具有抗凋亡作用[22],而笔者检测到该基因在PD小鼠黑质中的表达显著下降和多巴胺能神经元的减少。这可能是由于MPTP诱导的小鼠黑质Wnt/β-catenin信号下调导致Survivin表达减少,从而减弱了对多巴胺能神经元的保护作用。
在许多疾病的研究中,miR-218-5p可激活Wnt/β-catenin信号参与疾病进程。miR-218-5p可通过靶向DKK2和SFRP2增强Wnt/β-catenin信号,促进人类脂肪来源的干细胞成骨分化[23]。此外,真皮外泌体中的miR-218-5p也通过抑制SFRP2上调β-catenin信号促进了毛囊的发育[24]。本研究结果显示,过表达miR-218-5p过表达抑制了PD小鼠黑质多巴胺能神经元的减少,并且使Wnt/β-catenin信号相关基因Wnt7a、Ctnnb1、Lef1和Birc5表达增加。以上结果提示,miR-218-5p在黑质的过表达可能通过增强Wnt/β-catenin信号对PD小鼠的多巴胺能神经元产生保护作用。
综上,本研究发现miR-218-5p对MPTP诱导的PD小鼠多巴胺能神经元的变性死亡具有保护作用,可能通过调控Wnt/β-catenin信号实现,这可能为PD提供了潜在的治疗靶点。但本研究存在一定的不足,miR-218-5p通过靶向何种基因调节Wnt/β-catenin信号尚未明确,这将是下一步研究的重点。
