醋酸棉酚通过诱导铁死亡抑制脑胶质瘤细胞生长
杨洋, 杨梦婷, 许潇
(江苏大学医学院, 江苏 镇江 212013)
脑胶质瘤生存率极低,目前主要通过手术切除和化疗等方法治疗;由于其侵袭性较高,且易浸润周围脑组织,导致临床治疗效果有限[1]。前期研究发现,醋酸棉酚(gossypol acetate,GAA)可以促进脑胶质瘤细胞的自噬和凋亡,有较好的抗肿瘤活性[2]。铁死亡是铁依赖性氧化应激的细胞死亡方式,与多种肿瘤细胞的生长调控相关[3]。基于GAA的化学本质,推测其可能是一种铁死亡诱导剂,但对脑胶质瘤细胞铁死亡的影响尚不清楚。因此,本研究拟探讨GAA诱导脑胶质瘤细胞发生铁死亡的生物学效应。
1 材料与方法
1.1 细胞及主要试剂
人脑胶质瘤U87MG、LN229和U251MG细胞株购于中国科学院上海生命科学研究院。GAA购自上海生工生物公司;PBS和高糖DMEM购自美国Hyclone公司;澳洲胎牛血清购自美国Gibco公司;Transwell小室购自美国Coming Incorporated公司;CCK-8试剂、BCA蛋白质定量试剂盒购自南京诺唯赞公司;兔抗人β-微管蛋白、谷胱甘肽过氧化物酶4(GPX4)多克隆抗体购自美国Cell Signaling Technology公司;羊抗兔二抗购自ABclonal公司;微量还原型谷胱甘肽(GSH)试剂盒(微板法)、丙二醛检测试剂盒(TBA法)购自南京建成生物公司;特异性铁死亡挽救剂3-氨基-4-环己基氨基苯甲酸乙酯(Ferrostatin-1)购自美国MedChemExpress公司。
1.2 方法
1.2.1 细胞培养 3种人脑胶质瘤细胞用含有10%胎牛血清的高糖DMEM,于5%CO2、37 ℃的恒温细胞培养箱中培养。当细胞生长密度达70%~90%时,用0.25%胰蛋白酶进行消化传代。
1.2.2 细胞分组及处理 根据本课题组前期研究结果[4],U87MG、LN229和U251MG细胞的IC50分别为14.50、9.38和10.39 μmol/L。将3种人脑胶质瘤细胞各分为2组:0 μmol/L GAA组和10 μmol/L GAA组,分别予以对应浓度的GAA处理72 h;然后进行后续实验。
另将3种人脑胶质瘤细胞各分为4组:0 μmol/L GAA+0 μmol/L Ferrostatin-1组、0 μmol/L GAA+1 μmol/L Ferrostatin-1组、10 μmol/L GAA+0 μmol/L Ferrostatin-1组、10 μmol/L GAA+1 μmol/L Ferrostatin-1组,分别予以对应浓度的GAA和Ferrostatin-1处理72 h。
1.2.3 CCK-8法检测细胞增殖率 取“1.2.2”分组细胞接种于96孔板,每孔接种1 000个细胞,加入100 μL培养基,每组设3个复孔。分别在1、2、3、4、5、6 d每孔加入10 μL CCK-8,培养2 h;用酶标仪(BioTek 800TS)检测每孔450 nm波长处光密度(D)值。细胞相对增殖率(%)=(D加药-D空白)/(D未加药-D空白)×100%。
1.2.4 细胞克隆形成实验 取“1.2.2”分组细胞接种于6孔板,每孔接种1 000个细胞,加入2 mL培养基,每组设3个复孔,每隔4 d更换一次培养基,连续培养14 d后,在倒置普通光学显微镜可以观察到明显的细胞集落。用4%多聚甲醛固定30 min;结晶紫染色15 min;PBS洗涤3遍;拍照并计算细胞克隆数。
1.2.5 实时荧光定量PCR检测GPX4mRNA表达 取“1.2.2”分组细胞,按照Trizol试剂说明书提取总RNA,并逆转录成模板cDNA,进行qRT-PCR体系配置及扩增。配置10 μL反应体系:cDNA溶液0.5 μL,上、下游引物各0.2 μL,2×SYBR Premix ExTaqTM5 μL、无RNA酶双蒸水4.1 μL。扩增程序:94 ℃预变性5 min,94 ℃ 10 s,56 ℃ 30 s,72 ℃ 30 s,重复40个循环。GPX4mRNA引物序列:上游为5′-CCCATTCCTGAACCTTTCAA-3′,下游为5′-TCATGTCCCCAAAGCACG-3′;β-肌动蛋白引物序列:上游为5′-GTGGGGCGCCCCAGGCACCA-3′,下游为5′-CTTTAGCACGCACTGTAATTCCTC-3′。β-肌动蛋白作为内参,用2-ΔΔCt值计算目的基因mRNA相对表达量。
1.2.6 蛋白质免疫印迹法检测GPX4蛋白表达 取“1.2.2”分组细胞,分别加入适量上样缓冲液裂解细胞,100 ℃水浴10 min;4 ℃行12 000×g离心10 min,取上清液。取10 μL样品行10% SDS-PAGE,恒压100 V电泳1 h;300 mA恒流湿转150 min将蛋白质转移至PVDF膜;5%脱脂奶粉封闭1 h;加入一抗(GPX4稀释比为1 ∶1 000,内参β-微管蛋白稀释比为1 ∶2 500)4 ℃孵育过夜;TBST洗膜3次,每次10 min;加入羊抗兔二抗(稀释比为1 ∶20 000)室温孵育1 h;TBST洗膜3次,每次10 min;ECL发光液显影;利用凝胶成像仪(Minichemi 610)拍照保存并进行分析。
1.2.7 GSH和丙二醛含量测定 取“1.2.2”分组细胞,分别加入300 μL预冷PBS,超声破碎细胞;4 ℃行3 500 r/min离心10 min,取上清液。根据试剂盒产品说明书,用酶标仪分别检测405 nm和532 nm波长处D值。根据标准曲线计算浓度。根据BCA试剂盒测得的蛋白浓度,计算GSH和丙二醛相对含量。
1.3 统计学分析
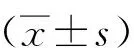
2 结果
2.1 GAA抑制脑胶质瘤细胞增殖
CCK-8结果显示,与 0 μmol/L GAA组比较,10 μmol/L GAA组U87MG、LN229和U251MG脑胶质瘤细胞相对增殖率从第3~6天均显著降低(P均<0.05),且随时间延长,细胞相对增殖率差值越来越大,在第6天时差异最显著。细胞克隆形成实验结果显示,与0 μmol/L GAA组比较,10 μmol/L GAA组3种脑胶质瘤细胞克隆形成数均明显减少(P均<0.05)。见图1。由此可见,GAA可持续抑制脑胶质瘤细胞增殖。
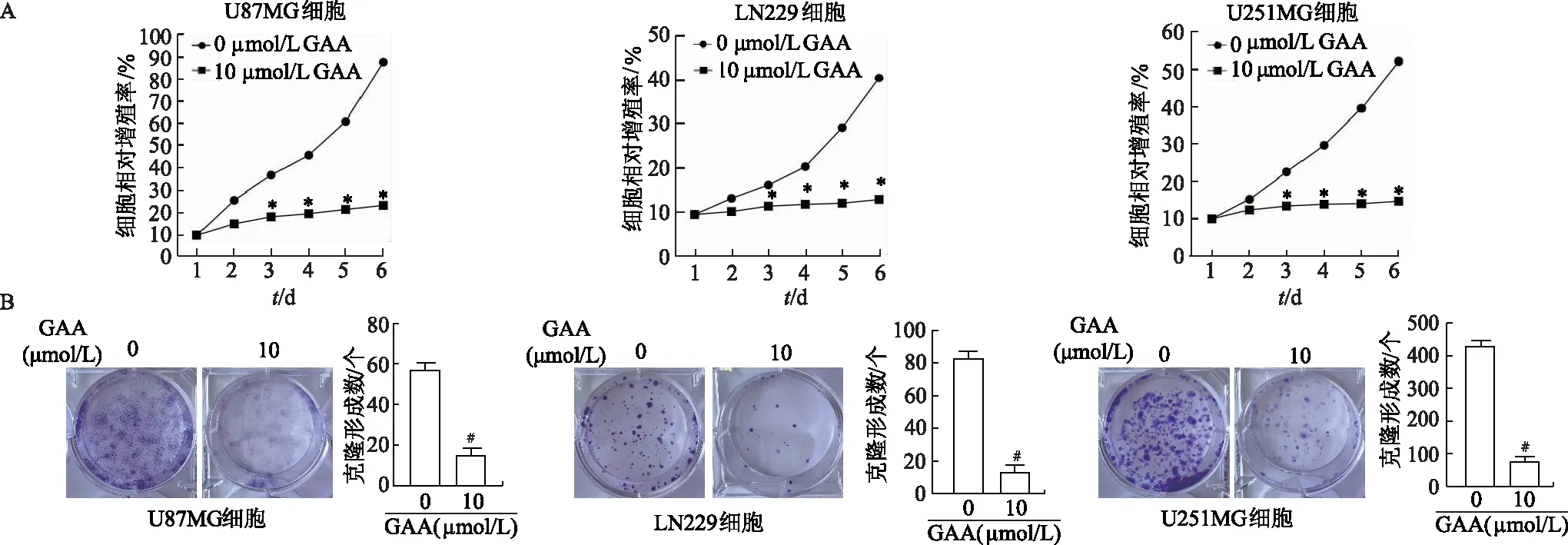
A:CCK-8法检测3种脑胶质瘤细胞相对增殖率;B:克隆形成实验检测3种脑胶质瘤细胞增殖能力;*:P<0.05,与对应时间点0 μmol/L GAA组相比;#:P<0.05,与0 μmol/L GAA组相比
2.2 GAA可引起脑胶质瘤细胞铁死亡
CCK-8结果显示,与10 μmol/L GAA+ 0 μmol/L Ferrostatin-1组相比,10 μmol/L GAA+1 μmol/L Ferrostatin-1组3种脑胶质瘤细胞相对增殖率明显升高(P均<0.05),且LN229和U251MG细胞较U87MG细胞更为明显。见图2。由此表明,特异性铁死亡挽救剂Ferrostatin-1可部分挽救GAA引起的细胞死亡,推测GAA引起的细胞死亡可能与细胞铁死亡相关,且LN229和U251MG细胞对其较为敏感。
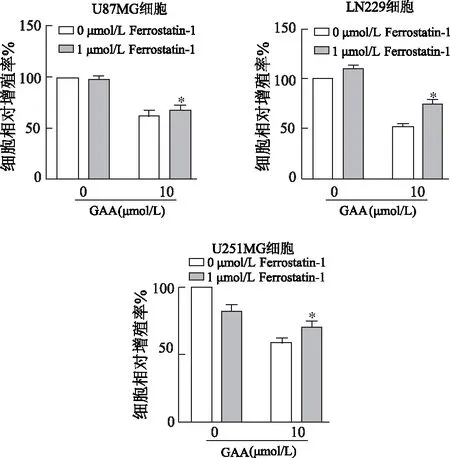
*:P<0.05,与0 μmol/L Ferrostatin-1+10 μmol/L GAA组比较
2.3 GAA抑制脑胶质瘤中GPX4表达
结果显示(图3),在U87MG、LN229和U251MG 3种脑胶质瘤细胞中,与0 μmol/L GAA组相比,10 μmol/L GAA组GPX4mRNA表达水平均明显降低(P均<0.05),其中U251MG细胞最明显。蛋白质免疫印迹结果也显示,与0 μmol/L GAA 组比较,10 μmol/L GAA组3种脑胶质瘤细胞中GPX4蛋白表达水平明显降低(P均<0.05)。见图4。由此推测,GAA可以通过抑制GPX4 mRNA和蛋白表达,诱导脑胶质瘤细胞发生铁死亡。
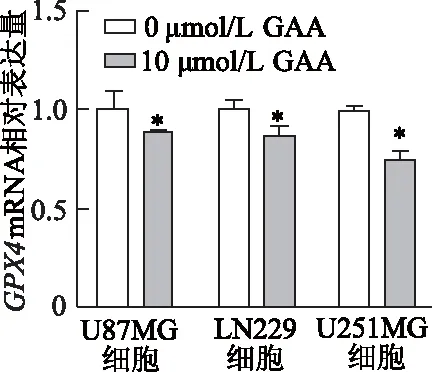
*:P<0.05,与0 μmol/L GAA组比较
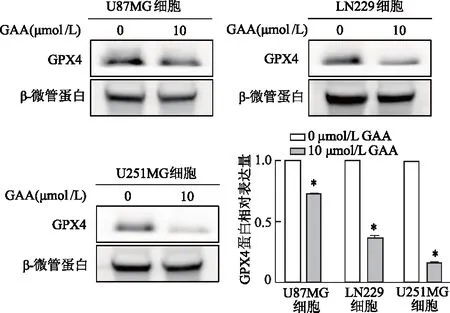
*:P<0.05,与0 μmol/L GAA组比较
2.4 GAA致脑胶质瘤细胞中GSH和丙二醛含量改变
结果如图5所示,与0 μmol/L GAA组相比,10 μmol/L GAA组LN229和U251MG细胞中GSH相对含量明显减少(P均<0.05),丙二醛含量明显增加(P均<0.05);但是,U87MG细胞中GSH和丙二醛相对含量无显著变化(P>0.05)。由此提示,GAA可能诱导LN229和U251MG细胞发生铁死亡,而对U87MG细胞作用效应不明显。
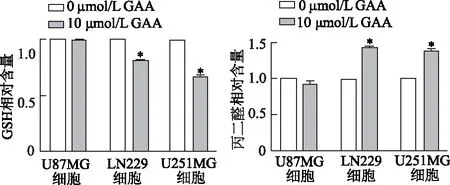
*:P<0.05,与0 μmol/L GAA组相比
3 讨论
GAA是一种多元酚醛类化合物,具有多种药理活性,包括抗生育能力、抗菌、抗肿瘤和抗氧化等[5],是一种新型抗癌药物[6]。目前已广泛用于男性避孕和治疗子宫肌瘤、子宫内膜异位症等妇科疾病[7-8]。
本研究发现,GAA可能通过抑制GPX4表达,诱导脑胶质瘤细胞发生铁死亡,且其生物学效应具有细胞特异性。细胞铁死亡的实质是由于GPX4失能,细胞内脂质氧化物代谢障碍,在铁离子作用下,造成膜脂上活性氧自由基堆积,使细胞内氧化还原失衡,进而诱导细胞死亡[9];常见的检测指标包括细胞活性、细胞内铁水平、细胞内脂质过氧化物以及细胞内与铁死亡相关的因子(GPX4, SLC7A11等)。本研究发现,特异性铁死亡挽救剂Ferrostatin-1可以显著降低GAA引起的脑胶质瘤细胞死亡,并且GAA引起细胞内GSH含量下降、丙二醛含量增加,初步证明GAA诱导脑胶质瘤细胞发生铁死亡进而发挥其抗脑胶质瘤的作用,理论上进一步补充了GAA的药理作用机制。
GPX4是铁死亡的主要靶点,其活性抑制可打破氧化平衡,导致脂质过氧化物破坏细胞膜结构,从而激发细胞铁死亡[10]。早期研究发现,GAA处理可导致脑胶质瘤细胞中线粒体蛋白质簇显著减少,血红素加氧酶1显著上调[11],介导血红素中铁离子释放及积蓄[12]。因此,推测GAA可能通过血红素加氧酶1而诱导细胞发生铁死亡,但具体机制尚需进一步阐明。本研究发现,GAA明显抑制脑胶质瘤细胞中GPX4 mRNA和蛋白表达,并且致细胞内还原型GSH含量明显降低,脂质过氧化物丙二醛含量显著增加,由此表明GAA可以通过抑制GPX4途径诱导脑胶质瘤细胞发生铁死亡。
综上所述,本研究表明GAA通过抑制GPX4途径诱导脑胶质瘤细胞发生铁死亡,从而抑制脑胶质瘤生长,由于脑胶质瘤细胞分型不同,其对药物的生物学效应具有细胞特异性。GAA调控GPX4通路的具体机制以及对不同类型脑胶质瘤的敏感性差异仍有待进一步研究。

