基于5E教学模式的“质量守恒定律”教学设计
丁艳梅
摘要:基于5E教学模式,进行“质量守恒定律”的教学设计。以物质的燃烧、氧气的制备等化学实验作为具体实验案例,通过设计实验方案、开展实验操作、归纳实验结果、讨论现象原理、评价实验流程等步骤,将5E教学模式运用到教学之中。
关键词:5E教学模式;质量守恒定律;初中科学
文章编号:1008-0546(2022)10x-0051-04中图分类号:G632.41文献标识码:B
一、教材分析和思路设计
“质量守恒定律”是浙教版初中《科学》教材八年级下册第三章第三节化学方程式第1课时的内容。本课时之前,学生已经学习了化学变化与物理变化的区别,分子、原子的基本知识,化学式的书写,实验室制取氧气的方法等内容。质量守恒定律是学习化学反应方程式的基础,因此,本节课的学习内容对后续学习化学反应方程式的书写、计算,巩固化学反应的知识至关重要。
如何通过实验测定的数据来探究质量守恒定律,以及在微观角度上理解质量守恒定律是本节课的重难点。5E教学模式主要包括参与(Engage)、探究(Ex?plore)、解释(Explain)、迁移(Elaborate)、评价(Evalu?ate)五个环节,[1]以此为基础设计本课的教学思路如图1所示。
二、教学目标
1.理解质量守恒定律,能从微观角度解释化学反应前后质量守恒的原因。
2.自主设计实验方案,测定化学反应前后物质质量变化,探究质量守恒规律,培养学生动手实践能力。
通过对化学反应实质的分析,认识化学反应前后物质质量守恒的本质原因,培养学生逻辑推理能力。
3.通过实验探究,培养学生科学、严谨的探究态度;通过小组合作、组间互评,培养学生善于合作、积极评价、勇于创新的精神。
三、教学过程
1.参与(Engage)
图2是参与环节的教学流程。
[教师]给出木头燃烧后留下的灰烬、蜡烛燃烧留下的蜡油和铁钉生锈的图片。提出问题:化学反应前后物质的质量是如何变化的?
[学生]木头燃烧后、蜡烛燃烧后质量减少。铁钉生锈后质量增加。
[演示实验]将锥形瓶置于天平托盘上,调节平衡。然后取下锥形瓶,将胶头滴管内的溶液滴入瓶内,使两种溶液混合反应,生成蓝色氢氧化铜沉淀。再将锥形瓶放回天平托盘上,观察是否平衡(见图3)。
[教师]通过这个实验可以得出结论:化学反应前后物质的质量是如何变化的呢?
[学生]不变。
[教师]为什么老师演示实验与木头燃烧、蜡烛燃烧、铁钉生锈会出现不同的质量变化呢?实验装置有什么特点?这样做有什么好处?
[学生]硫酸铜溶液与氢氧化钠溶液反应的实验装置是密封的,这样可以防止实验中的物质与外界发生交换。
[教师]要分析化学反应前后物质的质量是如何变化的,需要设计合适的实验装置进行实验探究。接下来我们通过其他的化学反应的实验,寻找化学反应前后物质的质量变化的规律。
2.探究(Explore)
图4是探究环节的教学流程。
[学生活动]将学生分成6组设计用过氧化氢溶液制取氧气的实验装置,探究化学反应前后质量变化的规律。每个小组在上课前发了一个资料袋,资料袋内放置了部分可能用到的实验仪器图片(见图5)供学生参考。
[学生]以小组为单位设计实验装置,并将实验装置图粘贴在A3纸上。时间3分钟。
[教师]全班巡视,学生遇到困难或者没有思路时,用问题引导学生思考:①演示实验的装置有没有可供借鉴之处?如何形成一个封闭的装置?如何控制反应发生?②能不能将产生的氧气收集起来并得到氧气的质量?
[学生]各小组派代表汇报本组的实验装置和大致实验方案。
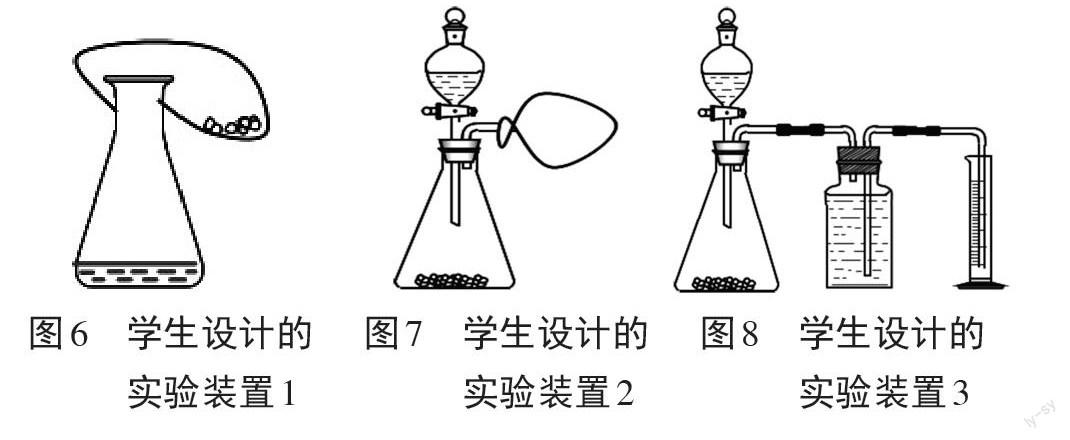
图6~图8为学生设计的实验装置图。
学生设计的实验方案简介:
如图6,锥形瓶内盛放适量的过氧化氢溶液,气球内加入适量二氧化锰,气球在锥形瓶口处扎紧。将整个装置置于天平托盘上,调节平衡。然后将气球内的二氧化锰慢慢倒入锥形瓶内,充分反应后再将锥形瓶放回天平托盘上,观察是否平衡。
如图7,锥形瓶内盛放适量二氧化锰,分液漏斗内加入适量的过氧化氢溶液,导管口处系紧一个气球,用于收集产生的氧气,将整个装置置于天平托盘上,调节平衡。然后将分液漏斗中的溶液加入锥形瓶内,转动活塞停止加入溶液,充分反应后再将锥形瓶放回天平托盘上,观察是否平衡。
如图8,与图7装置类似,导管口连接一个充满水的集气瓶,最右侧放置量筒。将锥形瓶置于天平托盘上,调节平衡,读出并记录质量m1。然后将所有装置连接好,转动活塞将分液漏斗中的溶液加入锥形瓶内,转动活塞停止加入溶液,充分反应后再将锥形瓶放回天平托盘上,调节平衡,读出并记录质量m2。读取量筒内水的体积V1,量筒中水的体积即产生的氧气的体积,乘以氧气的密度,得到氧气的质量m3。比较m1和m2+m3的关系。
评价、改进实验方案:小组之间进行评价,从实验的科学性、可行性、方便性等进行评价,最终学生一致认为图6的设计可以在实现探究目的的同时节省器材、方便搭建、操作简单。
然后小组合作按图6的装置进行实验。
3.解释(Explain)
图9是解释环节的教学流程。
[学生]交流实验结果:最终天平不平衡。
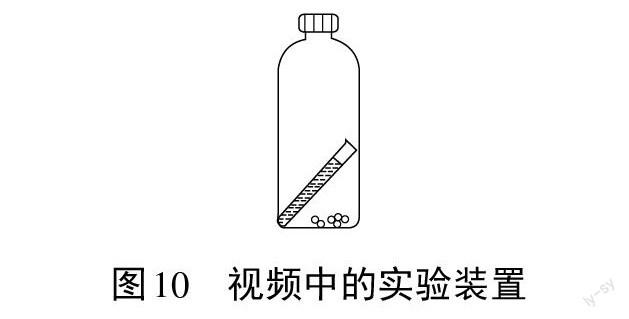
[教师]这是不是意味着化学反应前后质量改变呢?播放提前录制好的视频:用图10所示的实验装置进行实验。小试管内盛放过氧化氢溶液,塑料瓶内放置二氧化锰,将装置置于天平托盘上,调节平衡。再将瓶子倾斜,让小试管中溶液流出,充分反应后再將塑料瓶放回天平托盘上,此时天平平衡。
[教师]视频中的方案和我们自己设计的方案为什么得到的实验结果不同?问题出在哪里?
[学生]我们自己设计的实验中用到了气球,气球膨胀,在空气中受到浮力,从而影响了实验结果。
[教师]同学们设计实验时为什么用到了气球?图10装置中的塑料瓶换成锥形瓶和橡胶塞可以吗?
[学生]不可更换,气球起到缓冲作用,如果换成锥形瓶和橡胶塞,反应中锥形瓶内气压过大会导致橡胶塞飞出,导致实验失败。
[教师]实验设计时既要防止物质与外界发生交换,也要避免浮力等因素的干扰。
[教师]大量实验表明:参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。这个规律就是质量守恒定律。
设计意图:利于学生深入思考,也表明对实验装置的不断改进是获得正确实验结论的必不可少的步骤。
[教师]为什么在发生化学反应前后,各物质的质量总和相等呢?给出砷和氧气发生化学反应的微观过程图示(见图11),请同学们观察并填写表1。
[教师]你能从微观角度解释为什么化学反应前后各物质的质量总和相等吗?
[学生]化学反应前后,原子的种类、原子的数目、原子的质量都不变,所以物质的总质量不变。
总结:化学反应的实质是分子中的原子重新組合成新的分子。反应前后原子种类和数目没有变化,所以化学反应前后各物质质量总和必然相等。
练习:在化学反应前后,下列选项中,一定会改变的有,一定不会改变的有,可能会改变的有。
A.物质种类D.分子数目G.元素种类 B.物质总质量E.原子种类H.原子质量 C.分子种类F.原子数目I.物质状态
4.迁移(Elaborate)
图12是迁移环节的教学流程。
[教师]请同学们解释木头燃烧后、蜡烛燃烧后质量为什么会减少?铁钉生锈后质量为什么会增加?这些反应符合质量守恒定律吗?
[学生]符合质量守恒定律。木头、蜡烛燃烧后质量减少是因为部分生成物进入到了空气中。铁钉生锈后质量增加是因为反应物除了铁钉之外还有空气中的氧气。
设计意图:与“引入”呼应,利用“新知”质量守恒定律解决问题,同时纠正“旧知”的思维方式上的问题。
[教师]蜡烛燃烧后生成二氧化碳和水,你能根据这一事实,推断出蜡烛中肯定有什么元素?可能有什么元素?
[学生]一定会有碳元素和氢元素,可能含有氧元素。
设计意图:引发同学们思考,解决认知上的矛盾,对生活中的现象建立科学的解释。
5.评价(Evaluate)
图13是各环节的学习评价。
评价环节贯穿课堂始终。在探究环节中,每个小组设计的方案会被其他小组进行评价。评价包括:优点和可以改进之处。解释环节中通过学生对数据的处理、解释以及练习,对学生知识建构进行评价。迁移环节中,通过几个问题的提问,评价学生对本节课核心概念的理解和掌握。
四、结语
5E教学模式本质是以科学探究为核心的教学流程模式,[2]基于5E教学模式的“质量守恒定律”教学取得了比较理想的效果。以导入生活中常见的现象引发旧知冲突,通过自主设计实验方案、动手实验、改进实验方案让学生自主获得新知,最终利用新知科学解释生活中的现象。课堂教学中有过程性评价也有结果性评价,鼓励学生积极参与课堂活动。
参考文献
[1]王健,李秀菊.5E教学模式的内涵及其对我国理科教育的启示[J].生物学通报,2012(3):39-42.
[2]刘婷.指向问题解决的科学教学“5E”模式探析[J].基础教育课程,2021(1):44-49.

