一种提高动物源性食品中克伦特罗的检测精度的方法
黄永生 何玉榆 李湘媛 邱永为
摘 要:本研究基于液相色谱-串联质谱建立了一种高精密度检测克伦特罗的方法,对所建立的方法进行了方法学的考察与验证,参考已有的标准,对标准的相关处理步骤进行优化,采用液相色谱-串联质谱法进行分析。其标准曲线相关系数为0.999 98,方法检出限为0.045 5 μg/kg,回收率范围为93.2%~99.6%,相对标准偏差为1.2%~2.2%。所得结果表明,该方法检出限低,回收率较好,精准度高,重复性好,可以为检测动物源性食品中的克伦特罗提供有力的方法支撑。
关键词:克伦特罗;液相色谱-串联质谱;高精密度
中图分类号:S859.84 文献标志码:A 文章编号:1001-0769(2022)04-0088-04
克伦特罗(clenbuterol),化学名为1-(4-氨基-3,5-二氯苯基)-2-(叔丁基-D9-氨基)乙醇,俗稱“瘦肉精”,是一种β2-肾上腺素受体促效剂(β2-adrenergic agonist),临床上常被用作缓和气喘急性发作时的支气管扩张剂,用于治疗哮喘以及休克等疾病[1]。此类药物对动物脂肪的合成具有抑制作用,进而改变禽畜体内的代谢途径,有效促进禽畜的肌肉生长和骨骼肌蛋白的合成,提高家畜体内的瘦肉比例,因此常被非法商家当做特殊用途的饲料添加剂加入家畜的饲料中,以提高畜牧生产效益[2]。但是,这种做法会导致动物源性食物中的克伦特罗含量超标,且由于其具有稳定的性质,家畜摄入后很难代谢分解,容易在体内聚积,会随着屠宰后进入市场。在国内外也引发过一系列的由于克伦特罗残留导致食物中毒的事件,引起人们的高度重视[3-4]。我国农业农村部在第235号公告《动物性食品中兽药最高残留限量》中将克伦特罗及其盐类物质列为年度监测计划。在第176号等公告明确了在动物饲养过程中禁止使用盐酸克伦特罗。因此,开发和研究高效的克伦特罗检出分析技术一直是食品安全检测领域的热点。
当前,动物源性食物中的克伦特罗的检测主要采用酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)[5]、胶体金免疫层析法[6-7]、表面等离子体共振生物芯片[8]、气相色谱-质谱法(gas chromatography-mass spectrometer,GC-MS)、高效液相色谱(high performance liquid chromatography,HPLC)、液相色谱-质谱法(liquid chromatography-mass spectrometry,LC-MS)等[2,9-11]。ELISA灵敏度较高,但易出现假阳性结果,重现性较差;胶体金免疫层析法适合大规模检测,但易受环境因素影响,导致检查结果存在一定误差;表面等离子体共振生物芯片适合现场实时连续快速检测,但灵敏度较低;GC-MS的处理过程繁琐效率过低。对此,利用LC-MS检测克伦特罗就成为了较好的选择,其拥有高效的分离能力和准确的定性定量能力,具有灵敏度高、所得信息量大、效率较高等优点。
本研究参考了农业农村部1025公告-18-2008《动物源性食品中β-受体激动剂残留检测 液相色谱-串联质谱法》、GB/T21313-2007《动物源性食品中-受体激动剂残留检测方法 液相色谱-质谱/质谱法》、GB/T22286-2008《动物源性食品中多种β-受 体激动剂残留量的测定 液相色谱串联质谱在法》[13-15]等,并对上述标准进行了相应的优化整合,对动物源性食品中的克伦特罗进行定性与定量分析,优化了前处理操作,采用了多种反应监测模式测定,有效地提高了工作效率,为动物源性食品中克伦特罗的检测提供有力的技术支持。
1 使用材料及操作步骤
1.1 操作仪器与所用试剂
1.1.1 仪器
安捷伦1290液相色谱仪、AB Science质谱仪、漩涡混合仪、电子天平、恒温水浴摇床、氮吹仪、超纯水仪、超声波清洗机、冷冻离心机、混合型阳离子(mixed-mode cation exchanger,MCX)固相萃取柱(规格:3 cc,60 mg)。
1.1.2 药品与试剂
0.2 mol/L乙酸铵(pH=5.2);0.1 mol/L高氯酸溶液;5%氨化甲醇;甲醇(色谱纯)、甲酸(色谱纯);乙酸(分析纯);氢氧化钠(分析纯);β-葡萄糖醛苷酸酶/芳基硫酸酯酶(20 U/mL);复溶液:甲醇/水/甲酸(10∶90∶0.09,v/v/v)。
1.2 检测样品制备
取适量新鲜肌肉样品组织,将其搅碎至均匀态,于-20 ℃避光保存。
1.3 标液配制
取出克伦特罗的标准品,称取适量,将其用甲醇配成0.1 mg/mL的标准储备液,将其置于-20 ℃冰箱中保存,有效期4个月;之后对克伦特罗标准储备液用甲醇进行逐级稀释,配制成相应浓度的克伦特罗标准工作液,现配现用。
1.4 样品前处理
准确称取2.00 g(± 0.01 g)试样,置于50 mL离心管中,加入8.0 mL 0.2 moL/L乙酸铵溶液(pH=5.2)和40 ?L β-葡萄糖醛苷酸酶/芳基硫酸酯酶(20 U/mL),加盖2 000 r/min涡旋振荡8 min,37 ℃恒温摇床避光酶解18 h。酶解后放置至室温,在酶解液中加入300 ?L高氯酸(将pH调至1.00),涡旋30 s,10 000 r/min 低温离心5 min,移上清液于另一离心管中。在残渣中加入2 mL 0.1 mol/L高氯酸溶液,涡旋30 s,10 000 r/min低温离心5 min,合并上清液。上清液中加入570 μL 5 mol/L的NaOH(将pH调至4.00),备用。
MCX固相萃取柱分别依次用5 mL甲醇、5 mL水活化。取备用液全部过柱,再依次用5 mL水、5 mL甲醇淋洗小柱,抽干。用5 mL 5%氨化甲醇洗脱,收集至15 mL塑料离心管。洗脱液在50 ℃下氮气吹干,加入复溶液将吹干后洗脱液定容至1.00 mL,涡旋剧烈震荡5 min,使用1 mL注射器过0.22 μm的滤膜,供液质联用仪测定。
2 结果与讨论
2.1 标准曲线
按照农业农村部1025号公告-18-2008《动物源性食品中β–受体激动剂残留检测 液相色谱–串联质谱法》标准设置仪器条件,配制一系列浓度的标准样品溶液(0.25 ?g/kg、 0.50 ?g/kg、1.00 ?g/kg、2.50 ?g/kg、 5.00 ?g/kg),待仪器条件合适后,对标液进行测定,对得到的数据进行标准曲线的绘制,其相关系数为R2=0.999 98。
2.2 方法检出限测定
以空白的畜禽肌肉样品作为基质,制作阳性样,浓度C(0.25 ?g/kg),按照上述的方法进行前处理操作,之后用液质联用仪测定,测得克伦特罗的信噪比为S/N=16.5,由此得到其检出限为0.045 5 ?g/kg。
2.3 回收率及精密度确定
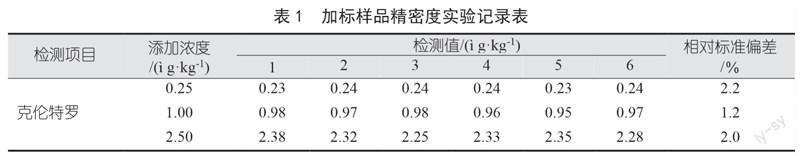
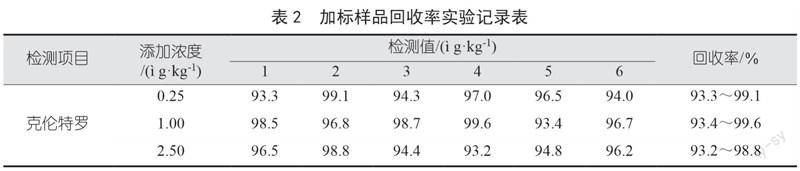
以空白畜禽肌肉组织为基质,进行加标回收率测定试验,加标浓度分别为0.25 ?g/kg、1.00 ?g/kg、2.50 ?g/kg。将加标后的样品及空白的组织样品按照前处理的方法操作,上机进行测试,得到相应的精密度及回收率结果如表1、表2所示。根据表1与表2中相对标准偏差和回收率结果可发现,该方法的相对标准偏差较低,且回收率表现较好,克伦特罗的回收率范围为93.2%~99.6%,相对标准偏差为1.2%~2.2%。该方法的检出限较低、重复性较好,也能保持较为优异的回收率,可用于克伦特罗的定性、定量检测。
3 結论
本研究提出了一种高效检测克伦特罗的方法,优化了相关标准提取步骤,采用乙酸铵对酶解后的畜禽肌肉组织进行提取,得到的溶液通过离心后取上清液进行过柱净化,利用液质联用仪进行测定。整个过程所进行操作简单,前处理时不需要太精密的仪器,同时所需的有机试剂较少。结果表明,该方法的检出限低,回收率较好,且重复效果好,有效地消除了基质效应的干扰,提高了克伦特罗的方法检测的准确性及精密度,有效地节约了检测的成本与时间,提升了检测的效率。通过不同中的抽检样品的实际测试证明,本方法适用于绝大多数畜禽肌肉组织中克伦特罗的快速定性、定量检测。
参考文献
[1] 张文华,洪灯,雷美康,等.超高效合相色谱法拆分和测定克伦特罗对映体[J].色谱,2021,39(12):1347-1354.
[2] 张文华,侯建波,荣杰峰,等.超高效合相色谱法对克伦特罗对映体的拆分及其在猪尿中的残留分析[J].分析测试学报,2021,40(12):1758-1764.
[3] 李周敏,王颖,冷寒雪,等.蛋白芯片法同时检测食品中克伦特罗与莱克多巴胺的残留量[J].分析测试学报,2019,38(8):913-919.
[4] 张鑫,刘文竹,康优,等.QuEChERS技术结合高效液相色谱-串联质谱法快速测定动物源性食品中克伦特罗的残留量[J].食品安全质量检测学报,2019,10(6):1555-1558.
[5] 郑海松,李云飞,杨小娇,等.出口肉及制品中盐酸克伦特罗的ELISA检测方法的建立[J].食品科技,2011,36(11):120-123.
[6] 冯晓阳,戴永康,张晟剑.胶体金层析免疫法对盐酸克伦特罗的检测试验[J].广东化工,2013,40(5):150-151.
[7]动物肌肉中盐酸克伦特罗的快速筛查胶体金免疫层析法:SB/T 10779-2012[S].2012.
[8] 廉双秋,崔大付,邓绍立.利用表面等离子体共振技术检测猪尿中盐酸克伦特罗[J].肉类研究,2014,28(11):42-48.
[9] 谢峰.盐酸克伦特罗检测方法的比较分析[J].当代畜牧,2018(9):25-26.
[10] 李莺,李婵君,王楠.气相色谱-质谱法测定猪肉中盐酸克伦特罗残留量[J].理化检验(化学分册),2014,50(9):1149-1152.
[11] 岳韩笑,雷雯,杜晓宁,等.同位素稀释-气相色谱-串联质谱法测定猪肉中残留的4种β-受体激动剂[J].质谱学报,2018,39(1):61-68.
[12] 张洋.LC-MS/MS法同时快速检测牛肉中12种β-受体激动剂的应用研究[J].食品安全导刊,2020(26):71-75.
[13]动物源性食品中β-受体激动剂残留检测方法 液相色谱-质谱/质谱法:GB/T 21313-2007[S].2007.
[14] 农业农村部1025号公告-18-2008,动物源性食品中β-受体激动剂残留检测 液相色谱-串联质谱法[S/OL].http://www.moa.gov.cn/nybgb/2008/dwuq/201806/t20180609_6151576.htm.
[15]动物源性食品中多种β-受体激动剂残留量的测定 液相色谱串联质谱法: GB/T 22286-2008[S].2008.

