质量守恒定律的七种应用
张海青

质量守恒定律是建构化学反应方程式的理论基础,也是初中化学学习的重点和难点。为了培养九年级学生灵活运用质量守恒定律解决问题的综合能力,笔者系统梳理了运用质量守恒定律解决问题的七种常见情况。
一、解释现象
用质量守恒定律解释化学反应中的一些现象是该定律最常见的使用情形。
例如:某学生利用碳酸钠和稀盐酸反应实验装置探究质量守恒定律,反应前天平平衡,反应后观察到天平不平衡,由此得出这个化学反应不遵守质量守恒定律。这个结论是否正确?为什么?
根据质量守恒定律,反应后的天平在理论上应该保持平衡。但具体到这个化学变化,因为反应中有二氧化碳气体生成,并逸散到空气中,所以导致天平失去平衡。基于此,在探究质量守恒定律的运用时,教师应引导学生明确:当化学反应中有气体参加或者生成时,反应必须在密闭容器中进行,否则天平无法保持平衡。
二、推断物质元素组成
根据质量守恒定律,从宏观上分析,组成物质的元素种类在化学反应前后是不变的,据此我们可以推断未知物质的元素组成。
例如:植物进行光合作用可简单表示为H2O+CO2=淀粉+O2,由此判断:淀粉中一定含有____ 元素,可能含有____ 元素。
此题主要考查物质在化学反应前后元素种类的变化情况。根据质量守恒定律可知,在化学变化中参加反应的各物质的元素种类是不变的。从上面的化学反应简式可知,两种反应物中共含有碳、氢、氧三种元素,且已确定的生成物中有氧气,由此可以推断生成物淀粉中一定含有碳元素、氢元素,可能含有氧元素。
三、推导物质化学式
化学式是描述物质组成的化学符号,我们可以根据质量守恒定律,推断未知物质的元素组成及化学式。
例如:生活中的自来水通常用氯气(Cl2)进行杀菌消毒处理,发生反应的化学方程式是Cl2+H2O=x+HClO。则x的化学式为( )。
A.H2 B.ClH C.HCl D.ClO2
根据质量守恒定律的微观意义,我们可以引导学生通过辨析得出“物质在化学反应前后,其原子的种类及个数都不变”的结论。在化学方程式Cl2+H2O=x+HClO中,反应物Cl2、H2O和生成物HClO中的各元素原子个数相等,由此可以推导出x的化学式为HCl。整个推导过程,可以培养学生的创新意识,使学生享受学习的成就感。
四、确定物质的质量
质量守恒定律是质量层面的守恒,而不是体积的守恒。我们引导学生根据质量守恒定律推导化学反应中未知物质的质量时,不能简单地进行数据上的加减,还应考虑反应物与生成物之间的质量关系。
例如:在化学反应A+2B=2C+D中,6gA和8gB恰好完全反应,生成9gD。若反应生成15gC,求参加反应的物质A的质量。
根据质量守恒定律可知,参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。由题中化学反应式A+2B=2C+D及物质A、B、D的质量,可以推算出物质C的质量为5g,从而得出A、B、C、D四种物质之间的质量比为6∶8∶5∶9。根据这个质量比及题目中“反应生成15gC”,可以计算出物质A的质量为18g。
五、推算化学计量数
化学计量数是化学反应式中物质前的系数,可以揭示化学反应中各反应物和生成物之间的关系,是化学方程式配平的基础。根据质量守恒定律可以确定化学反应中具体物质的化学计量数。
例如:在化学方程式aC2H6+bO2=mCO2+nH2O中,各化学计量数之间的关系正确的是( )。
A.2m=a B.3n=2a C.m=2a D.a=n+m
物质发生化学变化的过程中,分子的种类肯定要发生改变,但分子的个数则可能改变也可能不改变,而原子的种类及个数是肯定不变的,这从一定程度上决定了物质化学计量数之间的关系。依据化学方程式aC2H6+bO2=mCO2+nH2O中碳、氢、氧的原子个数不变,可以分别推导出三组等量关系:2a=m;6a=2n;2b=2m+n。从而确定此题选C。
六、判别化学反应类型
运用质量守恒定律,根据化学反应过程中各物质之间的质量关系,可以推断哪些物质是反应物、哪些物质是生成物,、哪些物质是催化剂,从而根据反应物与生成物种类的多少,确定化学反应的基本类型。
例如:把A、B、C、D四种纯净物放在一个密闭容器內,在一定条件下充分反应,测得反应前后各物质的质量如下表:
回答下列问题:
①反应后D的质量为____g;
②物质C可能是____;(填“反应物”“生成物”或“催化剂”)
③密闭容器中发生的基本化学反应类型是________ 。
这道题综合考查了学生对基本化学反应类型和实验数据的分析能力。根据“在化学反应中参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和”的规律,可以推算出反应后物质D的质量数为10.6。物质C在反应前质量不变,则可能是催化剂,也可能没参加该反应。同时,根据反应前后物质的增加(有生成物)与减少(有反应物转化)可以判定该反应为分解反应。
七、辨析微观反应示意图
教师可以根据质量守恒定律的微观粒子意义——化学反应前后原子的种类、个数、质量不变,引导学生科学辨析微观反应示意图。
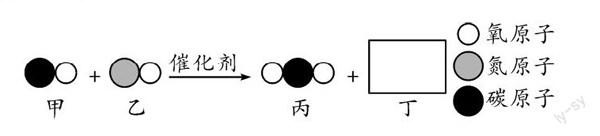
例如:汽车尾气催化转换器可减少有害气体的排放,其中某一反应过程的微观变化如下图所示。请回答下列问题:
①丙物质中碳、氧两种元素的质量比为____;化学反应前后种类没有发生改变的微粒是____;(填“分子”或“原子”)
②该反应涉及的四种物质中有____ 种是氧化物;
③已知丁是一种单质,则丁是____ (填化学式);
④该反应的化学方程式为________ 。
要解决这道题,就需要在微观示意图和答案之间建立一个桥梁——质量守恒定律。由题中三种粒子分别构成物质的情况,我们可以确定生成物丙、丁的化学式分别为CO2、N2,进而确定丙物质中碳、氧两种元素的质量比为3∶8。根据质量守恒定律的微观释义,我们知道化学反应的实质是“分子的破裂,原子的重新组合”,进而确定化学反应前后种类没有发生改变的微粒是原子。由质量守恒定律的定义可以确定该反应的化学方程式为2CO+2NO[催化剂]2CO2+N2。在该反应涉及的四种物质中,根据物质分类原则,可以确定其中有3种是氧化物。
责任编辑 刘佳

