基于RAF-MEK1/MEK2信号途径探讨脊蛇祛湿胶囊改善胶原诱导关节炎模型大鼠肠道炎症的作用机制
李湖帆 钟琴 马武开 黄颖 朱丹 张潇东 陈昌明


【摘 要】目的:探讨脊蛇祛湿胶囊通过RAF-MEK1/MEK2信号途径改善胶原诱导关节炎(CIA)模型大鼠肠道炎症的作用机制。方法:将70只SPF级Wistar雌性大鼠随机分为空白对照组、模型对照组、脊蛇祛湿胶囊低剂量组、脊蛇祛湿胶囊中剂量组、脊蛇祛湿胶囊高剂量组、益生菌组及甲氨蝶呤组,每组10只。喂养1周后,除空白对照组外,其余6组构建CIA模型,连续灌胃4周后处死大鼠,分离大鼠肠道组织,进行HE染色,并观察其病理,采用Western blot法检测各组大鼠肠道组织RAF、MEK1及MEK2蛋白的表达水平,RT-qPCR法检测大鼠肠道组织RAF、MEK1及MEK2 mRNA的表达水平。
结果:大肠病理及Western blot、RT-qPCR结果显示,与空白对照组比较,模型对照组肠道组织黏膜层及黏膜下层可见大量细胞增生,并可见黏膜隆起及充血、水肿。模型对照组RAF、MEK1、MEK2蛋白及基因在大肠组织中表达增加,当予以一定脊蛇祛湿胶囊干预后,大鼠肠道组织的病变情况明显改善,且大肠组织中RAF、MEK1、MEK2蛋白及基因表达降低。结论:脊蛇祛湿胶囊可能通过下调RAF-MEK1/MEK2信号途径改善CIA大鼠的肠道炎症。
【关键词】 类风湿关节炎;肠道炎症;脊蛇祛湿胶囊;MAPK信号通路;RAF-MEK1/MEK2信号;胶原诱导关节炎;大鼠
Study on the Mechanism of Jishe Qushi Jiaonang(脊蛇祛濕胶囊)in Improving Intestinal Inflammation in Collagen-induced Arthritis Model Rats Based on RAF-MEK1/MEK2 Signal Pathway
LI Hu-fan,ZHONG Qin,MA Wu-kai,HUANG Ying,ZHU Dan,ZHANG Xiao-dong,CHEN Chang-ming
【ABSTRACT】Objective:To explore the mechanism of Jishe Qushi Jiaonang(JQJ,脊蛇祛湿胶囊)in improving intestinal inflammation in collagen-induced arthritis(CIA)model rats through RAF-MEK1/MEK2 signaling pathway.Methods:Seventy female Wistar rats of SPF grade were randomly divided into a blank control group,a model control group,a low-dose JQJ group,a medium-dose JQJ group,a high-dose JQJ group,a probiotics group and a methotrexate group,with 10 rats in each group.After fed for one week,except for the blank control group,the other six groups was used to construct CIA models.The rats were killed after continuous gavage for
4 weeks.The intestinal tissues of the rats were separated,HE staining was made,and their pathology was observed.The expression levels of RAF,MEK1 and MEK2 proteins in the intestinal tissues of the rats in each group were detected by Western blot,and the expression levels of RAF,MEK1 and MEK2 mRNA in the intestinal tissues of the rats were detected by RT-qPCR.Results:The results of colorectal pathology,Western blot and RT-qPCR showed that compared with the blank control group,a large number of cell proliferation,mucosal swelling,congestion and edema could be seen in the intestinal mucosa and submucosa of the model control group.In the model control group,the expressions of RAF,MEK1,MEK2 proteins and genes increased in large intestine tissue.When given a certain JQJ,the pathological changes of rat intestinal tissue were significantly improved,and the expression of RAF,MEK1,MEK2 proteins and genes in large intestine tissue decreased.Conclusion:JQJ may improve intestinal inflammation in CIA rats by down regulating RAF-MEK1/MEK2 signal pathway.
【Keywords】 rheumatoid arthritis;intestinal inflammation;Jishe Qushi Jiaonang(脊蛇祛湿胶囊);MAPK signal path;RAF-MEK1/MEK2 signal;collagen-induced arthritis;rats
类风湿关节炎(rheumatoid arthritis,RA)是慢性损毁性关节炎为主要表现的自身免疫疾病,以关节晨僵、肿胀、疼痛及功能障碍等为主要表现。引起RA发病的机制有很多,其中肠道微生物失调在RA发生、发展中发挥重要作用[1]。肠道微生物失调能够改变机体肠道上皮黏膜细胞的通透性,激活免疫细胞产生各种炎性因子及抗体在关节处或各器官聚集,造成关节滑膜组织炎症及骨质破坏,促进RA发病[2]。研究表明,RA患者肠道菌群中异常增多的普雷沃氏菌能够通过介导辅助性T细胞17(Th17细胞)的炎症反应促进RA发病[3]。Th17细胞能够分泌重要的效应因子白细胞介素(IL)-17,IL-17A作为炎症抗原结合细胞上的IL-17受体引发丝裂原活化蛋白激酶(MAPK)信号途径介导炎症、感染等的发生和发展,在RA的发病机制中至关重要[4]。而脊蛇祛湿胶囊在前期研究中已被证实对RA具有良好疗效,能够减轻胶原诱导关节炎(CIA)模型大鼠足趾的肿胀,降低模型大鼠血清致炎因子IL-17、IL-1、肿瘤坏死因子-α等炎症因子的分泌。同时脊蛇祛湿胶囊能降低核转录因子-κB(NF-κB)信号通路中的NF-κB/P65、NF-κB/P50蛋白在CIA模型大鼠血清中的表達,从而减轻关节炎症;另外,脊蛇祛湿胶囊还能通过下调CIA大鼠细胞因子
IL-17、IL-23的表达,抑制IL-17/IL-23炎症轴活性,达到减少RA滑膜炎症反应的目的[5]。但暂无脊蛇祛湿胶囊对大鼠肠道炎症及MAPK相应炎症信号通路的相关性研究,肠道微生物导致的肠道炎症早已被证明与RA密切相关。故本研究通过探讨脊蛇祛湿胶囊对大鼠肠道MAPK信号通路中RAF、MEK1及MEK2蛋白表达的调控作用,从肠-关节轴出发为RA治疗提供新的理论依据。
1 实验材料
1.1 实验动物 SPF级6~8周龄雌性Wistar大鼠70只,体质量150~180 g,购自长沙市天勤生物技术有限公司,实验动物生产许可证号SCXK(湘)2019-0013,大鼠饲养于贵州中医药大学甲秀校区实验动物中心。在室温(25 ℃)环境下,相对湿度(50±5)%,饲养间通风干燥,并保持安静,以12 h的昼夜循环,适应性喂养1周后用于实验。本研究通过贵州中医药大学伦理审批委员会审批,批准号ky2020035。
1.2 主要药物与试剂 脊蛇祛湿胶囊(药物组成:金毛狗脊15 g、乌梢蛇10 g、千年健15 g、黑骨藤10 g、小花青风藤15 g、姜黄20 g、白芍15 g、
三七3 g、甘草3 g。院内制剂,每粒0.45 g,贵州中医药大学第二附属医院药剂科,黔药制字Z20160028,批号170701);甲氨蝶呤片(通化茂祥制药有限公司,批号070405B);益生菌(双歧杆菌四联活菌片,内蒙古双奇药业股份有限公司,批号61001095);牛Ⅱ型胶原冻干粉(Chondrex,批号200078);弗氏完全佐剂(Sigma,批号SLCD4457);苏木素(Sigma,批号H9627);伊红Y(国药集团,批号71014544);小鼠单抗β-actin(武汉博士德生物工程有限公司,批号BM0627);HRP标记羊抗小鼠二抗(武汉博士德生物工程有限公司,批号BA1051);PMSF(阿拉丁,批号P105539);兔单抗RAF(Abcam,批号ab181115);兔多抗MEK1(affinity,
批号AF6383);兔多抗MEK2(Affinity,批号AF6282);HiScript?Ⅱ Q RT SuperMix for qPCR(+gDNA wiper)(VAZYME,批号R233-01);dNTP(TIANGEN,批号CD117)。
1.3 主要仪器 病理切片机(德国轮转式切片机,Leica RM 2016);显微镜(奥林巴斯型生物显微镜,BX53);电泳仪电源(北京六一仪器厂,DYY-7C);垂直电泳槽(北京六一仪器厂,DYCZ-24DN);离心机(湖南湘仪实验室仪器开发有限公司,HI650);紫外分析仪(北京君意东方电泳设备有限公司,JY02S);ChemiDoc Touch Imaging System(美国Bio Rad公司);TransBlot Turb System(美国Bio Rad 公司);荧光定量PCR仪(Applied Biosystems)。
2 方 法
2.1 分组、动物模型制备与样品采集 将70只雌性Wistar大鼠随机分为空白对照组、模型对照组、脊蛇祛湿胶囊低剂量组、脊蛇祛湿胶囊中剂量组、脊蛇祛湿胶囊高剂量组、益生菌组及甲氨蝶呤组,每组10只。本研究中实验大鼠的给药剂量均按照生药量进行换算[6]。除空白对照组外,其余各组大鼠经右后足跖皮内及尾根部注射CIA模型乳剂,每只0.1 mL,建立CIA大鼠模型。空白对照组大鼠于右后足跖皮内皮下及尾根部注射等量的生理盐水。5 d后进行加强免疫,除空白对照组外,各组大鼠尾根部及右后足垫部消毒后,注射CIA模型乳剂每只0.2 mL致炎。造模第2天,除空白对照组外,其余大鼠可见关节轻度肿胀,加强免疫后可见大鼠关节重度肿胀,活动受限,食欲减退,符合CIA大鼠模型[7]。造模第7天开始给药干预,脊蛇祛湿胶囊低剂量组给予脊蛇祛湿胶囊
0.225 g·kg-1·d-1灌胃,脊蛇祛湿胶囊中剂量组给予脊蛇祛湿胶囊0.45 g·kg-1·d-1灌胃,脊蛇祛湿胶囊高剂量组给予脊蛇祛湿胶囊1.35 g·kg-1·d-1灌胃,益生菌组给予益生菌0.35 g·kg-1·d-1灌胃,甲氨蝶呤组给予甲氨蝶呤1 mg·kg-1,每周1次灌胃,空白对照组和模型对照组给予等量生理盐水灌胃,连续28 d。28 d后,处死大鼠,分离肠道组织用于观察组织病理、Western blot及qRT-PCR实验。
2.2 对大鼠肠道组织进行HE染色 取适量肠道组织,使用梯度酒精对组织进行脱水处理,使石蜡能顺利地渗入组织,再进行浸蜡,包埋,将包埋好的蜡块使用徕卡病理切片机进行切片,切片在烤箱烤3 h,将石蜡切片依次放入各种溶剂中进行脱蜡,蒸馏水再浸洗5 min。再将切片放入苏木素染液中染色5 min,自来水洗浸洗返蓝,返蓝切片放入1%水溶性伊红染液染色5 min,自来水中浸洗,将切片风干后中性树胶封片,显微镜下观察大鼠肠道组织病变情况。
2.3 Western blot法检测RAF、MEK1及MEK2蛋
白的表达 取各组适量的大鼠肠道组织提取总蛋白,分离蛋白上清,以BSA为标准绘制标准曲线,计算出待测样品的蛋白浓度,与蛋白上样缓冲液放入沸水中水浴进行蛋白变性;随后进行SDS-PAGE电泳,电泳完毕后进行转膜,用TBST清洗1次后,用10%脱脂奶粉室温封闭PVDF膜2 h,一抗4 ℃孵育过夜,用TBST洗膜3次,每次5 min,二抗常温下孵育1 h,用TBST洗膜3次,每次5 min;将PVDF膜用滤纸轻轻沾干后,加入显影液,反应2 min后放入ChemiDoc Touch Imaging System进行曝光,检测待测目的条带并分析条带灰度值。
2.4 RT-qPCR法检测RAF、MEK1及MEK2 mRNA
的表达 在冰冻肠道组织中加入Trizol试剂,用匀浆器研磨移至无RNase的1.5 mL EP管中,裂解后加入氯仿于EP管中,混匀数次,室温放置再离心8 min,可见RNA主要分布在水相中,再转移上层水相于另一新的1.5 mL EP管中,加入异丙醇后静置10 min,弃去上清,加入无RNase的75%乙醇1 mL,混匀后离心机以12000 r·min-1离心
5 min,离心半径8.5 cm,计算RNA的纯度和浓度,根据OD260/OD280比值,估测RNA质量,根据吸光光度值按下列公式计算样品RNA的浓度:总RNA浓度(μg·μL-1)= OD260×40×10-3。将提取的RNA逆转录成cDNA,稀释10倍作为模板上机检测,目的基因相对定量通过内参基因CT值与待检基因CT值经2-△△Ct计算,得出样本间表达量差异倍数关系。目的基因RAF、MEK1、MEK2及内参基因β-actin引物序列见表1。
2.5 统计学方法 采用SPSS 26.0软件进行统计分析。计量资料符合正态分布以表示,采用方差分析及t检验,不符合正態分布采用非参数检验。以P < 0.05为差异有统计学意义。
3 结 果
3.1 各组大鼠行为学表现 与空白对照组比较,模型对照组早期致炎部位的炎症反应多出现对侧和前足肿胀,呈进行性加重,行动不便,耳和尾部出现关节炎小结,以及质量下降等特征,大鼠主要表现为体质量减轻,精神萎靡,摄食及其他活动减少,带有病态,伴轻微脱毛等关节症状,一般自后足首发,逐渐蔓延至前足,症状呈进行性加重。经喂养干扰药物后,脊蛇祛湿胶囊高剂量组及甲氨蝶呤组较模型对照组明显好转,与空白对照组行为学表现基本一致。脊蛇祛湿胶囊中、低剂量组及益生菌组与模型对照组比较,行为学表现稍减轻。
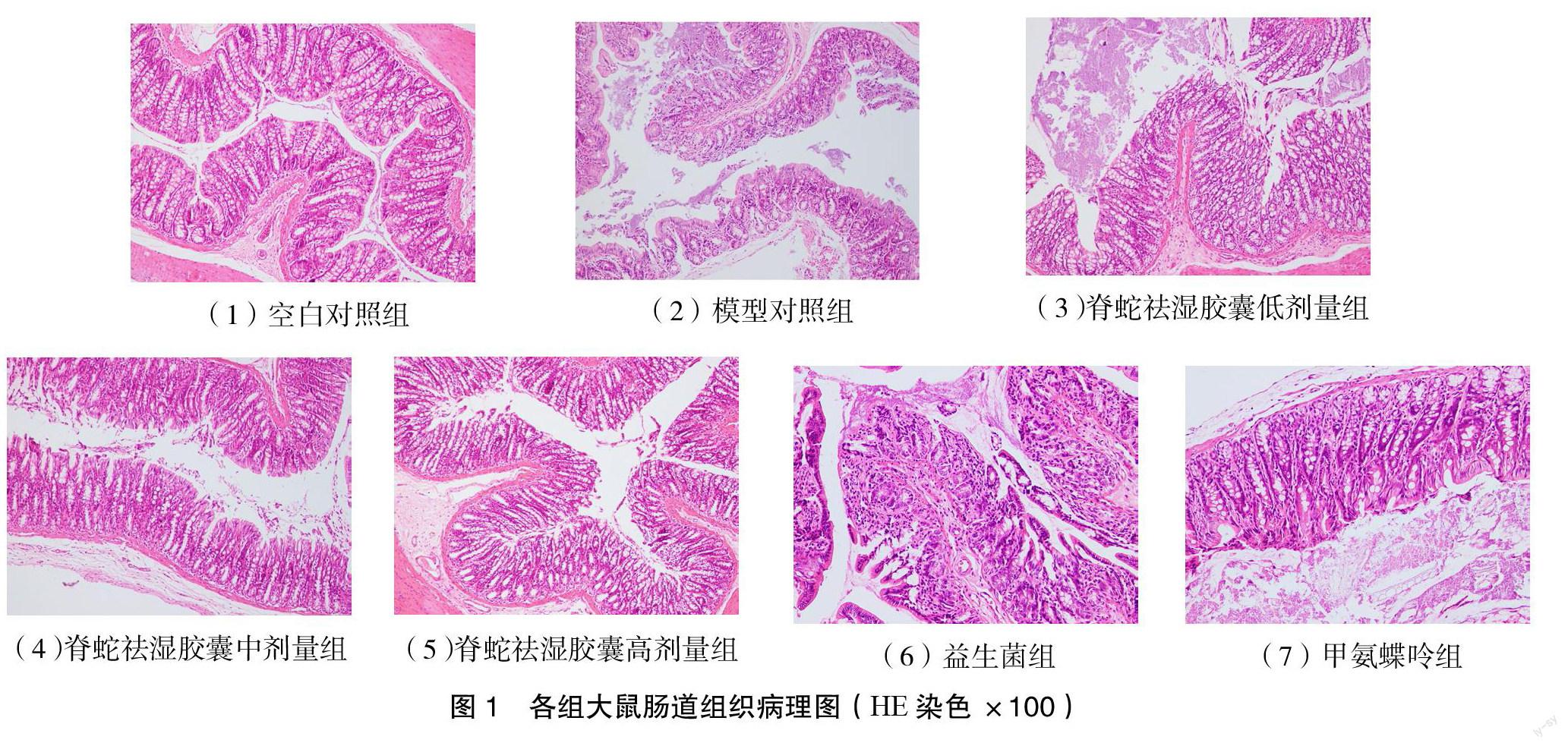
3.2 脊蛇祛湿胶囊对CIA大鼠肠道组织病理学的影响 空白对照组肠道组织黏膜层及黏膜下层无充血、水肿及炎性细胞浸润,黏膜层及黏膜下层细胞排列整齐。模型对照组肠道组织黏膜层及黏膜下层可见大量细胞增生,大量炎性细胞成弥漫性浸润,并可见黏膜隆起及充血、水肿。脊蛇祛湿胶囊低剂量组肠道黏膜层及黏膜下层可见中等量炎性细胞浸润,肠道组织增生、水肿,肠道黏膜层及黏膜下层细胞排列紊乱,与模型对照组比较无明显改善。脊蛇祛湿胶囊中、高剂量组和甲氨蝶呤组可见少量新生血管形成,炎性细胞浸润少,与模型对照组比较,炎性浸润、增生、血管新生组织有明显改善,脊蛇祛湿胶囊高剂量组和甲氨蝶呤组作用效果相当。见图1。
3.3 脊蛇祛湿胶囊对CIA大鼠肠道组织RAF、MEK1及MEK2蛋白表达的影响 与空白对照组比较,模型对照组大鼠肠道中RAF、MEK1及MEK2蛋白的表达水平明显升高(P < 0.05);与模型对照组比较,各给药组大鼠肠道中RAF、MEK1及MEK2蛋白的表达水平明显降低(P < 0.05)。
见图2、表2。
3.4 脊蛇祛湿胶囊对CIA大鼠肠道组织RAF、MEK1及MEK2 mRNA表达的影响 与空白对照组比较,模型对照组RAF、MEK1及MEK2 mRNA蛋白表达显著升高(P < 0.05)。与模型对照组比较,各给药组RAF、MEK1及MEK2 mRNA蛋白表达显著降低(P < 0.05)。见表3。
4 讨 论
中医学认为,RA为痰浊、瘀血、水湿等邪侵袭肢体经络引起气血运行不畅,经络痹阻所致。而脊蛇祛湿胶囊的主要作用为祛瘀消痰、通痹止痛。贵州中医药大学第二附属医院风湿科长期治疗RA的临床经验及前期研究成果发现,脊蛇祛湿胶囊能缓解RA患者关节肿痛,调节骨代谢,降低甲氨蝶呤等免疫抑制剂类药物的不良反应[8]。
大量研究认为,肠道在许多炎症性疾病中扮演着重要的角色,肠漏、肠道微生态失调和肠道炎症不仅与小肠结肠炎、克罗恩病等消化系统疾病有关,而且也与自身免疫性疾病密切相关,如RA、系统性红斑狼疮及多发性硬皮病等[9-10]。肠道微生物与宿主的发育、生长及物质代谢密切相关,且对机体的免疫应答起重要的调节作用,若肠道菌群发生紊乱,则易产生肠道炎症,使肠道天然屏障作用逐渐减弱,机体的抵抗力降低,无法发挥正常的抗菌能力,机体免疫系统减弱,即可增加患病风
险[11]。目前,肠-关节轴成为许多自身免疫性疾病研究的重点,研究表明,肠道微生物失调可导致肠道炎症而使RA患者的病情加重[12]。此外,研究人员通过干预肠道Wnt/β-catenin通路能够改变CIA大鼠的肠道炎症情况及RA的严重程度,提示CIA模型与肠道炎症密切相关[13]。约75%早期未经治疗的RA患者中有普氏菌,普氏菌会排挤对抗炎症的微生物群,或自身促进炎症。随着普氏菌的相对丰度及数量增加,会在肠道黏膜介导Th17细胞发生肠道炎症[14]。Th17细胞通过分泌IL-17促进自身免疫疾病的发展,IL-17结合其在肠道上皮细胞、巨噬细胞的受体引发MAPK信号通路影响着RA的病情[15]。
MAPK信號通路主要是通过氧化及激活转录因子,控制炎性因子表达参与整个RA炎症的过
程[16]。RAF、MEK1及MEK2是MAPK信号通路中的重要一员,也是RAS-RAF-MEK-ERK通路中重要的信号分子,活化的RAS通过与RAF的结构域结合从而使RAF激活,活化后的RAF能够进一步与下游的MEK蛋白结合进而使MEK激活,激活后的MEK再进一步激活下游的唯一底物ERK,最后活化的ERK进入细胞核,继而引起一系列生理、生化反应。在细胞增殖、细胞凋亡、细胞分化、肿瘤发生等方面发挥着重要作用[17]。在RA的发生、发展中,由于RAF、MEK1等基因的突变,导致该通路持续活化。其中,MEK蛋白与肠道炎症密切相关,当MEK信号通路被抑制,损伤的肠黏膜可被修复,肠道炎症减轻[18]。另外,通过抑制RAF蛋白的表达,可使肠道中的巨噬细胞和中性粒细胞浸润减少,抑制肠上皮细胞坏死和防止肠屏障功能丧失,也可使肠道炎症缓解[19]。
本研究发现,与空白对照组比较,模型对照组RAF、MEK1、MEK2蛋白及RAF、MEK1、MEK2 mRNA在大肠组织中表达增加。当予一定脊蛇祛湿胶囊干预后,大肠组织中RAF、MEK1、MEK2蛋白及RAF、MEK1、MEK2 mRNA表达降低,证明脊蛇祛湿胶囊可通过抑制RAF、MEK1、MEK2蛋白的表达减轻肠道炎症。另外,1.35 g·kg-1剂量的脊蛇祛湿胶囊与甲氨蝶呤抑制RAF、MEK1、MEK2蛋白的表达量相当,剂量太小则抑制效果不明显,从治疗RA及药物不良反应的角度,对于长期服用脊蛇祛湿胶囊治疗的RA患者来说,能够降低一定的不良反应。同时病理切片显示,予以脊蛇祛湿胶囊后肠道黏膜层及黏膜下层的充血、水肿及炎症细胞浸润明显减轻,大鼠的行为学表现如足肿胀、精神等得到明显改善。RA作为一种慢性疾病,服用药物种类多,时间长,容易导致胃肠道疾病产生肠道炎症,同时肠道菌群失调也可产生肠道炎症,故RA患者需长期服用护胃药。而实验结果显示,脊蛇祛湿胶囊作为中药可改善肠道炎症,提示脊蛇祛湿胶囊可缓解传统抗风湿药对RA患者造成的肠胃损伤。结合Western blot、RT-qPCR实验结果及病理切片、大鼠行为学表现,证实脊蛇祛湿胶囊可通过抑制RAF、MEK1、MEK2蛋白的表达改善肠道炎症从而治疗RA。
综上所述,通过制备CIA模型,发现脊蛇祛湿胶囊能改善大鼠的行为学表现,抑制机体肠道炎症反应,下调RAF-MEK1/MEK2信号表达,发挥治疗RA的作用。本研究可为脊蛇祛湿胶囊治疗RA提供一定的理论依据,同时通过研究
RAF-MEK1/MEK2蛋白在肠道的表达来探索更多的中药用于治疗RA。
参考文献
[1] SHI W,YE H,DENG Y,et al.Yaobitong capsules reshape and rebalance the gut microbiota and metabolites of arthritic rats:An integrated study of microbiome and fecal metabolomics analysis[J].J Chromatogr B Analyt Technol Biomed Life Sci,2022,4(1):123096.
[2] PENG J,LU X,XIE K,et al.Dynamic alterations in the gut microbiota of collagen-induced arthritis rats following the prolonged administration of total glucosides of paeony[J].Front Cell Infect Microbiol,2019,12(9):204-220.
[3] ABDULLA OA,NEAMAH W,SULTAN M,et al.The ability of ahr ligands to attenuate delayed type hypersensitivity reaction is associated with alterations in the gut microbiota[J].Front Immunol,2021,29(12):1-16.
[4] SAMARPITA S,RASOOL M.Cyanidin attenuates IL-17A
cytokine signaling mediated monocyte migration and differentiation into mature osteoclasts in rheumatoid arthritis[J].Cytokine,2021,31(142):155502.
[5] 蔡鑫,唐芳,马武开,等.苗药金乌健骨方治疗类风湿关节炎的研究进展[J].中国老年学杂志,2021,41(9):2001-2004.
[6] 苏云龙,王雪梅.胶原诱导性类风湿关节炎大鼠模型制备及早期表现评价[J].内蒙古医科大学学报,2020,42(1):53-55.
[7] 俞云,于辉,冯旌,等.基于NF-κB/NLRP3信号轴探讨大血藤对CIA大鼠的治疗作用及机制[J].南京中医药大学学报,2021,37(3):396-399.
[8] 田镭,钟琴,马武开,等.脊蛇祛湿胶囊联合小剂量甲氨蝶呤治疗类风湿关节炎42例临床观察[J].风湿病与关节炎,2019,8(8):14-17,35.
[9] AARTS J,BOLEIJ A,PIETERS BCH,et al.Flood con-trol:how milk-derived extracellular vesicles can help to improve the intestinal barrier function and break the gut-joint axis in rheumatoid arthritis[J].Front Immunol,2021,28(12):1-12.
[10] 楊婷婷,高明利.肠道菌群与系统性红斑狼疮相关性的研究进展[J].风湿病与关节炎,2021,10(8):76-80.
[11] CHAMI B,MARTIN NJJ,DENNIS JM,et al.Myeloperoxidase in the inflamed colon:a novel target for treating inflammatory bowel disease[J].Arch Biochem Biophys,2018,13(1):61-71.
[12] ASOUDEH F,DJAFARIAN K,AKHALGHI M,et al.The effect of probiotic cheese consumption on inflammatory and anti-inflammatory markers,disease severity,and symptoms in patients with rheumatoid arthritis:study protocol for a randomized,double-blind,placebo-controlled trial[J].Trials,2022,23(1):180-189.
[13] TAN W,QIU Y,CHEN N,et al.The intervention of intestinal Wnt/β-catenin pathway alters inflammation and disease severity of CIA[J].Immunol Res,2021,69(4):323-333.
[14] LARSEN JM.The immune response to Prevotella bacteria in chronic inflammatory disease[J].Immunology,2017,151(4):363-374.
[15] LIN W,WANG N,ZHOU K,et al.RKIP mediates autoimmune inflammation by positively regulating IL-17R signaling[J].EMBO Rep,2018,19(6):1-16.
[16] BEHL T,UPADHYAY T,SINGH S,et al.Polyphenols targeting MAPK mediated oxidative stress and inflammation in rheumatoid arthritis[J].Molecules,2021,26(21):6570-6594.
[17] WU Q,YUAN X,LI B,et al.Salvianolic acid alleviated blood-brain barrier permeability in spontaneously hypertensive rats byinhibiting apoptosis in pericytes via P53 and the Ras/Raf/MEK/ERK pathway[J].Drug Des Devel Ther,2020,16(14):1523-1534.
[18] LIAO PL,HUANG SH,HUNG CH,et al.Efficacy of azatyrosine-phenylbutyric hydroxamides,a histone deacetylase inhibitor,on chemotherapy-induced gastrointestinal mucositis[J].Mol Sci,2019,20(2):249-264.
[19] ZHANG C,LUO Y,HE Q,et al.A pan-RAF inhibitor LY3009120 inhibits necroptosis by preventing phosphorylation of RIPK1 and alleviates dextran sulfate sodium-induced colitis[J].Clin Sci(Lond),2019,1133(8):919-932.
收稿日期:2022-03-12;修回日期:2022-04-25

