电针干预对帕金森病模型小鼠黑质中酪氨酸羟化酶及氧化应激因子表达的影响
赵颖倩,亢恺雯,刘奇,马雪,李杰,鲁刚,王强,3,4
[1.陕西中医药大学针灸推拿学院,咸阳 712046;2.陕西中医药大学第二临床医学院,咸阳 712046;3.陕西省针药结合重点实验室,咸阳 712046;4.咸阳市神经生物学(针灸)重点实验室,咸阳 712046]
帕金森病(Parkinson’s disease, PD)是发病率仅次于阿尔茨海默病的神经系统退行性疾病[1]。PD多好发于中老年人,临床常根据患者运动体征的改变如静止性震颤、运动迟缓、肌肉僵硬和体态不稳来诊断及针对治疗。其主要病理学特点为中脑黑质致密部多巴胺能神经元选择性变性及缺失,残存神经元中出现以α-突触核蛋白为主要成分的路易小体[2],导致纹状体多巴胺耗竭,丘脑功能增强以及皮质运动区的兴奋性传入减少,从而使患者出现运动功能障碍。PD的发病与遗传、环境、免疫、氧化应激等多种因素综合作用有关,氧化应激在其中起着至关重要的作用[3],但其具体的发病机制尚未明确[4]。PD在世界范围内影响着近500万人的身体健康,预计2040年全球PD患者人数将增加4倍[5]。因此,寻找PD相关致病因素,为治疗及预防提供新的策略和靶点已经迫在眉睫。1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine, MPTP)小鼠模型是目前应用最广泛的 PD模型,研究已证实MPTP小鼠模型在症状及病理学方面均符合临床PD的特征,是一种较理想的PD模型[6]。
本实验拟通过MPTP皮下缓释构建小鼠PD模型,观察早期电针干预对PD模型小鼠运动障碍改善、小鼠脑黑质组织中酪氨酸羟化酶(tyrosine hydroxylase,TH)、氧化应激因子超氧化物歧化酶(superoxide dismutase, SOD)-2和谷胱甘肽过氧化物酶(glutathione peroxidase, Gpx-1)蛋白表达的影响,证明“嗅三针”可以通过抑制 PD小鼠的氧化应激反应,达到改善PD模型小鼠运动功能障碍的目的。
1 材料与方法
1.1 实验动物与方法
选取40只10周龄清洁级雄性昆明小鼠作为研究对象,体质量(18±5)g,实验使用许可证号为SYXK(陕)2018-001。根据随机数字表法随机分为空白组、PD组、针刺组和左旋多巴组,每组10只。动物由西安交通大学实验动物中心提供,生产许可证号为SCXK(陕)2020-001。环境温度为 20~24 ℃,湿度为40%~70%,12 h明暗交替,适应性喂养1周。对动物的处理遵循《关于善待实验动物的指导意见》[7]。
1.2 主要试剂与仪器
山羊抗鼠SOD2抗体(ab118340,英国Abcam);山羊抗小鼠Gpx-1抗体(PAB7049, Abnova);山羊抗小鼠TH抗体(ab75875, Abcam);山羊抗兔IgG H&L(HRP)抗体(ab3816,英国 Abcam);抗生物素蛋白生物素化辣根过氧化物酶复合物(ZY131095,泽叶生物);小鼠 TH免疫组化试剂盒(ab137869,英国 Abcam);Braford蛋白浓度测定盒(批号 V900144, biosharp);SDS-PAGE凝胶制备盒(批号V900483, biosharp);左旋多巴(72816,美国SIGMA);MPTP(M0896,美国Sigma)。高速冷冻离心机(美国贝克曼);组织切片机(德国莱卡);SDZ-Ⅱ型电针仪(苏州医疗用品厂有限公司);酶标仪(美国 Bio-Rad);Image Pro Plus 6.0图像分析系统(美国Media Cybernetics);蛋白电泳转膜系统(美国Bio-Rad)。
1.3 模型制备
PD模型[8]采用清洁级成年昆明小鼠,吸入式麻醉机麻醉小鼠(异氟醚溶液诱导浓度4%,维持浓度1.5%),手术过程中持续麻醉。小鼠后背部皮下0.5 cm左右做横切口,钝性分离皮肤与肌肉,手术植入注满 MPTP溶液的胶囊渗透压泵,向泵内注射 200 μL的 MPTP溶液,MPTP含量为0.5 mg,缓释速度7 μL/d,总时长4周;空白组小鼠予以同样处理,泵内注射200 μL生理盐水溶液[9]。小鼠出现震颤、立毛、倦怠及运动测试障碍证明造模成功[10]。
1.4 干预方法
1.4.1 空白组
仅同步抓取,无其他干预。
1.4.2 PD组
仅植入注满MPTP胶囊渗透压泵,之后不进行任何干预。
1.4.3 针刺组
于造模2周后开始采用针刺干预。参照《实验针灸学》[11]进行穴位定位,取神庭和双侧天枢、上巨虚穴。神庭位于前正中线,额顶骨缝交界线前方;上巨虚穴位于小鼠胫骨外侧,偏下方6 mm,直刺3~4 mm;天枢穴位于小鼠前正中线旁开5 mm,耻骨联合以上20 mm,直刺2~3 mm。正极接天枢穴,负极分别接神庭穴10 min,上巨虚穴10 min,刺激参数为疏密波,频率为2~15 Hz,强度为 1 mA,以小鼠肢体轻微震颤为度。每日干预20 min,1个疗程为5 d,后休息2 d,共治疗6个疗程。
1.4.4 左旋多巴组
应用西药左旋多巴,以每日3 mg/kg的剂量,对PD模型小鼠于造模2周后进行灌胃。每日1次,治疗5 d为1个疗程,休息2 d,共治疗6个疗程。
1.5 指标检测
1.5.1 行为学检测
电针干预6个疗程结束后第1天进行行为学检测,包括步长实验和游泳实验。步长实验具体为,设置泡沫板通道,在通道的底部固定等尺寸的胶水白纸,在实验前对全部的小鼠进行适当的训练,确定出步长,将小鼠后趾使用墨汁染黑后等待其穿过通道,最后测算同侧脚印间距的平均值[12]。游泳实验具体为,小鼠禁食 12 h后称重,在小鼠尾部悬吊约为其体质量10%的保险丝,后将小鼠放入水箱,自投入水内开始,用秒表计算鼻孔下沉水面所需时间,水温27 ℃左右,测定其游泳时间。行为学测试结束后进行心脏灌注取材[13]。
1.5.2 免疫组化法检测黑质区TH表达
用4%的水合氯醛溶液(每10 g体质量注射0.1 mL)腹腔注射麻醉,麻醉小鼠后,用生理盐水和 4%多聚甲醛溶液经左心室快速灌注固定脑组织,根据小鼠脑立体定位图谱,切除前囟后,于 3~4 mm的冠状切面,采用脑模具截取黑质部分。制作切片后BSA封闭,一抗孵育 4 ℃过夜后 PBS冲洗,滴加二抗孵育,PBS冲洗后DAB溶液显色并观察。200倍视野下,每张切片选取3~4个视野,Image Pro-Plus分析并计算TH阳性细胞数,阳性细胞为细胞浆染成棕褐色。
1.5.3 Western blot法检测黑质区 TH、SOD-2和Gpx-1蛋白表达
小鼠脑黑质组织中加入 RIPA裂解液进行冰上研磨、裂解、离心(15 min)后,然后用考马斯蓝法测定蛋白浓度,继而进行SDS-PAGE电泳,转膜后用5%脱脂奶粉封闭液孵育1 h。于4 ℃冰箱分别置于TH、SOD-2、Gpx-1和GAPDH(均为1:5 000)一抗中孵育过夜、洗膜后,使用相应二抗(1:2 000)避光室温孵育1 h后洗膜后,发光显影。结果用Bandscan5.0软件进行扫描,分析TH、SOD-2、Gpx-1及内参GAPDH的灰度值。
1.6 统计学方法
所以数据采用 SPSS22.0统计学软件进行统计分析。符合正态分布的计量资料用均数±标准差表示,组间比较采用单因素方差分析,两两比较采用Bonferroni检验。以P<0.05表示差异具有统计学意义。
2 结果
2.1 4组造模后行为学测试结果比较
与空白组比较,PD组小鼠步长距离减少,游泳时间缩短,差异有统计学意义(P<0.05)。与PD组比较,针刺组小鼠的步长距离显著加长,游泳时间有显著延长,差异有统计学意义(P<0.05)。与PD组比较,左旋多巴组小鼠的步长和游泳时间也有显著提高,差异有统计学意义(P<0.05)。详见表1。
表1 4组造模后行为学测试结果比较 (±s)

表1 4组造模后行为学测试结果比较 (±s)
注:与空白组比较1)P<0.05;与PD组比较2)P<0.05
组别 n 步长距离(cm) 游泳时间(min)空白组 10 8.89±1.12 4.85±0.99 PD组 10 4.23±1.381) 1.81±1.081)针刺组 10 6.51±1.012) 3.14±1.212)左旋多巴组 10 7.32±1.222) 3.26±1.512)
2.2 4组小鼠中脑黑质中SOD-2、Gpx-1表达比较
与空白组比较,PD组小鼠黑质中SOD-2和Gpx-1的蛋白表达量显著降低,差异有统计学意义(P<0.05)。与PD组比较,针刺组黑质中SOD-2和Gpx-1表达显著升高,差异有统计学意义(P<0.05)。与PD组比较,左旋多巴组的SOD-2和Gpx-1表达也显著提高,差异有统计学意义(P<0.05)。详见图1、图2。
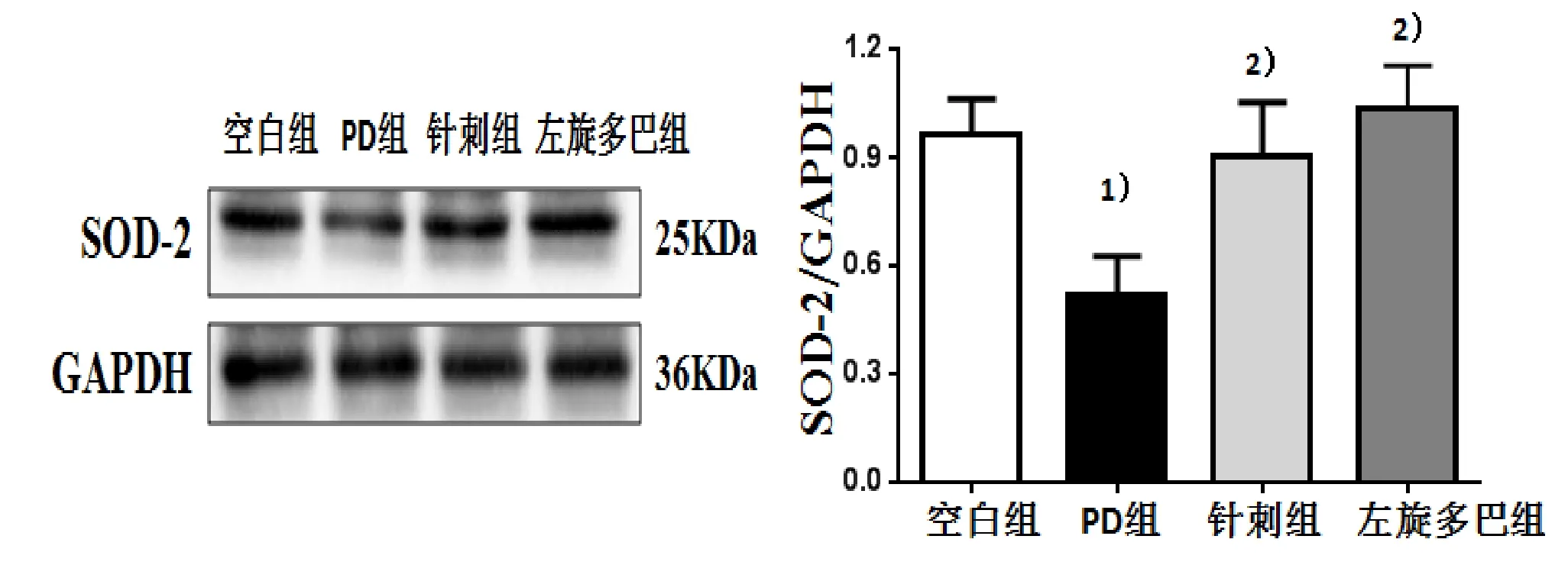
图1 4组小鼠黑质SOD-2蛋白的表达及条带图

图2 4组小鼠黑质Gpx-1蛋白的表达及条带图
2.3 4组小鼠中脑黑质中TH表达比较
与空白组比较,PD组小鼠黑质中TH蛋白表达显著降低,差异有统计学意义(P<0.05);与 PD组比较,针刺组黑质中 TH表达升高,差异有统计学意义(P<0.05)。与PD组比较,左旋多巴组TH表达无显著性变化(P>0.05),详见图3、图4。

图3 4组小鼠黑质中TH蛋白免疫组化结果(×200倍)
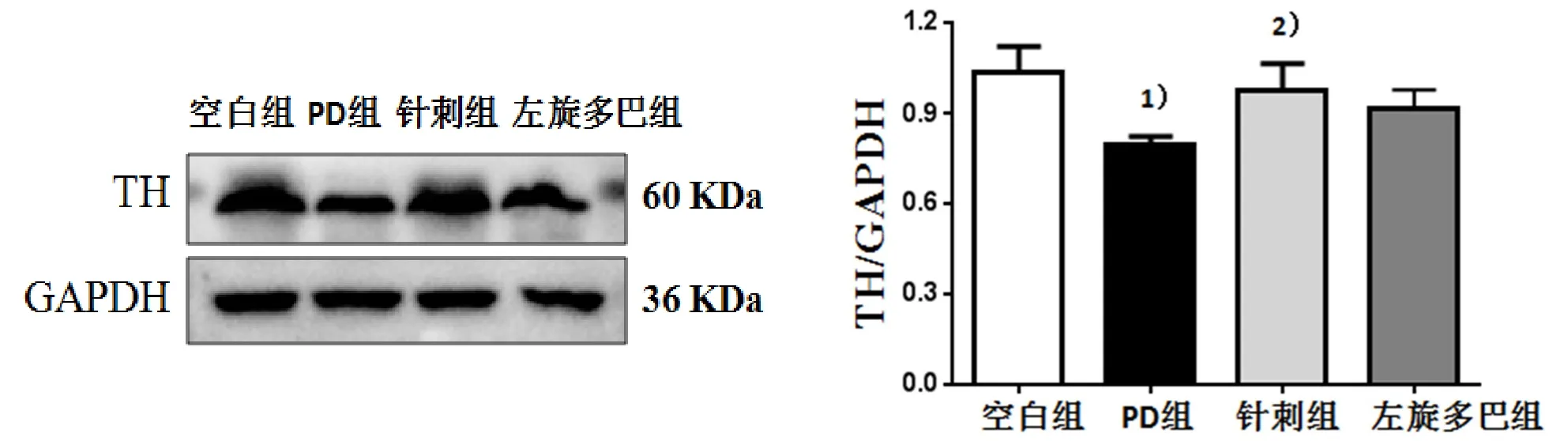
图4 4组小鼠黑质中TH蛋白表达及条带图
3 讨论
随着我国进入人口老龄化阶段,老年病之一的帕金森病(PD)患者人群数量逐渐庞大,目前临床主要采用多巴胺类药物进行治疗,但长期使用所致的副作用使患者备受困扰,所以探求发病原因以及寻找新的治疗方式逐渐成为重要的研究方向。PD的主要病理改变为多巴胺(dopamine, DA)能神经元变性、丢失及路易小体(lewy body, LB)的形成,氧化应激、线粒体功能障碍、炎症及机体免疫反应参与其中。钙超载、多巴胺代谢失衡、谷胱甘肽等还原剂水平降低等诸多因素均会导致体内的氧化与抗氧化系统失衡[14]。氧化反应过程中线粒体中的超氧化物歧化酶(SOD)和谷胱甘肽(glutathione, rglutamyl cysteingl glycine, GSH)可催化活性氧生成二价氧和水,避免细胞损伤[15]。在许多PD病例中,氧化应激被认为是导致细胞功能障碍和死亡的潜在机制[16]。PD患者尸检结果表明,其黑质内8-羟基鸟苷、蛋白质羰基等氧化标志物显著高于其他脑区,表明黑质细胞遭受氧化应激损伤[17]。在帕金森病中,线粒体功能障碍可能提高发病率,黑质 DA神经元更容易发生氧化应激反应,继而导致线粒体 DNA突变几率增高,最终会形成不断的恶性循环,导致帕金森病病情加重[18]。本次实验的结果表明,针刺组与PD组相比,针刺组黑质中SOD-2和Gpx-1表达升高,针刺组小鼠的抗氧化能力显著升高,这为其治疗帕金森病提供理论依据。
氧化应激也促进致病蛋白质的聚集,干扰细胞自噬,导致年龄和疾病相关蛋白酶体功能障碍[19]。在线粒体基因组突变、氧化应激,毒素刺激等因素下,线粒体产生功能失调,这是PD发病关键环节。经典PD模型制备,正是抑制了线粒体复合体Ⅰ功能导致神经元损伤[20]。线粒体复合体Ⅰ被抑制后,不仅影响ATP生成,也导致活性氧(reactive oxygenspecies, ROS)生成增加,损伤mtRNA, ATP合成不足也会导致门冬氨酸及谷氨酸等兴奋性递质增加,对神经元产生毒性[21]。Aβ寡聚体也可干扰线粒体与内质网的钙离子交换,抑制受损线粒体自噬[22-23]。随着机体的衰老,氧化应激及细胞凋亡增加,产生大量ROS,线粒体DNA损伤加剧,因此年龄是影响PD发病最大风险因素[24]。
黑质中的酪氨酸羟化酶(TH)表达近年来被认为与PD发病具有相关性,有报道针灸疗法可以提高脑黑质TH的表达[25],本次实验结果表明,MPTP诱导的PD模型小鼠TH含量减少,针刺干预可以提高TH的表达,推测可能是通过增加 TH的表达而提高了多巴胺的合成能力,进而达到改善模型小鼠运动能力的目的。
1-甲基-4-苯基-吡啶离子(1-methyl-4-phenyl pyridinium, MPP+)是MPTP的活性代谢产物,有研究证明,它同 MPTP一样,对多巴胺能神经元具有损伤作用[26],其不仅会促使 DA异常释放,还会导致细胞一系列的氧化应激反应[27]。近来MPTP与胶质细胞活化以及DA神经元损伤之间的关系也引起了广泛的关注[28],其次通过神经行为学实验评价,证明MPTP诱导完全可以模拟PD患者的运动障碍[29]。本实验采用缓释模型,总时长4周,与腹腔注射急性模型比较,慢性模型更好地模拟了PD的病理学特征[30]。本实验选用游泳实验及步长实验,分别从步态及运动耐性两个角度评价其运动功能。针刺组小鼠的步长距离、游泳时间与PD组比较显著加长,针刺干预改善小鼠PD典型运动症状。
PD属于中医学“颤证”“震颤”“痉证”的范畴,早在《素问·至真要大论》中就诸如“诸风掉眩,皆属于肝”“诸痉项强,皆属于湿”等记载[31]。基于“脑病治肠”理论,在前期研究中发现针刺由、神庭和双侧天枢、上巨虚五穴对PD及其以早期便秘为主的非运动症状均有较好的改善作用[32]。其中神庭为督脉穴,为与足阳明胃经之交会穴,“病变在脑,首取督脉”,其功效是开窍通络止颤;足阳明胃经穴位上巨虚是大肠的下合穴,“邪在腑,取之合”[33],“合治内腑”,具有调节胃肠功能的作用。天枢穴为大肠募穴,是人体上下气机交汇之处,升清降浊之枢纽,能够通大肠和通肺气,配合上巨虚共同发挥调节胃肠功能作用。以上诸穴合用,“上下同调”可开窍、止颤,通调气机、合胃通腑[34-35]。本实验结果显示,早期电针干预可抑制 PD小鼠氧化因子表达,增强机体抗氧化作用,缓解 PD运动功能障碍,为治疗PD提供了新的治疗靶向。

