经皮耳迷走神经刺激对患者术后早期认知功能的影响
王娟,刘佩蓉,刘春亮,彭生
(上海中医药大学附属第七人民医院,上海 200137)
术后认知功能障碍(postoperative cognitive dysfunction, POCD)是发生在手术后的一种中枢神经系统并发症,常表现为焦虑和语言理解、记忆力及社交能力下降等,其中老年患者高发。重度者可表现出躁狂症状,甚至呈类似阿尔兹海默症病(AD)极端痴呆症状,自杀倾向,导致死亡率增加[1-3]。有研究显示应用药物减轻中枢神经系统炎症及营养中枢神经细胞对 POCD具有改善作用,但是药物均有一定的副作用。有研究发现通过物理治疗的方法,在副作用忽略不计的情况下,可以取得类似的效果,其中耳迷走神经刺激是常用的方法之一[4]。而通过迷走神经刺激是否能改善 POCD,目前报道较少。因此,本研究拟采用经皮耳迷走神经刺激,观察其对老年患者术后早期认知功能障碍的影响。
1 临床资料
1.1 一般资料
120例拟择期全麻下手术的老年患者,随机分为经皮耳迷走神经刺激(transcutaneous auricular vagus nerve stimulation, TAVNS)组、假刺激组和空白对照组,每组40例。3组一般资料比较,差异无统计学意义(P>0.05)。详见表1。

表1 3组一般资料比较
1.2 纳入标准
①年龄≥65岁,性别不限;②术前麻醉评估 ASAⅠ~Ⅱ级;③无高血压、糖尿病等系统病变,无精神类药物服用史、药物成瘾史;④能理解并配合完成简易智能量表(MMSE)筛查和蒙特利尔认知评估量表(MoCA)测定;⑤自愿参加本项试验,签署知情同意书。
1.3 排除标准
①术前MMSE<27分者;②处于妊娠期、哺乳中或计划怀孕者;③合并有心、脑、肝、肾和造血系统严重原发性疾病,以及急性病、传染病、恶性肿瘤者;④曾参加过电刺激治疗的临床试验者;⑤电刺激部位皮肤有破损或皮肤病者。
2 治疗方法
2.1 TAVNS组
常规乙醇消毒后,于耳甲迷走神经分布区[解剖学定位为耳甲腔和耳甲艇,耳甲艇后下缘为耳甲 12区(肝);耳甲腔后上缘为耳甲 13区(脾);对耳轮下脚臀穴直对的耳甲艇为耳甲10区(肾),肝肾之间为耳甲11区(胰胆);耳甲腔中心为耳甲 15区(心);心穴周围为耳甲14区(肺);心穴到外耳道口为耳甲16区(气管);屏间切迹内缘为耳甲 17区(三焦);外缘为耳甲 18区(内分泌)]放置电极片后,采用低频脉冲治疗仪(G6805-2)进行 30 min的刺激,强度 1 mA,频率 20~30 Hz,脉冲持续时间1 ms,刺激间隔时间10 s。每日1次。术前1 d至术后3 d进行治疗。
2.2 假刺激组
予以相同参数的电刺激,但电极刺激位置为耳郭非迷走神经分布区域,详见图1。

图1 刺激部位示意图
2.3 空白对照组
不做任何处理。
3 治疗效果
3.1 观察指标
3.1.1 行为学指标
术前 1 d采用简易智力状态检查(MMSE)进行筛选,MMSE<27分者剔除。入组后,由经过培训的专人评估,记录所有患者术前1 d,术后1 d、3 d、7 d的MoCA评分。MoCA内容包括注意与集中、执行功能、记忆、语言、视空间技能、抽象思维、计算和定向力8个认知领域的11个检查项目。完成MoCA检查大约需要10 min。总分为30分,<26分被认为有认知功能障碍。
3.1.2 血清生化指标
用酶联免疫吸附法(ELISA)测定术前、术毕及术后1 d、3 d的神经元特异性烯醇酶(NSE)、S100β、肿瘤坏死因子(TNF)-α、白细胞介素(IL)-6及 IL-1β表达水平。
3.2 统计学方法
所有数据均采用 SPSS21.0统计学软件进行统计分析。符合正态分布的计量资料以均数±标准差表示,不同时间点的组间比较采用单因素方差分析,组内不同时间点比较采用配对t检验。不符合正态分布的资料比较采用Wilcoxon秩和检验。检验水准为α=0.05。
3.3 治疗结果
3.3.1 3组不同时间MoCA评分比较
术前3组患者MoCA评分比较,差异无统计学意义(P>0.05)。术后1 d、3 d、7 d,TAVNS组的评分高于假刺激组和空白对照组(P<0.05),假刺激组和空白对照组比较差异无统计学意义(P>0.05)。详见表2。
表2 3组不同时间MoCA评分比较 (±s,分)

表2 3组不同时间MoCA评分比较 (±s,分)
组别 例数 术前 术后1 d 术后3 d 术后7 d TAVNS 组 40 27.95±0.85 26.25±1.35 27.08±1.47 27.78±1.00假刺激组 40 27.88±0.79 25.03±1.46 25.43±1.55 25.48±4.08空白对照组 40 27.90±0.67 24.90±1.66 25.13±1.74 25.85±1.53 F - 0.098 9.937 17.377 9.136 P - 0.907 <0.001 <0.001 <0.001
3.3.2 3组不同时间血清NSE和S100β水平比较
3组术前和术毕血清 NSE、S100β比较,差异无统计学意义(P>0.05)。与空白对照组和假刺激组比较,TAVNS组术后1 d、术后3 d的NSE、S100β水平降低(P<0.05);假刺激组和空白对照组比较差异无统计学意义(P>0.05)。详见表3。
表3 3组不同时间血清NSE和S100β水平比较 (±s, ng/mL)
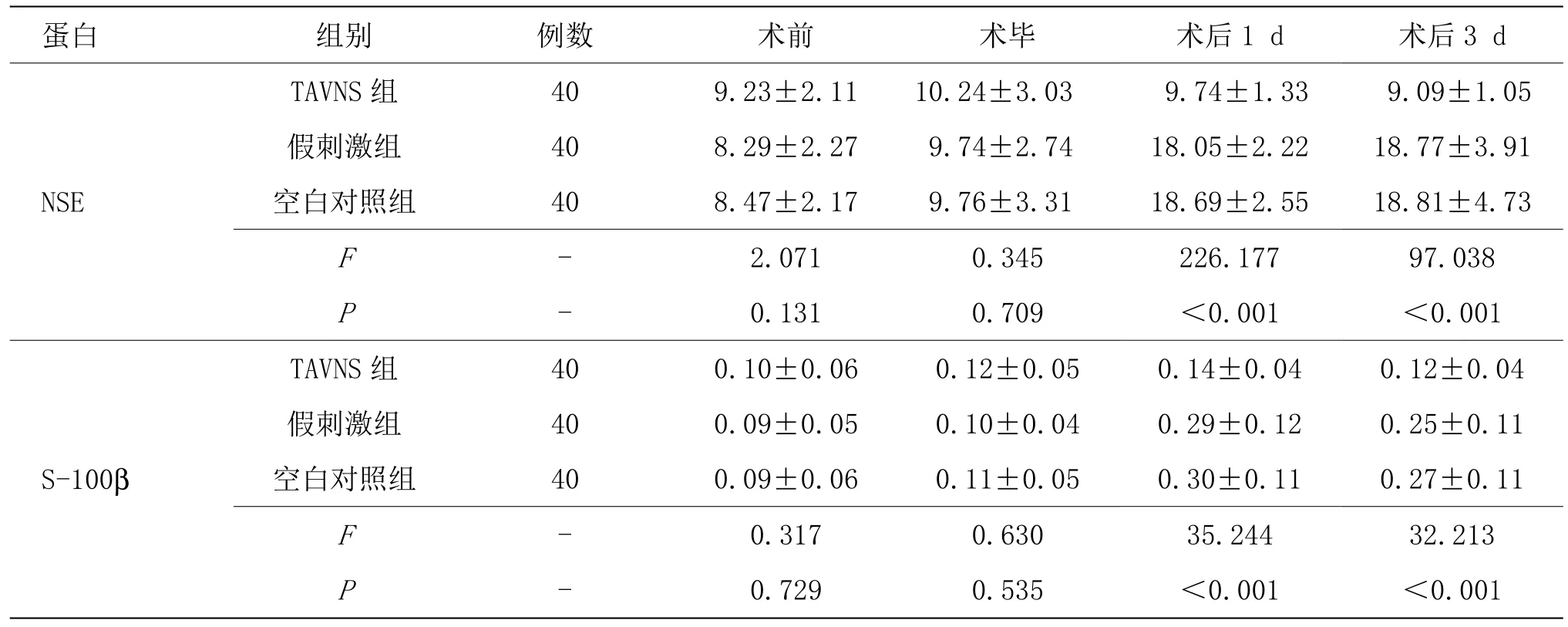
表3 3组不同时间血清NSE和S100β水平比较 (±s, ng/mL)
蛋白 组别 例数 术前 术毕 术后1 d 术后3 d NSE TAVNS 组 40 9.23±2.11 10.24±3.03 9.74±1.33 9.09±1.05假刺激组 40 8.29±2.27 9.74±2.74 18.05±2.22 18.77±3.91空白对照组 40 8.47±2.17 9.76±3.31 18.69±2.55 18.81±4.73 F - 2.071 0.345 226.177 97.038 P - 0.131 0.709 <0.001 <0.001 S-100β TAVNS 组 40 0.10±0.06 0.12±0.05 0.14±0.04 0.12±0.04假刺激组 40 0.09±0.05 0.10±0.04 0.29±0.12 0.25±0.11空白对照组 40 0.09±0.06 0.11±0.05 0.30±0.11 0.27±0.11 F - 0.317 0.630 35.244 32.213 P - 0.729 0.535 <0.001 <0.001
3.3.3 3组不同时间血清 TNF-α、IL-6、IL-1β水平比较
3组术前和术毕血清TNF-α、IL-6、IL-1β水平比较,差异无统计学意义(P>0.05)。与空白对照组和假刺激组比较,TAVNS组术后 1 d、术后 3 d患者血清TNF-α、IL-6、IL-1β水平降低(P<0.05);假刺激组与空白对照组比较差异无统计学意义(P>0.05)。详见表4。
表4 3组不同时间血清TNF-α、IL-6、IL-1β水平比较 (±s, ng/mL)

表4 3组不同时间血清TNF-α、IL-6、IL-1β水平比较 (±s, ng/mL)
蛋白 组别 例数 术前 术毕 术后1 d 术后3 d TNF-α TAVNS 组 40 4.30±1.62 4.98±1.66 5.41±1.37 5.66±1.02假刺激组 40 4.03±1.46 4.44±1.63 11.30±3.70 10.79±3.51空白对照组 40 4.05±1.76 5.24±1.44 13.36±3.27 11.89±3.50 F - 0.343 2.640 77.699 51.910 P - 0.711 0.076 <0.001 <0.001 IL-6 TAVNS 组 40 103.23±27.09 108.45±26.68 94.86±18.61 90.80±19.16假刺激组 40 98.81±24.53 107.27±26.15 203.06±29.22 188.27±19.78空白对照组 40 99.02±29.62 107.11±27.88 201.14±26.35 193.23±26.89 F - 0.337 0.030 242.830 270.229 P - 0.715 0.971 <0.001 <0.001 IL-1β TAVNS 组 40 90.50±2.90 91.14±2.41 93.64±3.91 92.94±3.28假刺激组 40 90.02±2.63 90.72±3.00 173.07±50.77 163.29±41.78空白对照组 40 90.05±3.17 90.14±2.42 191.90±48.08 154.82±33.93 F - 0.336 1.458 66.544 60.876 P - 0.715 0.237 <0.001 <0.001
4 讨论
有研究[5]显示,POCD的发生率可高达15.66%,且一旦发生,会导致患者死亡率增加,丧失工作能力的风险增高,并增加家庭社会负担。在老年患者发生率更高,研究显示老年患者术后早期认知功能障碍在术后1周发生率为23%,70岁以上的为29%,术后3个月超过70岁的患者发生率仍有14%,提示POCD的风险随着年龄的增加而增加[6]。针对POCD,目前尚没有疗效确切的药物或改善措施。因此,尚需要临床进一步的探讨。
迷走神经刺激术(VNS)是近年来兴起的用于治疗某些顽固性疾病的物理治疗方法,美国 FDA分别于1997年2005年先后批准了颈部VNS作为难治性癫痫及抑郁症的一种可行疗法[7]。有一个小样本的临床试验,用VNS治疗10例老年性痴呆(AD)患者,经治疗后患者的认知功能得到了明显改善。直接的迷走神经刺激术需要暴露迷走神经并放置刺激器,手术风险高,并发症多,临床开展并不广泛。近年来大量学者研究显示经皮耳迷走神经刺激(TAVNS)是无需手术,费用较低,几乎没有不良反应,并能保证与传统VNS有相近功效[8-9]。已有研究发现TAVNS在治疗癫痫[10]、抑郁症[11]、意识障碍[12]等多种脑及相关疾病中发挥着重要的作用。
耳针是中医针灸学的一个重要组成部分,“耳者,宗脉之所聚也”。耳甲区有耳穴心、耳穴肝、耳穴肾、耳穴神门等分布,称为“内脏代表区”。神经解剖学研究表明,耳甲是体表唯一有迷走神经分布的区域,刺激耳甲区可激活迷走神经耳支,其传入纤维到达中枢神经系统,传出纤维支配心血管系统、呼吸系统、胃肠道系统等外周器官。理论上,经皮耳迷走神经刺激能够通过激活耳甲区传入性迷走神经进而促使传出性迷走神经传出冲动增加,从而激活胆碱能抗炎通路,最终抑制炎症反应。
中枢神经系统炎症是POCD发生的重要原因,POCD的发生与术后外周血炎症标记物浓度有关[13],因此减轻炎症反应理论上可以改善POCD。TNF-α、IL-6、IL-1β是反映机体炎症水平的常用指标,因此本研究中其表达水平被选择用于代表术后的炎症水平。结果显示,手术结束后,由于创伤、应激和麻醉等原因,TNF-α、IL-6、IL-1β显著上调。手术结束后,采用耳穴迷走神经刺激的TAVNS组患者TNF-α、IL-6、IL-1β表达水平显著低于空白对照组,同时其MoCA评分也显著高于空白对照组,提示,耳穴迷走神经刺激通过抑制术后炎性细胞因子的表达参与了POCD的改善。而假刺激组无显著效果。参照RONG P等[11]研究,本试验的假刺激采用的是将电极部位移动到耳郭非耳甲区部位,结果显示,同样的刺激参数下,假刺激组抑制炎性细胞因子TNF-α、IL-6、IL-1β的上调效果较TAVNS组明显较差,提示耳甲区刺激有特定的治疗效果。杨欢等[14]研究表明电针刺激可以降低糖尿病患者术后认知功能障碍的发生,并降低血清IL-6、IL-1β水平。李小娇等[15]研究也发现连续8周的耳甲电针刺激可以显著改善难治性抑郁的认知评分,和笔者的结果相一致。
NSE和S100β表达均是脑损伤的外周血反映指标,脑损伤后NSE和S100β表达上升后,可以透过血脑屏障渗出到外周血,因此通过测量外周血NSE和S100β的表达可以反映出脑损伤水平。POCD的发生的实质是手术中多种原因造成的脑损伤,因此术后外周血 NSE和S100β表达具有不同程度上调。RUSLIN M等[16]研究发现脑损伤患者脑神经元发生损伤,NSE就会释放入细胞间隙和脑脊液,导致脑脊液和血清中 NSE的含量升高,血浆 NSE水平与患者脑损伤的严重程度呈显著性相关。MERCIER E等[17]研究表明,检测血清S100β蛋白可判断颅脑损伤严重程度,脑损伤后 S100β蛋白水平与患者预后不良有显著相关。徐静等[18]研究表明,S100β和 NSE在脑内分别代表神经胶质细胞和神经元的损伤程度,二者联合检测具有互补的诊断价值,能更全面、准确地反映脑损伤程度。而林之薇[19]研究表明术前使用乌司他丁,可降低老年患者手术后出现围术期神经认知紊乱的发生率,该保护作用与其抗炎作用有关,其抑制炎性细胞因子的表达后,可以显著抑制外周血NSE、S100β和IL-6的上调。饶瑾等[20]研究表明高压氧治疗可以减少患者外周血 TNF-α、IL-6水平,抑制炎性反应,可以改善老年患者手术后认知功能。
炎性细胞因子导致认知功能障碍可能的机制是①炎症导致血脑屏障受损,使外周血的有害物质更容易通过血脑屏障进入中枢[21-23]。②炎症能促进神经细胞凋亡,导致神经细胞数量减少。③炎症导致神经胶质细胞激活增加,进一步放大炎症反应,导致细胞水肿,细胞间信息传导障碍,表现为认知功能受损。近年来大量临床及实验研究[24-29]证实了TNF-α、IL-6等炎症因子可以参与学习、记忆的生理过程,并在认知功能障碍的病理生理过程中发挥一定的作用,各种促炎细胞因子水平显著升高,进一步激活小胶质细胞并破坏血脑屏障的通透性,从而引起脑损伤和认知功能障碍。
因此本试验观察了经皮耳迷走神经刺激治疗前后患者外周血NSE和S100β的表达水平和TNF-α、IL-6、IL-1β的表达水平。研究发现,与空白对照组和假刺激组比较,TAVNS组术后1 d、3 d患者血清NSE、S100β和 TNF-α、IL-6、IL-1β水平降低;而假刺激组与空白对照组比较无明显差异。术前3组患者MoCA评分组间比较,差异无统计学意义;而术后1 d、3 d、7 d, TAVNS组的评分显著大于假刺激组和空白对照组。因此可以推断出随着时间的延长,多次经皮耳迷走神经刺激可以缓解老年患者术后早期认知功能障碍。
综上所述,经皮耳迷走神经刺激可以显著改善老年患者术后的认知评分,同时抑制NSE和S100β水平和炎性细胞因子TNF-α、IL-6、IL-1β水平的上调。

