基于ciRS-7/miR-7/FAK通路研究掌叶半夏水提物对宫颈癌的抑制作用*
王明喜,张丽霞,王长平,朱前勇
1.安阳市中医院,河南 安阳 455000; 2.河南省人民医院,河南 郑州 450000
宫颈癌是妇科最常见的恶性肿瘤之一,我国每年有14万的新增宫颈癌患者,发病率仅次于乳腺癌,这可能与我国妇女人乳头瘤病毒(human papilloma virus,HPV)感染率上升有一定关系[1-2]。目前,宫颈癌的主要治疗方法为手术治疗和放疗,但不良反应较大,且对年轻患者生育功能的保留以及对复发或晚期宫颈癌的治疗造成诸多问题,因此寻找新的宫颈癌治疗方法尤为重要[3-4]。
近年来,中草药以有效、低毒的优势日益受到人们的重视,并作为治疗肿瘤的补充和替代疗法。掌叶半夏为植物掌叶半夏的块茎,性辛、味平、入肝经,具有祛风定惊、燥湿化痰、消肿散结的功效[5-6]。现代研究表明,掌叶半夏水提物(pinellia extract,PE)可通过诱导CD+T细胞向Th1型分化,改善调节性T淋巴细胞(regulatory T lymphocyte,Treg)和辅助性T淋巴细胞17(T helper lymphocyte 17,Th17)的比例发挥抗肿瘤免疫作用;还可通过阻断细胞外调解蛋白激酶(extracellular regulated protein kinases,ERK)的磷酸化、促进B细胞淋巴瘤-2相关X蛋白质(B-cell lymphoma-2-associated X,Bax)的基因表达水平抑制CaSki和HeLa宫颈癌细胞株的增殖[7]。进一步的动物实验研究证明,PE能改善顺铂引起的裸鼠体质量下降及肝酶升高,同时能够抑制CaSki裸小鼠皮下移植瘤的生长[8-9],但对其具体机制未做深入研究。本研究通过细胞实验探讨PE对人类宫颈癌细胞侵袭及迁移的影响,并拟建立人宫颈癌HeLa细胞株裸鼠皮下移植瘤模型,基于小脑变性相关蛋白1反义转录物(circular RNA sponge for microRNA-7,ciRS-7)/microRNA-7(miR-7)/着斑激酶(focal adhesion kinase,FAK)信号通路探讨PE改善宫颈癌的作用机制,为临床宫颈癌的治疗提供新途径。
1 材料
1.1 动物与细胞人宫颈癌细胞(HeLa,中国科学院典型培养物保藏委员会细胞库,细胞目录号:TChu187);SPF级BALB/c-nu雌性裸小鼠18只,购自北京维通利华实验动物技术有限公司,(7±1)周龄,体质量(20±2)g,动物合格证号:201711179,动物许可证号:SCXK(京)2017-1-003,所有小鼠均笼养在相同条件下,室温控制在(24±1) ℃,自由摄食、饮水,大鼠适应性喂养1周后开始实验。动物实验由安阳市中医院动物伦理委员会审批通过(HNN02019-0129)。
1.2 药物与试剂PE(上海禾午生物科技,货号:S24752);胎牛血清(北方智杰方远科技有限公司,货号:10099141C);二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量检测试剂盒(上海酶联生物科技有限公司,货号:ML2766);FAK抗体(上海抚生实业有限公司,货号:A097939);p-FAK山羊抗兔单克隆抗体(美国Abcam公司,货号:ab81298);IgG辣根过氧化酶(horseradish reroxidase,HRP)标记二抗多克隆抗体(北京博奥森生物技术有限公司,bs-40295G-HRP);GAPDH单克隆抗体、TRIzol 试剂盒(北京百奥莱博科技有限公司,货号:SY0635、BTN71201);Go ScriptTM 逆转录试剂盒(普洛麦格生物技术有限公司,货号:A2800);实时荧光定量PCR试剂盒(上海谷研实业有限公司,货号:GOY-0606P);DMEM培养基(上海户实医药科技有限公司,货号:12800-017);牛胎儿血清(美国 Invitrogen 公司,货号:A3161001C);青霉素(湖北威德利化学科技有限公司,规格:5 kg/瓶,货号:HBW-M9);链霉素(湖北广奥生物科技有限公司,规格:25 kg/桶,货号:GA3807);罗斯威尔公园纪念研究所(roswell park memorial institute,RPMI) 1640培养基(上海华雅思创生物科技有限公司,货号:10-040-CV);引物序列委托上海生物工程技术公司合成。
1.3 仪器DM500型光学显微镜及其成像系统、VORTEX 3型漩涡混匀器、DC300F型生物显微镜(德国LEICA公司);JY04S-3C型凝胶图像分析系统(上海创赛科技有限公司)。
2 方法
2.1 细胞培养将HeLa细胞复苏后,转移至DMEM培养基中(含10%热灭活的牛胎儿血清、100 U·mL-1青霉素、100 mg·L-1链霉素),在5%CO2、37 ℃恒温培养箱中培养传代,用0.5%胰蛋白酶消化传代,传2至3代后备用。
2.2 Transwell小室法检测HeLa细胞侵袭、迁移能力Transwell小室用孔径6.5 mm微孔膜分隔为上室和下室。收集2.1项下所得的宫颈癌HeLa细胞,分为HeLa细胞对照组和HeLa细胞PE干预组(0.15 g·L-1)。于4 ℃、3 000 r·min-1下将两组HeLa细胞离心10 min,弃上清液,用预冷的PBS洗涤,反复进行3次,取200 μL HeLa悬液置于Transwell上室,并加600 μL含20%胎牛血清的DMEM培养液到Transwell下室,培养24 h后,取出Transwell小室用预冷PBS冲洗2次,轻轻擦去上室细胞,甲醇固定膜及膜上细胞15 min,结晶紫染色30 min,33%醋酸溶液洗脱,显微镜下观察拍照,计算细胞计数[10]。上述操作重复3次取均值。
2.3 动物分组、移植瘤模型制备及药物干预将18只BALB/c-nu雌性裸小鼠适应性喂养1周后,随机分成正常对照组、皮下移植瘤模型组和PE干预组,每组6只。取2.1项下对数生长期的人宫颈癌HeLa细胞,调整细胞密度为1×107mL-1,除正常对照组外,其余组裸小鼠颈背部皮下注射接种人宫颈癌HeLa细胞0.2 mL建立移植瘤模型。接种13天后,瘤体直径大约5 mm,此时PE干预组裸小鼠以10 mg·kg-1剂量腹腔注射0.2 mL PE,每天1次,连续3周,其余组给予同等体积的生理盐水。
2.4 荷瘤小鼠肿瘤体积及抑瘤率的计算用药3周后,分别测量移植瘤的长径、短径,计算肿瘤体积V=长径×短径2/2,评估3组小鼠移植瘤的大小。小鼠脱臼处死,取肿瘤并称其质量,计算抑瘤率。
抑瘤率=(对照组平均瘤质量-干预组平均瘤质量)/对照组平均瘤质量×100%
2.5 RT-qPCR法检测各组小鼠肿瘤组织中ciRS-7mRNA及miR-7mRNA的表达水平取0.1 g小鼠肿瘤组织,放入研钵中,在液氮中将其充分研磨后,倒入1.5 mL EP管中,加入1 mL TRIzol溶液,振荡混匀。室温孵育10 min,4 ℃、12 000 r·min-1离心10 min,取上层清液,根据1 mL TRIzol加入 200 μL 氯仿比例,加入专用氯仿,振荡15 s,冰浴静置20 min,4 ℃,12 000 r·min-1离心20 min,取上清液,加入450 μL异丙醇,混匀,-20 ℃孵育40 min,4 ℃,12 000 r·min-1离心20 min,弃去上清液,加入1 mL冰浴的75%乙醇洗涤沉淀,使沉淀悬浮,4 ℃,7 500 r·min-1离心10 min,弃去上清液。PCR扩增:94 ℃预变性2 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸2 min(共35个循环),72 ℃总延伸6 min。随后进行琼脂糖凝胶电泳,分析目的基因和参比基因GAPDH的条带灰度值[11]。引物序列见表1。

表1 引物序列
2.6 Western Blot法检测各组小鼠肿瘤组织中FAK蛋白的表达水平取肿瘤组织100 mg,研碎后,加入总蛋白提取液,冰浴后于4 ℃下10 000 r·min-1离心10 min,取上清,BCA法进行蛋白定量,调整蛋白浓度至5 mg·L-1,取20 μL,水浴加热变性后上样,以十二烷基硫酸钠-聚丙烯酰胺凝胶电泳将不同相对分子质量蛋白分离,转到PVDF膜上,将膜洗涤后在5%牛血清蛋白溶液中室温封闭60 min,TBST洗涤后4 ℃孵育一抗(FAK、p-FAK GAPDH一抗稀释比例为1500),过夜后孵育HRP标记的鼠抗兔二抗(12 000),室温下振荡孵育2 h,清洗后用化学发光试剂进行显色,显色后,以凝胶成像仪观察条带并拍照,Image- QuaNT软件测光密度,以GAPDH为内参,计算相对光密度值[12]。

3 结果
3.1 PE对HeLa细胞侵袭能力的影响Transwell小室法检测 HeLa细胞侵袭能力的变化发现,与HeLa细胞对照组比较,HeLa细胞PE干预组细胞侵袭数目显著降低(P<0.01),提示PE可抑制HeLa细胞的侵袭能力。见图1,表2。

注:A:HeLa细胞对照组;B:HeLa细胞PE干预组

表2 PE对HeLa细胞侵袭、迁移能力的影响
3.2 PE对HeLa细胞迁移能力的影响Transwell小室法检测 HeLa细胞迁移能力的变化发现,与HeLa细胞对照组比较,HeLa细胞PE干预组细胞迁移数目显著降低(P<0.01),提示PE可抑制HeLa细胞的迁移能力。见图2,表2。
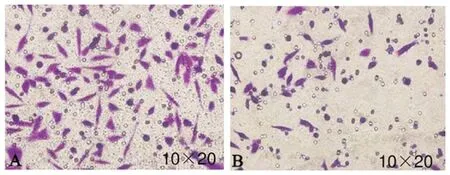
注:A:HeLa细胞对照组;B:HeLa细胞PE干预组
3.3 PE对荷瘤小鼠肿瘤生长的影响与皮下移植瘤模型组比较,PE干预组荷瘤裸鼠肿瘤体积明显变小(P<0.01),肿瘤质量明显降低(P<0.01),提示PE对宫颈癌小鼠具有显著的抑瘤作用。见图3,表3。

表3 PE对荷瘤小鼠肿瘤生长的影响

注:A:皮下移植瘤模型组小鼠;B:PE干预组小鼠;C:皮下移植瘤模型组与PE干预组小鼠肿瘤大小
3.4 PE对荷瘤小鼠肿瘤组织中FAK蛋白表达水平的影响与正常对照组比较,皮下移植瘤模型组小鼠FAK蛋白表达水平显著升高(P<0.05),p-FAK蛋白表达水平显著降低(P<0.05);而PE干预组FAK蛋白及p-FAK蛋白的表达水平无明显差异(P>0.05)。与皮下移植瘤模型组比较,PE干预组FAK蛋白表达水平显著降低(P<0.05),p-FAK蛋白表达水平显著升高(P<0.05)。以上结果表明,PE促进FAK蛋白的磷酸化。见图4。

注:A:正常对照组;B:皮下移植瘤模型组;C:PE干预组;与正常对照组比较,*P<0.05;与皮下移植瘤模型组比较,#P<0.05
3.5 PE对荷瘤小鼠肿瘤组织中ciRS-7mRNA、miR-7mRNA表达的影响与正常对照组比较,皮下移植瘤模型组ciRS-7mRNA的表达水平显著升高(P<0.05),miR-7mRNA的表达水平显著降低(P<0.05);PE干预组ciRS-7mRNA、miR-7mRNA的表达水平无明显差异(P>0.05)。与皮下移植瘤模型组比较,PE干预组ciRS-7mRNA的表达水平显著降低(P<0.05),miR-7mRNA的表达水平显著升高(P<0.05)。见表4。

表4 PE对荷瘤小鼠肿瘤组织ciRS-7 mRNA、miR-7 mRNA表达的影响
4 讨论
随着医学技术的快速发展,宫颈癌诊疗水平大幅提高,但发病率仍居高不下,给女性的生命健康造成了严重威胁[13]。宫颈癌的临床治疗主要是以铂类为基础的联合化疗,然而,由于药物的毒性作用以及肿瘤细胞的耐药性导致治疗效果产生了极大限制[14-15],因此,需要探寻新的药物治疗手段。
掌叶半夏又名虎掌南星,具有定惊祛风、化痰散结的功效。研究表明,掌叶半夏浸出液可使HeLa宫颈癌细胞凝缩成团块,失去正常细胞结构;还可导致部分细胞脱落,对宫颈癌有明显的抑制作用[16-17];由掌叶半夏等中药制成的薄膜对宫颈癌前病变同样具有一定的阻断作用[18]。PE可以通过抑制ERK磷酸化及B细胞淋巴瘤-2(B cell lymphoma-2,Bcl-2)、增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)及病毒癌基因E6的表达,上调抑癌基因P53的表达等抑制宫颈癌细胞株Cski和HeLa的增殖,并促进细胞凋亡[19-20]。本研究显示,PE的干预可显著降低HeLa细胞侵袭及迁移数目,与上述文献研究结果相符。
研究显示,抑癌因子miR-7在人宫颈癌组织中的表达明显低于正常宫颈组织[21];ciRS-7具有miR-7的海绵样吸附作用,可抑制miR-7 的功能,在人宫颈癌组织中的表达高于正常宫颈组织[22-23]。ciRS-7/miR-7轴不仅具有重要的生物学作用,同时参与机体多种疾病的发生发展。FAK是一种细胞质内的蛋白酪氨酸激酶,参与胞内多条信号通路的传导[24]。有关研究显示,ciRS-7包含了miR-7,ciRS-7能提高miR-7靶基因表达,miR-7通过靶定FAK来抑制宫颈癌细胞增殖、侵袭及迁移[25]。FAK在多种类型的肿瘤细胞中都出现表达量和活性上调现象,通过激酶依赖和非激酶依赖机制参与肿瘤细胞侵袭、转移、增殖、生长和抗凋亡等多个过程[26-27]。YUAN等[28]通过分析人乳腺癌的病例,发现FAK表达随乳腺癌恶性程度增高而增加。在本研究结果中,PE提高FAK蛋白的磷酸化,而降低FAK蛋白的表达,可能是因为PE抑制miR-7mRNA的表达水平,增加ciRS-7mRNA的表达,从而降低了下游FAK蛋白的表达量。推测,PE可能通过调节ciRS-7/miR-7/FAK通路抑制宫颈癌荷瘤小鼠肿瘤组织的生长。
综上所述,PE可抑制宫颈癌Hela细胞的侵袭和迁移,抑制肿瘤细胞的生长,其作用机制可能与调控ciRS-7/miR-7/FAK信号通路有关。

