经导管瓣中瓣流体动力学PIV实验研究
刘丽,万辰杰,王硕,李崇崇,柯林楠,王春仁
中国食品药品检定研究院 医疗器械检定所,北京 102629
引言
随着人工生物心脏瓣膜材料和技术的不断更新和发展,越来越多的临床研究显示出生物瓣膜的优越性[1-5]。目前,市场上所用的生物瓣膜主要由牛心包或猪主动脉瓣制成,此类生物瓣膜的优势是患者不需终身接受抗凝治疗,但其发生瓣膜毁损和二次换瓣手术的概率较高,且二次开胸手术风险相比首次手术明显增加。
自2008年开始,随着介入技术的发展,经导管瓣中瓣植入技术逐渐在临床上尝试使用[6-10]。该治疗方法将经导管植入式人工心脏瓣膜(以下简称:经导管瓣膜)压缩至输送系统的管道内,经股动脉(或心尖)植入至已毁损生物瓣膜的瓣口处进行释放,完成瓣膜的二次植入。相比传统外科瓣膜治疗术,经导管瓣中瓣植入不需要开胸和体外循环,患者术后创伤较小、恢复快,非常适用于无法承受二次开胸手术的高龄、高危患者,并逐渐成为生物瓣膜二次植入的替代手术。Deepak等[11]通过在PubMed等数据库检索出二次换瓣临床试验594例,其中有255例经导管瓣中瓣植入术,339例二次开胸生物瓣膜植入术,二者在手术死亡率、30 d死亡率和1年死亡率方面无显著差异,该结果从临床上说明了经导管瓣中瓣技术治疗高危手术患者主动脉瓣衰败的安全性和可行性。
近几年,国内也逐渐开展了经导管瓣中瓣技术的临床应用研究[12-13]。经导管瓣中瓣的特殊结构,导致植入的经导管瓣膜开口面积更小、跨瓣压差增加,从而增加了心脏负荷,在一定程度上会影响瓣膜使用寿命。流体力学数据是临床上选择瓣膜规格的重要依据,但目前关于经导管瓣中瓣的研究多为临床病例报道,能对其进行评估的流体力学相关研究数据仍旧比较缺乏[14-19]。
本文以人体真实血流流量波形为基准,构建体外循环流动系统,采用粒子图像测速技术(Particle Image Velocimetry,PIV)对经导管瓣中瓣以及经导管瓣膜的下游血管内流场进行重构,在获取运动学信息的基础上引入时间平均壁面剪切应力、震荡剪切指数、相对停留时间等动力学参数,对瓣膜流体动力学性能进行评估,为经导管瓣中瓣临床前的评价提供参考。
1 材料与方法
1.1 实验装置
实验台主要包括两部分:循环回路和测量系统(图1)。循环系统基于脉动流性能测试,采用模块化人工心脏瓣膜脉动流测试系统(上海心瓣测试设备有限公司)进行研究[19-20]。该系统能模拟主动脉瓣部位流动环境,提供生理压力及流量波形。实验中,为增强流动可视化,选取透明的有机玻璃装置来模拟血液回路中的各个器官,并模拟实现各自生理功能。绿色回路为模拟简化后的人体真实血液循环,血液从电机模拟的左心室流出,通过主动脉瓣膜进入主动脉以及下游各级分支(图1中的透明管路),然后流到左心房(开口柱形容器),最后经二尖瓣(球形机械瓣膜)返回左心室,为下次血液循环提供足够血液流量。其中,黄色箭头所标注的均为实验系统中的测量装置,由同步器控制的激光发射频率与高速数码相机的采集频率保持一致,可获得一系列关于时间序列的粒子图像对。

图1 实验台系统
PIV测量系统作为一种非侵入式的全流场流动测量技术,被广泛应用于主动脉瓣的流场研究[21-23]。其原理是在待测流体中添加示踪粒子,通过同步器控制激光发生器发射片光源照亮目标流场区域,同时在激光工作的瞬时利用CCD相机记录一系列时间序列下的粒子图像对,最后基于算法程序获得目标区域的速度场信息[23]。本文所采用的PIV系统主要由双脉冲激光器(New Wave Research,Solo PIV,532 nm,400 mJ,5 ns)、高速数码相机(PCO 1200 HS)、同步器(575型脉冲/延迟发生器)、用于保持和移动激光束的电控协调框架以及计算机组成。图2为PIV计算流场,图3为循环系统中压力和流量随时间变化的曲线图。

图2 PIV计算流场
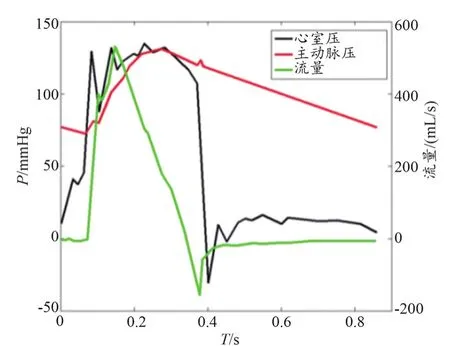
图3 脉动循环压力流量曲线
管路内部流体介质选取黏度、密度与真实血液较为接近的甘油-蒸馏水混合液,将二者按37∶63的比例均匀混合后加入循环系统中,升温至37 ℃,介质密度ρ=1100 kg/m3、常温时黏度µ=0.0035 Pa·s,折射率(n=1.33)与测试用夹具折射率相近(n=1.33)[24]。PIV系统激光器的发射波长为532 nm,发射频率为15 Hz。双脉冲激光器产生的激光经过导光臂、柱面镜和球面镜等片光元件引导后在实验模型中心平面形成厚度约为5 mm的片光,激发均匀布散于工作流体中的示踪粒子。为使图像能够有效反映流场信息,所选取的示踪粒子需要有效反射激光束波长,且具备良好跟随性。因此,选取粒径为8~12 μm、浓度为0.25%的空心玻璃珠悬浊液作为示踪剂。PIV的测试参数如下:① 测试液黏度为3.5×10-3Pa·s(甘油水溶液);② 示踪粒子:空心玻璃珠,d=8~12 μm;③ PIV时间间隔为280 μs;④ PIV曝光时间为100 μs;⑤ PIV成像率:15 Hz(同步脉冲);⑥ 成像物比:1 像素=9×10-5m;⑦ PIV速度物体比:1像素/帧=0.3331 m/s;⑧ 成像分辨率为625×1280像素。
1.2 实验样品
本文所使用瓣中瓣的外瓣为St.Jude Medical Inc.的生物瓣膜(27 mm),内部嵌套的瓣膜为苏州杰成医疗科技有限公司的经导管瓣膜(25 mm),见图4a。将二者按照图4b所示方式安装于循环系统的测试区域上游。

图4 心脏瓣膜安装示意图
1.3 实验要求
本研究以人体真实血流流量波形为基准,构建体外脉动循环系统,采用PIV技术对人工心脏瓣膜下游血管内流场进行重构,在获取运动学信息的基础上引入时间平均壁面剪切应力、震荡剪切指数、相对停留时间等动力学参数,结合瓣膜平均跨瓣压差、反流百分比等临床评价指标,对经导管瓣中瓣以及经导管瓣膜下游流场动力学性能进行评估。
2 结果
2.1 速度场
瓣膜的开闭随脉冲流动呈现周期性变化,完整的周期运动包括瓣膜开启-瓣膜关闭-瓣膜重新开启三部分,因此可通过分析速度的周期性变化得到瓣膜的周期特征值。如图5a所示,选取流量Q=2 L/min时瓣膜安装位置下游测试区域几何中心点所对应的速度随时间变化的曲线,来计算瓣膜的运动周期。对速度曲线进行傅立叶变换(图5b)。根据主频信息,可以得到瓣膜周期为T=0.85 s。非定常流动条件下,单一周期内的流动状态不断变化,为便于描述流动特性,结合相机采集频率(15 Hz),将单个心动周期分为13个相位,各节点对应不同的瓣膜开度,对应瓣膜从开启到关闭(图5c),纵坐标变量代表不同时刻下的流量Q,本文选取四个节点(A、B、C、D)进行结果展示,它们分别对应心脏收缩早期、收缩峰值期、收缩晚期以及舒张早期四个特征状态,以评估运动学和动力学的时间无关特征。

图5 测试区域几何中心速度曲线及傅立叶分析
图6~7分别展示了经导管瓣中瓣和经导管瓣膜Q=4.0 L/min时心动周期内测试瓣膜附近的速度分布云图。收缩早期主动脉瓣瓣叶开始张开,瓣口处出现血液流动;收缩峰值期主动脉瓣瓣叶完全打开,血液中心对称流动加剧,血液跨瓣流动达到最大速度;收缩晚期主动脉瓣开始关闭,主动脉瓣附近的血液流动现象与峰值期现象相似,但流动速度降低;舒张早期随着主动脉瓣的关闭,跨瓣流动逐渐消失。经导管瓣中瓣与经导管瓣膜相比,最大速度相对较小,中心射流偏下,说明瓣中瓣安装后不完全居中,存在位置偏移。

图6 Q=4.0 L/min经导管瓣中瓣的相平均速度场和空间平均速度场

图7 Q=4.0 L/min经导管瓣膜的相平均速度场和空间平均速度场
2.2 主动脉瓣附近黏性剪应力和涡量
过大的剪应力会破坏血管壁的结构或导致血栓形成。因此,壁面剪应力是评价瓣膜性能的重要依据。根据速度分布导出的变量,包括剪应力和涡量,见式(1)~(2)。

图8~9分别显示了经导管瓣中瓣和经导管瓣膜的剪切应力场分布。经导管瓣中瓣和经导管瓣膜在整个循环中剪应力场变化趋势相同。在瓣膜打开之前,流体保持几乎均匀,剪切应力值接近于0;当瓣膜打开到最大值时,剪切应力也达到最大值。由于2组测试瓣膜的安装几何形状相似,理论上它们之间的剪应力分布应该是相似的。然而,经导管瓣中瓣比经导管瓣膜速度场、剪切应力场和涡流场有更大的不对称性,说明经导管瓣中瓣在安装过程中出现了中心偏离,该偏离可能由于安装经导管瓣膜的生物瓣膜的瓣叶所致,本实验中生物瓣膜为全新瓣膜,临床中如果生物瓣膜出现衰败或钙化现象,经导管瓣中瓣不居中现象可能会有所加剧。
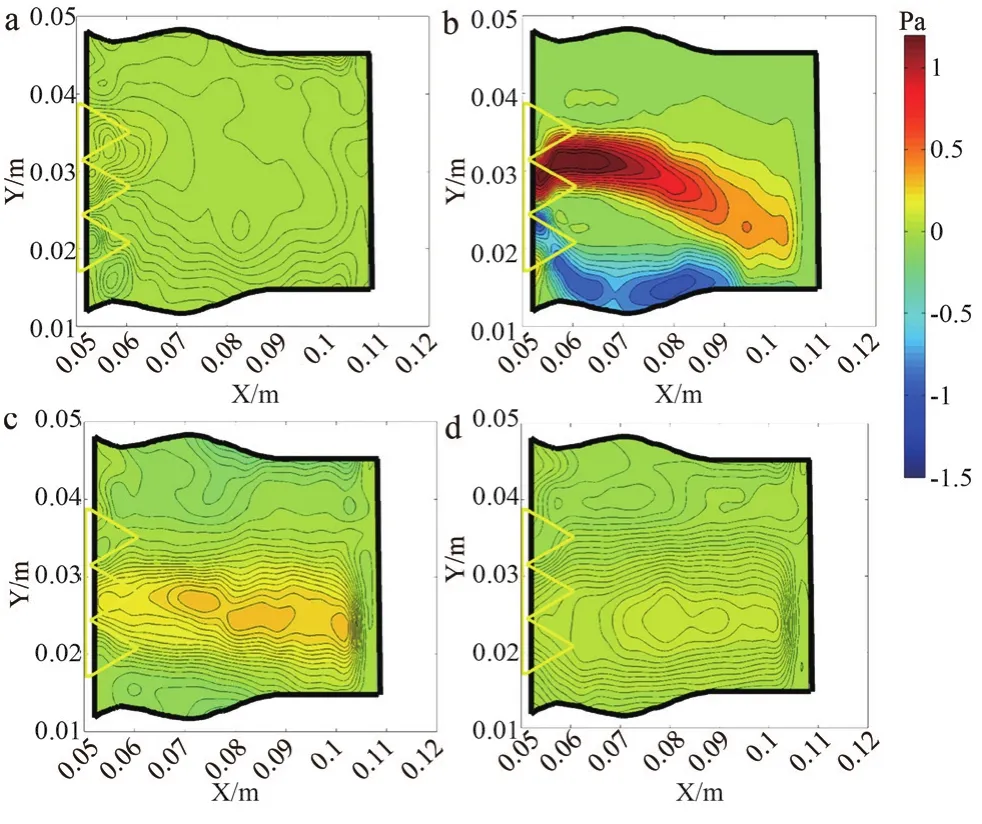
图8 Q=4.0 L/min经导管瓣中瓣的相平均剪应力场和空间平均剪应力场
经导管瓣中瓣和经导管瓣膜相位平均涡量场,见图10~11。涡量Ω相关的速度梯度使用公式(2)计算。负值代表涡量的方向垂直于这个平面和点向外。因此,涡量场在整个周期内的变化类似于剪应力的变化。
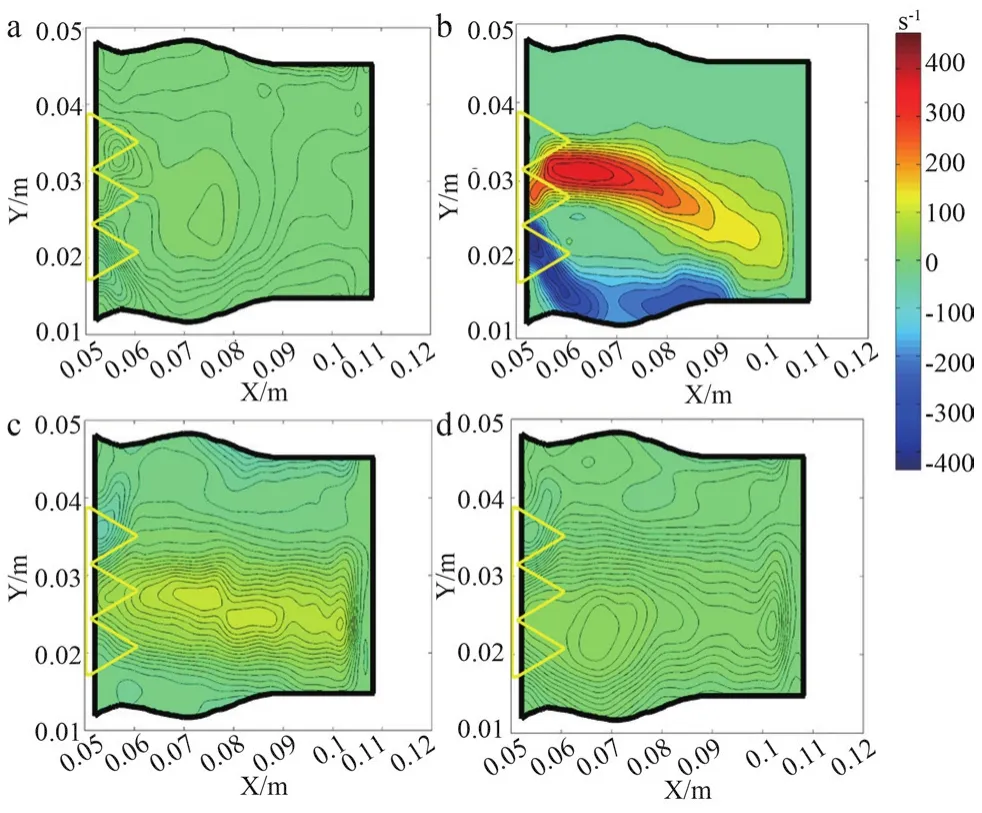
图10 Q=4.0 L/min时经导管瓣中瓣涡量场的相位平均和空间平均

图11 Q=4.0 L/min时经导管瓣膜涡量场的相位平均和空间平均
2.3 瓣后流场动力学评估

此外,涡流和剪应力的结果是由它们相互作用的特定几何形状决定的,即对于扁平的容器壁,其作用结果是增加与壁面之间的摩擦力,而对于在瓣膜附近弯曲的边界,它们会引起反流和气穴现象。因此,将这种对壁面有影响的阈值推广到整个流场也可以作为参考。对于射流,平均剪切应力(Average Shear Stress,TAWSS)的安全阈值约为0.4 Pa[27],而在本次测量中,靠近中心处的剪应力约为靠近壁面处剪应力的6倍(图8~9)(t=9/13T)。将中心区域有害活动对应的阈值涡量估计为公式(3)。

可知,两个瓣膜最大涡量出现在瓣膜下游的中心区域(图10~11)。剪应力的性能决定了血管壁是否会被磨损甚至损坏[26]。因此,瓣膜下游管道内部的上下边界被作为研究剪应力值随流量的变化情况的特定区域。通过采用三个指标进行分析,如式(4)~(6)所示,它们分别是指时间平均剪切应力和振荡剪切指数(Oscillatory Shear Index,OSI),相对停留时间(Relative Residence Time,RRT)。

对于完全单向WSS情况,OSI=0。如果剪切流完全是非定常振荡的,则平均WSS的净量为0,最大OSI=0.5。高OSI的位点容易产生内皮功能障碍和动脉粥样硬化。低TAWSS(低于0.4 Pa)和高RRT(高于10 m2/N)可共同促进动脉粥样硬化,而异常高TAWSS(高于40 Pa)可导致内皮损伤,易增加血栓形成风险[25-28]。通过式(6)估计OSI的安全阈值如公式(7)所示。

得到的两个瓣膜的空间平均指数随流量的变化情况,见图12。对于这两种类型,随着流量的变化,上边界的剪应力大于下边界的剪应力,这是由相对于横截面的不对称安装造成的。在相同流量下,经导管瓣中瓣比经导管瓣膜会产生更高的剪切应力。经导管瓣中瓣包括两组位于同一横截面上的瓣叶,它们在不改变流量的情况下收缩中心射流的横截面,从而导致径向上的速度梯度(对应于较大的壁面剪应力)大于经导管瓣膜单组瓣叶。

图12 TAWSS随流量的变化曲线
OSI表示心动周期中出现螺旋或反流的概率,见图13。对于人体来说,高血压被认为是容易产生内皮功能障碍和动脉粥样硬化的危险因素。随着流量的增加,经导管瓣中瓣的流量变化几乎保持稳定,在4~5 L/min范围内达到最低值。有效开口面积(Effective Opening Area,EOA)和反流量(Qleak)相互独立,共同正影响。随着流量的增加,EOA和Qleak的增长应该会导致经导管瓣中瓣的增长模式,但瓣中瓣的特殊结构抑制了这种变化。同时,下边界的数值比上边界高,这是因为经导管瓣中瓣在上边界比在下边界有更高的剪切应力,有效地减少了流体的停滞和随后的近壁反流。

图13 OSI随流量变化曲线
如图13b所示,经导管瓣膜在低流速下OSI波动显著。达到4 L/min后,有明显下降,降至经导管瓣中瓣水平。Qleak减少和EOA增加共同导致了2~4 L/min和5~7 L/min期间的水位波动。这是因为低Qleak代表低反流百分比(Reflux Percentage,RF),降低了下游壁的流向波动,导致低OSI,而大的EOA使流体向下游流动,携带滞留流体运动,增强了流动的波动性。同时,经导管瓣膜在4~5 L/min期间有一个突然的下降,这是因为在相同的流动周期内,泄漏量的下降幅度大于EOA的增加幅度。下边界高于上边界的原因与经导管瓣中瓣相同。从实验结果可知,经导管瓣中瓣比经导管瓣膜具有更稳定的性能,并且在低流量下表现更安全。
如图14所示,两个瓣膜RRT均低于10 m2/N,说明血流在壁面停留时间较短,发生动脉粥样硬化或血栓形成的风险较低。当流量低于4 L/min时,RRT波动较大,这可归因于和的累积波动。图12~13中的数据表明,低TAWSS和高OSI导致低流量下较大的RRT。它的物理解释是,大量的液体聚集在窦区或瓣叶与瓣壁之间的间隙中,在短的心动周期内很难随着上游流体冲击向下游移动。然而,当流量超过4 L/min时,主流能够在下游壁处输送流体,从而减少流量。同时,随着流量的增加,经导管瓣中瓣比经导管瓣膜更稳定,这是由OSI和TAWSS的变化共同决定的。

图14 RRT随流量变化曲线
3 讨论
目前,国内外评估人工心脏瓣膜体外流体力学性能,主要是参考ISO 5840和GB 12279进行脉动流性能测试。此测试方法未考虑到因原生瓣叶的钙化和组织结构不对称对植入瓣膜形状的改变而影响的预期使用效果,同时,测试未能量化评估到植入瓣膜后的流场状况,不能量化评估人工瓣膜植入后因改变原生瓣膜的流场而导致的潜在溶血或者血栓形成的风险。对于近年来出现的人工心脏瓣膜在瓣中瓣领域的研究,目前能查阅到的关于人工心脏瓣膜“瓣中瓣”的文献和资料主要是各家瓣膜企业的一些临床数据和一些超声影像数据,对于瓣中瓣的体外流体性能测试较少,且没有一个可参考的具体的评判指标。
监管力度的不断加大对高风险的人工心脏瓣膜体外评估也提出了更高的要求。本文结合已上市产品的临床使用情况及主要风险点,以人体真实血流流量及压力波形为基准,构建体外脉动循环系统,采用PIV技术对人工心脏瓣膜下游血管内流场进行重构,在获取运动学信息的基础上引入时间平均壁面剪切应力、震荡剪切指数、相对停留时间等动力学参数,结合瓣膜跨瓣压差、反流百分比等常规临床评价指标,对瓣膜性能进行全面评估,为人工心脏瓣膜临床前的潜在溶血性和血栓形成风险评价提供参考。
本文通过实验验证了经导管瓣中瓣在瓣膜周围和下游具有与经导管瓣膜相似的特征,随着流量的变化,两种类型瓣膜产生的管壁剪应力在释放直径相同的情况下性能上差别不大,经导管瓣中瓣与经导管瓣膜相似的功能,具有良好的血流动力学性能,给瓣中瓣的预期性能评估提供了科学客观的数据支撑。但本试验未考虑瓣膜下游血管因收缩和舒张而带来的直径尺寸变化,也未评估高血压患者的使用情况。因此应根据人体主动脉血管顺应性,结合临床瓣膜使用患者条件,设计和建立更严格的测试方法来科学客观地评估其血流动力学性能。

