菌草“绿洲一号”根际土壤中优势菌株的筛选与菌落PCR鉴定
肖之奇,林占熺
(福建农林大学国家菌草工程技术中心,福州 350002)
【研究意义】菌草是指经过了栽培食药用菌的三级系统筛选法的系统选育之后,可以用于栽培食药用菌的新型草本植物[1]。菌草技术由福建省农林大学菌草研究所林占熺研究员于1987年发明,菌草技术最初用于“以草代木”种植食药用菌[2],即通过使用菌草代替树木作为培育食药用菌的基质,从而缓解当时因培育食药用菌而大量砍伐树木所造成的突出的“菌林矛盾”[3]。菌草技术问世后,立即引起了联合国开发计划署和粮农组织的关注,于1994年被联合国开发计划署列为“中国与其它发展中国家优先合作项目”,之后又于2017年被联合国列为“和平发展基金项目”重点项目向全球推广,为国际减贫事业贡献中国智慧和中国方案[4]。随着时代的发展,目前菌草技术已经广泛运用到生态治理领域,在治理土壤盐碱化的过程中发挥了重要的作用,菌草“绿洲一号”作为近年来选育培养出来的新草种,在治理土壤盐碱化领域得到了越来越广泛的应用。因此,研究菌草“绿洲一号”这种可用于土壤盐碱化治理的新型草种对于盐碱地土壤的改良治理机制具有重要的研究意义,可以为运用生物方法对盐碱地土壤进行改良治理提供新的思路和方法。【前人研究进展】利用菌草“绿洲一号”改良治理盐碱地土壤目前已经取得了一定的研究进展,2013—2017年,福建农林大学国家菌草工程技术中心先后在内蒙古阿拉善、山西运城、河南兰考、山东东营、新疆阜康、和田等地区开展了种植菌草“绿洲一号”治理盐碱地的相关实验研究,均取得了理想的治理成果[5]。相关研究数据表明,菌草“绿洲一号”根系发达、生长迅速、植株富含各类粗蛋白,在治理盐碱地的过程中见效快、效果好[6]。种植菌草“绿洲一号”可以显著增加土壤微生物的数量,从而改善土壤微生物的种群结构,从而从根本上改善盐碱地的土壤理化性质,降低盐碱土壤的盐碱度,使盐碱土壤自身的土壤肥力得到有效恢复[7]。这也是菌草“绿洲一号”改善盐碱土壤的核心机制所在。随着现代分子生物学技术的发展,高通量测序技术在检测和鉴定微生物种群方面发挥着重要的作用,其中以16sDNA高通量测序技术因其具有良好的特异性因而在鉴定微生物种群方面应用最为广泛。16sDNA位于原核细胞核糖体小亚基上,包括10个保守区域(Conserved Regions)和9个高变区域(Hypervariable Regions),其中保守区在细菌间差异不大,高变区具有属或种的特异性,随亲缘关系不同而有一定的差异。因此,16sDNA可以作为揭示生物物种的特征核酸序列,被认为是最适于细菌系统发育和分类鉴定的指标。16sDNA扩增子测序(16sDNA Amplicon Sequencing),通常是选择某个或某几个变异区域,利用保守区设计通用引物进行PCR扩增,然后对高变区进行测序分析和菌种鉴定,16S rDNA扩增子测序技术已成为研究环境样本中微生物群落组成结构的重要手段[8-10]。同时菌落PCR技术也已经广泛的应用于阳性克隆子的鉴定[11]。菌落PCR直接以菌体热解后暴露的DNA作为模板进行PCR扩增,省去了提取细菌菌体DNA等一系列的复杂过程,与传统的先提取细菌菌体DNA而后进行PCR扩增的方法相比,更加省时省力[12],适合菌株的快速批量鉴定。【本研究切入点】目前相关的研究进展仍然停留在初步的数据采集阶段,对菌草“绿洲一号”对于盐碱地土壤微生物种群数量及种群结构的改良具体机制尚不明确。【拟解决的关键问题】本文以菌草“绿洲一号”根际土壤微生物为切入点,通过对菌草“绿洲一号”根际土壤中具有重要生态价值的优势菌株进行分离培养及筛选鉴定,明确菌草“绿洲一号”对盐碱地土壤微生物种群数量及种群结构的改良具体机制。
1 材料与方法
1.1 土壤样品采集
取样地点为福建省福州市国家菌草工程技术中心长江澳盐碱滩涂治理基地(25°31′28.03″N、119°47′46.22″E),菌草“绿洲一号”为两年生成年植株(图1),该基地的土壤类型均为滨海盐碱地土壤。采用五点取样法在毗邻菌草“绿洲一号”种植地段的未种植菌草“绿洲一号”植株且表面无植物生长的空白盐碱地段提取深度为20 cm左右的深层土壤,作为空白组土样;在菌草“绿洲一号”种植地段内挑选植株土壤选取长势较好的“绿洲一号”菌草植株,提取菌草“绿洲一号”植株根际深度为20 cm左右的根际土壤,作为对照组土样(表1)。去除土样中的杂物和大的土块后,将每组土样混合均匀,装入无菌袋中置于-80 ℃冰箱中保存。

表1 土壤样品采集信息

图1 菌草“绿洲一号”植株
1.2 培养基制备
TSB固体培养基:用于菌草“绿洲一号”植株根际土壤中优势菌株的分离培养和筛选纯化。其配方为:胰酪胨17.0 g,氯化钠5.0 g,大豆木瓜蛋白酶消化物3.0 g,磷酸氢二钾2.5 g,葡萄糖(一水合/无水)2.5 g,琼脂20.0 g,pH 7.3±0.2。
LB固体培养基:用于菌草“绿洲一号”植株根际土壤中优势菌株的保存。其配方为:胰蛋白胨10.0 g,酵母提取物5.0 g,氯化钠10.0 g,琼脂15.0 g,pH 7.3±0.2。
1.3 空白组和实验组土壤微生物种群的差异性分析
按照MP Biomedicals Fast DNA土壤样品提取试剂盒的操作说明,提取空白组土样和实验组土样的土壤微生物总DNA,每个组的土壤均提取8个土壤微生物总DNA样本,空白组土样提取的8个土壤微生物总DNA样本编号为:KB1~KB8;实验组土样提取的8个土壤微生物总DNA样本编号为:SY1~SY8。检测合格之后以提取到的土壤微生物总DNA为模板运用PCR技术对细菌的16sDNA片段进行扩增,扩增结束后回收PCR扩增产物并送检。空白组和实验组土壤微生物种群的差异性分析由苏州帕诺米克生物技术有限公司运用16sDNA高通量测序技术进行分析。
1.4 菌草“绿洲一号”根际土壤中优势菌株的分离筛选与纯化
称取保存于-80 ℃的菌草“绿洲一号”植株根际土壤9.0 g,置于经过灭菌处理的250 mL锥形瓶中,加入90 mL生理盐水,配置成10-1浓度梯度的土壤悬浮液。密封后放置于37 ℃、150 r/min的恒温振荡培养箱中振荡120 min,使土壤当中的微生物充分溶解于生理盐水。振荡结束后室温下静置20 min左右,吸取1 mL上清液于2号试管中,加入9 mL生理盐水,稀释成10-2浓度梯度的土壤悬浮液。依此类推,分别吸取1 mL上一浓度梯度土壤悬浮液用生理盐水按照10倍的浓度梯度进行稀释,依次稀释成10-2、10-3、10-4、10-5、10-6、10-7、10-8、10-9浓度梯度的土壤悬浮液[13]。
选取10-4、10-5、10-6、10-74个浓度梯度的土壤悬浮液,用200 μL移液枪吸取100 μL的土壤悬浮液接种于含有灭菌处理的TSB培养基的细菌培养皿,用涂布棒均匀涂抹于TSB培养基表面,每个浓度梯度的土壤悬浮液接种4个培养皿,密封后倒置于37 ℃的恒温培养箱中培养3~6 d左右。将接种环用酒精灯烧红冷却后分别挑取TSB培养基表面长出的白色和黄色单菌落,在经过1×105Pa灭菌20 min处理后的TSB培养基上连续划线,直至TSB培养基表面生长出的菌落全部为白色菌落和黄色菌落为止。
1.5 菌草“绿洲一号”根际土壤中酸杆菌和鞘氨醇单胞菌的菌落PCR鉴定
在无菌的超菌工作台中,用经过灭菌处理的移液枪枪头挑取TSB培养基表面的白色和黄色单菌落,放入装有20 μL无菌双蒸水(ddH2O)的1.5 mL PCR管中,搅拌后不断吹打,使挑取的酸杆菌菌体充分溶于无菌双蒸水(ddH2O)中。而后将装有优势菌株菌液的1.5 mL PCR管盖好管盖置于电磁炉中用沸水持续蒸煮5 min,使优势菌株菌体在加热条件下充分裂解,DNA充分暴露[14]。
以充分裂解的优势菌株菌体DNA为模板,设计优势菌株的特异性引物(酸杆菌上下游引物为Acido-135F:ATACCGCATAACACCTACG,Acido-587R:CCACACTCAAGCCAGATAG,扩增片段长度452 bp; 鞘氨醇单胞菌上下游引物为Sphin-187F:AGCGTTGTTCGGAATTACT, Sphin-403R:CACCTCAGCGTCAATACC, 扩增片段长度216 bp)。PCR反应体系采用20 μL体系:3 μL DNA, 上游下游引物各1 μL,10 μL 2×TaqMaster Mix(内含Taq酶、dNTP、Mg2+),5 μL ddH2O。扩增程序:94 ℃预变性90 s; 94 ℃变性30 s, 50 ℃退火30 s, 72 ℃延伸60 s,进行34个循环;72 ℃延伸4 min。
1.6 优势菌株菌落PCR反应产物的凝胶电泳反应
称取0.4 g凝胶琼脂糖,加入40 mL 1×TAE凝胶电泳缓冲液,煮沸后加入4 μL Glegreen核酸凝胶染料,倒入DNA凝胶多孔制胶器,待冷却形成多孔凝胶板后取出放入电泳槽中备用。
向电泳槽中倒入1×TAE凝胶电泳缓冲液,液面高于凝胶板约1 cm,在凝胶板第一个点样孔中加入5 μL DL2000 DNA Marker试剂、而后将5 μL酸杆菌菌落PCR反应产物与1 μL 6×DNA Loading Buffer试剂(DNA上样缓冲液)在封口膜表面混合均匀后依次加入剩余的点样孔,样品加入完毕后,开始进行电泳。电泳电压120 V,电泳时间30 min,电泳结束后,用凝胶电泳成像系统验证凝胶电泳效果。
2 结果与分析
2.1 空白组和实验组土壤微生物种群的差异性分析
2.1.1 门水平的物种相对丰度差异性分析 由图2可以看出,在门水平上,空白组土样(KB1~KB8)中种群相对丰度较高的变形菌门(Proteobacteria)和厚壁菌门(Firmicutes)在实验组土样(SY1~SY8)中均明显下降。而泉古菌门(Crenarchaeota)、不明细菌(unidentified-Bacteria),放线杆菌门(Actinobacteriota),蓝藻(Cyanobacteria)、拟杆菌门(Bacteroidota),Chloroflexi等菌门的相对丰度变化不大。酸杆菌门(Acidobacteriota)和脱硫菌门(Desulfobacterota)在实验组土样(RS1~RS8)中的相对丰度得到了有效提高。空白组土样(KB1~KB8)中酸杆菌门的物种相对丰度依次为1.0%、0.74%、2.7%、2.0%、2.8%、1.6%、2.3%、2.2%;实验组土样(SY1~SY8)中酸杆菌门的相对丰度依次为5.5%、8.4%、5.0%、6.4%、5.1%、6.1%、6.1%、6.5%;空白组土样(KB1~KB8)中脱硫菌门的物种相对丰度依次为0.1%、0.1%、0.4%、0.3%、0.7%、0.6%、0.8%、0.7%;实验组土样(SY1~SY8)中脱硫菌门的相对丰度依次为3.9%、5.1%、2.2%、1.2%、5.0%、9.5%、3.7%、2.6%;两者的相对丰度均明显提高。
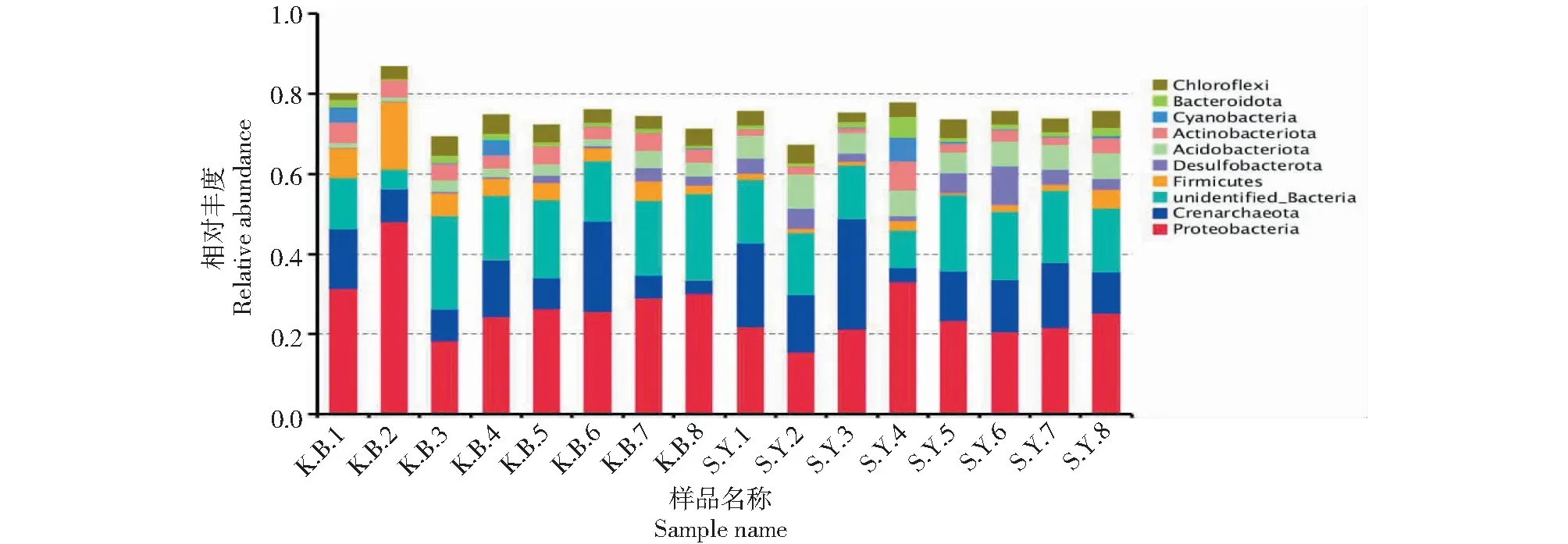
图2 各样本门水平物种相对丰度
由图3可以看出,在门水平上,实验组土样(RS1~RS8)中KD4-96、古菌门(Archaea)、Subgroup-21、bacteriap25、Thermoplasmata、Verrucomicrobiae、脱硫菌门(Desulfuromondia)、Polyangia、酸杆菌门(Acidobacteriae)、Vicinamibacteria和亚硝酸菌门(Nitrososphaeria)的物种聚类要明显高于空白组土样(KB1~KB8)。结合门水平物种相对丰度柱形图和门水平物种聚类热图综合分析,脱硫菌门和酸杆菌门为实验组土样(SY1~SY8)中门水平的优势菌门。
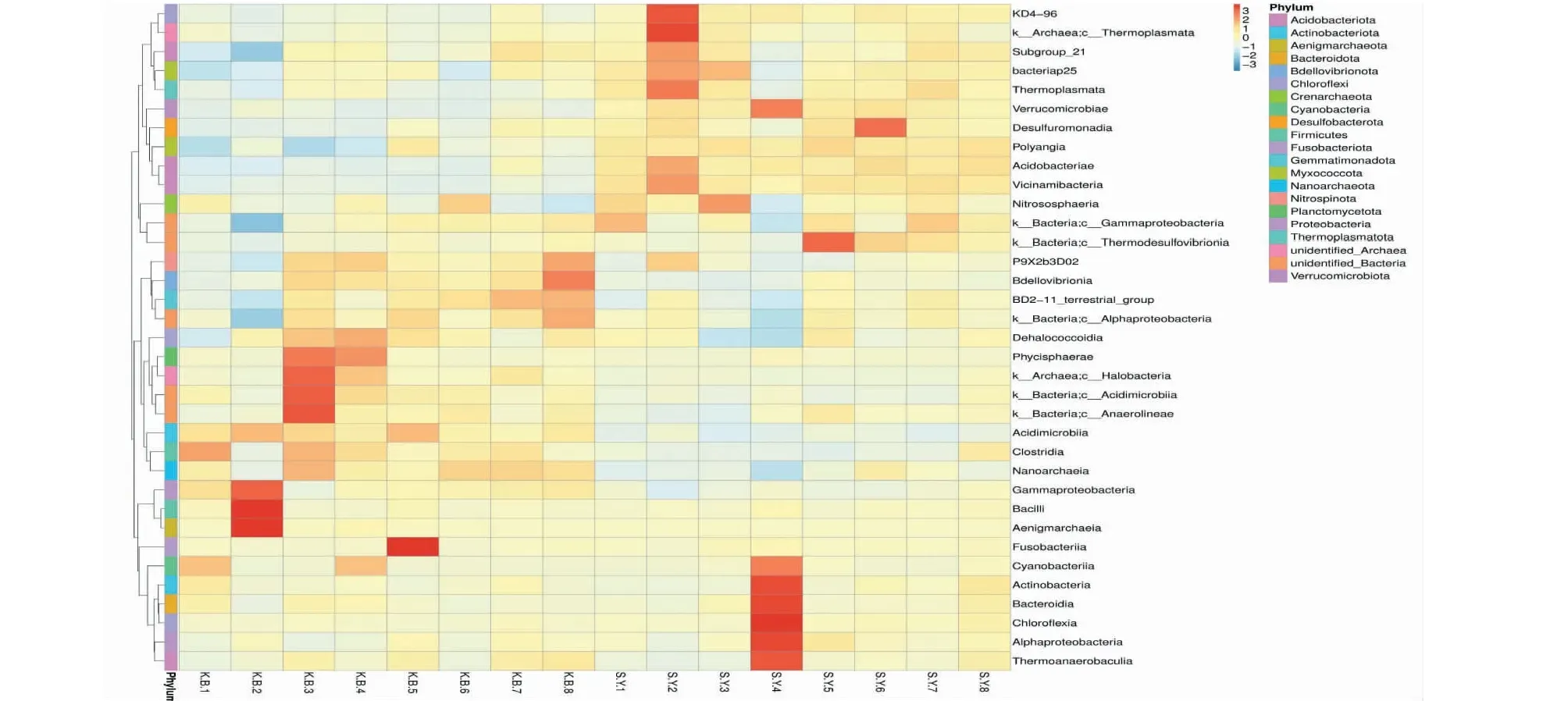
图3 各样本门水平物种聚类热图
2.1.2 目水平的物种相对丰度差异性分析 由图4可以看出,空白组土样(KB1~KB8)和实验组土样(SY1~SY8)各样本之间在目水平的物种相对丰度出现了明显的分化,实验组土样(SY1~SY8)在目水平的物种相对丰度明显要高于空白组土样(KB1~KB8)。在实验组土样(SY1~SY8)中,红螺菌目(Rhodospirillales)、鞘脂单胞菌目(Sphingomonadales)、伯克霍尔德氏菌目(Burkholderiales)的物种相对丰度要明显高于空白组土样(KB1~KB8)。红螺菌目在实验组土样中物种相对丰度依次为4.2%、6.1%、4.4%、3.3%、5.1%、4.4%、5.9%、3.6%;鞘脂单胞菌目在实验组土样中物种相对丰度依次为0.6%、0.6%、0.7%、6.6%、1.4%、0.7%、0.6%、0.9%,在空白组土样KB3~KB5中,鞘脂单胞菌目的物种相对丰度为0,其余各空白组土样的鞘脂单胞菌目的物种相对丰度均极低;伯克霍尔德氏菌目在实验组土样中物种相对丰度依次为6.2%、3.8%、6.3%、10.9%、4.9%、4.8%、5.2%、4.9%。对比空白组土样,实验组土样中红螺菌目、鞘脂单胞菌目、伯克霍尔德氏菌目的物种相对丰度均有提高。
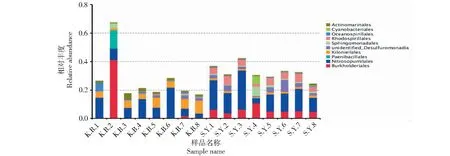
图4 各样本目水平物种相对丰度
由图5可以看出,实验组土样(SY1~SY8)中红螺菌目(Rhodospirillales),根瘤菌目(Rhizobiales),鞘脂单胞菌目(Sphingomonadales),假单胞菌目(Pseudomondales),微球菌目(Micrococcales)的物种聚类要明显高于空白组土样(KB1~KB8)。其中假单胞菌目为常见的致病菌,具有感染性。

图5 各样本目水平物种聚类热图
结合目水平物种相对丰度柱形图和目水平物种聚类热图综合分析,红螺菌目(Rhodospirillales)和鞘脂单胞菌目(Sphingomonadales)为实验组土样(SY1~SY8)中目水平的优势菌目。
2.1.3 科水平的物种相对丰度差异性分析 由图6可以看出,空白组土样(KB1~KB8)和实验组土样(SY1~SY8)各样本之间在科水平的物种相对丰度的差异更加明显。在实验组土样中,磁螺菌科(Magnetospiraceae),鞘氨醇单胞菌科(Sphingomonadaceae),草杆菌科(Oxalobacteraceae),脱硫单胞菌科(Desulfuromonadaceae)的物种相对丰度要明显高于空白组土样(KB1~KB8)。磁螺菌科在实验组土样(SY1~SY8)中物种相对丰度依次为4.0%、5.9%、4.2%、2.0%、4.8%、4.2%、5.7%、3.4%;鞘氨醇单胞菌科在实验组土样(SY1~SY8)中物种相对丰度依次为0.6%、0.5%、0.5%、6.5%、1.4%、0.7%、0.6%、0.9%,在空白组土样KB3~KB6中,鞘氨醇单胞菌科的物种相对丰度为0,其他各样本中鞘氨醇单胞菌科的物种相对丰度均极低;草杆菌科在实验组土样(SY1~SY8)中物种相对丰度依次为0.1%、0.1%、0.3%、7.8%、0.1%、0.3%、0.3%、0.4%,在空白组土样(KB1~KB8)中,草杆菌科的物种相对丰度均为0;脱硫单胞菌科在实验组土样(SY1~SY8)中物种相对丰度依次为2.0%、4.1%、1.2%、0.6%、3.2%、8.1%、2.3%、1.4%。
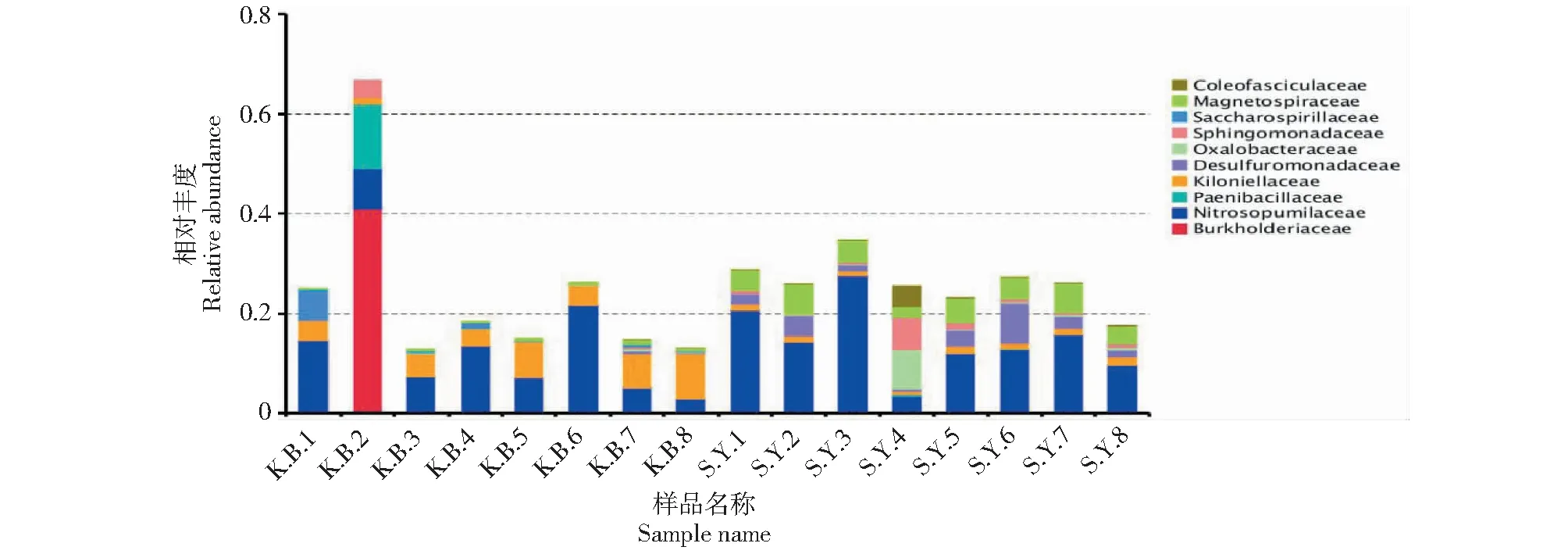
图6 各样本科水平物种相对丰度
由图7可以看出,实验组土样(SY1~SY8)中脱硫单胞菌科(Desulfuromonadaceae),假单胞菌科(Pseudomonadaceae),鞘氨醇单胞菌科(Sphingomonadaceae),硫杆菌科(Acidithiobacillaceae)的物种聚类要明显高于空白组土样(KB1~KB8)。其中假单胞菌科为具有感染能力的致病菌。
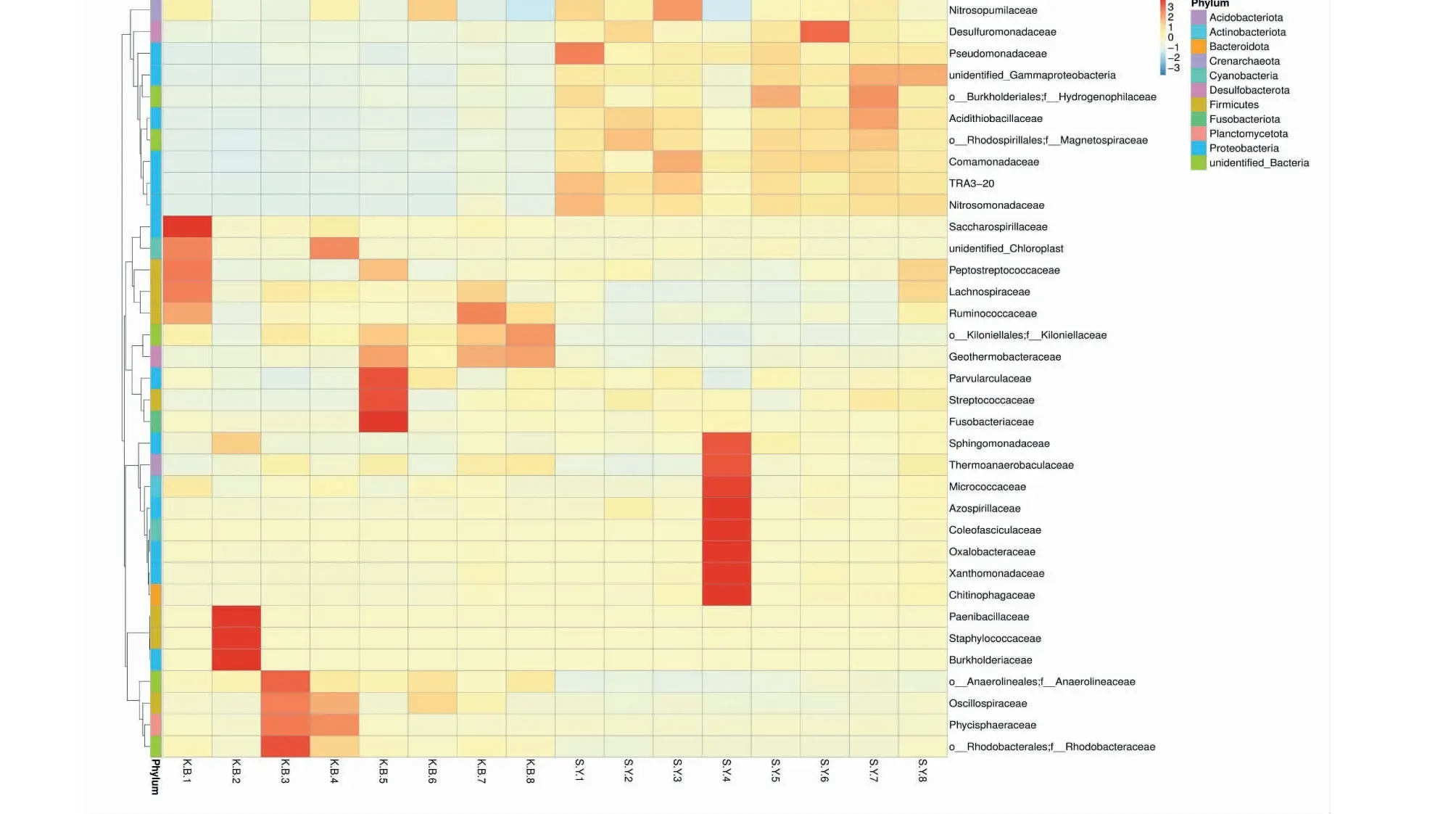
图7 各样本科水平物种聚类热图
结合科水平物种相对丰度柱形图和科水平物种聚类热图综合分析,鞘氨醇单胞菌科(Sphingomonadaceae)和脱硫单胞菌科(Desulfuromonadaceae)为实验组土样(SY1~SY8)中科水平的优势菌科。
2.1.4 属水平的物种相对丰度差异性分析 属水平是公认的可以最有效的鉴定不同菌株的分类水平,各类不同菌株的差异性在属水平上体现得最为明显,通过属水平的种群相对丰度差异性分析,可以快速区分不同菌株之间的差异性。空白组土样(KB1~KB8)和实验组土样(SY1~SY8)各样本之间的物种相对丰度的差异性在属水平上体现得最明显,由图8可以看出,鞘氨醇单胞菌属(Sphingomonas)在实验组土样(SY1~SY8)中的物种相对丰度要高于空白组土样(KB1~KB8)。鞘氨醇单胞菌属(Sphingomonas)在实验组土样(SY1~SY8)中的物种相对丰度依次为0.3%、0.3%、0.3%、5.7%、0.5%、0.5%、0.3%、0.6%。而空白组土样KB3~KB8中的物种相对丰度为0,在其他各空白组样本当中的物种相对丰度均极低。
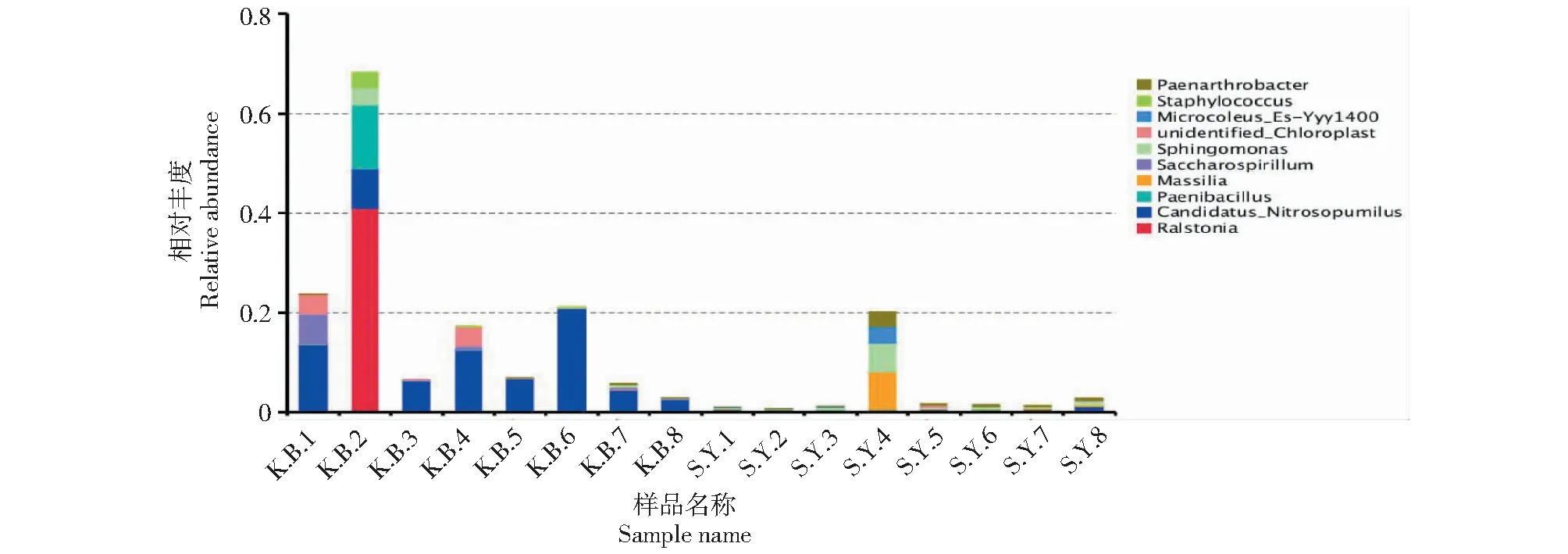
图8 各样本属水平物种相对丰度
由图9可以看出,实验组土样(SY1~SY8)中鞘氨醇单胞菌属(Sphingomonas)和假单胞菌属(Pseudomonas)的物种聚类要明显高于空白组土样(KB1~KB8)。其中假单胞菌属为致病菌。结合属水平物种相对丰度柱形图和属水平物种聚类热图综合分析,鞘氨醇单胞菌属为实验组土样(SY1~SY8)属水平的优势菌属。
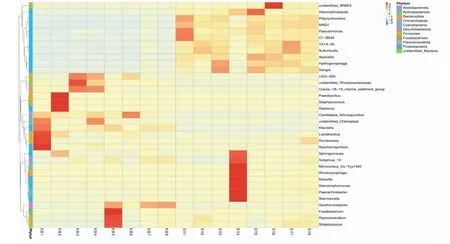
图9 各样本属水平物种聚类热图
2.2 分离培养的目标菌株确定
通过对空白组土样(KB1~KB8)和实验组土样(SY1~SY8)在各分类水平(Phylum、Class、Order、Family、Genus)上的物种相对丰度柱和物种聚类的差异分析,实验组土样(SY1~SY8)中门分类水平的优势菌门为脱硫菌门(Desulfuromondia)和酸杆菌门(Acidobacteriae);目分类水平的优势菌目为红螺菌目(Rhodospirillales)和鞘脂单胞菌目(Sphingomonadales);科分类水平的优势菌科为鞘氨醇单胞菌科(Sphingomonadaceae)和脱硫单胞菌科(Desulfuromonadaceae);属分类水平的优势菌属为鞘氨醇单胞菌属(Sphingomonas);由于假单胞菌为致病菌,不进行分离培养。
2.3 目标菌株菌落PCR反应产物的凝胶电泳分析
从治理土壤盐碱化的生态利用价值和菌株自身的生态作用出发,选择酸杆菌和鞘氨醇单胞菌作为目标菌株进行分离培养。如图10~11所示,酸杆菌菌落PCR目标条带(452 bp)和鞘氨醇单胞菌菌落PCR目标条带(216 bp)清晰明亮,排列整齐,目标条带的长度和分布位置准确。因此,可以确定从菌草“绿洲一号”根际土壤当中分离培养出的目标菌株为酸杆菌和鞘氨醇单胞菌菌株。
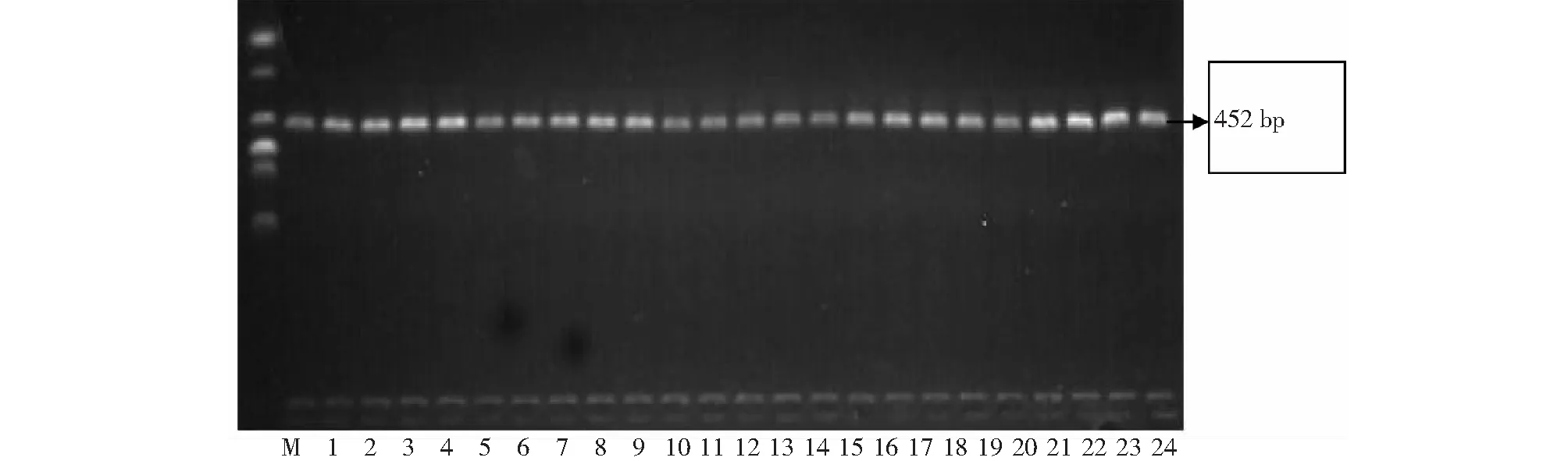
M为DL2000 DNA marker指示条带,1~24为样品扩增结果
3 讨 论
本文通过运用16sDNA高通量测序技术对空白组土样(KB1~KB8)和实验组土样(SY1~SY8)进行微生物种群结构测序,明确了两者在各分类水平(Phylum、Class、Order、Family、Genus)上的物种相对丰度柱和物种聚类的差异,实验组土样(SY1~SY8)中门分类水平的优势菌门为脱硫菌门(Desulfuromondia)和酸杆菌门(Acidobacteriae);目分类水平的优势菌目为红螺菌目(Rhodospirillales)和鞘脂单胞菌目(Sphingomonadales);科分类水平的优势菌科为鞘氨醇单胞菌科(Sphingomonadaceae)和脱硫单胞菌科(Desulfuromonadaceae);属分类水平的优势菌属为鞘氨醇单胞菌属(Sphingomonas)。最终从菌草“绿洲一号”的根际土壤中分离培养出了酸杆菌和鞘氨醇单胞菌这两种具有重要生态作用的目标菌株。
菌草“绿洲一号”作为一种可以有效治理土壤盐碱化的新型草种,其根际土壤当中的酸杆菌丰度较高[15],酸杆菌是近年来新分离出来的细菌,作为嗜酸菌可有效分泌各类胞外酸[16],从而降低土壤盐碱度,在治理土壤盐碱化的过程当中发挥着重要作用[17]。但由于纯化的酸杆菌菌体很难通过人工分离培养获得,因此对于酸杆菌的研究非常稀少[18]。鞘氨醇单胞菌同样也是近年来新分离出来的细菌,虽然作为一种新型的微生物资源,具有高效的芳香有机物降解能力,在环境保护及工业生产方面具有巨大的应用潜力[19]。但由于对鞘氨醇单胞菌的认识较晚,因此对于鞘氨醇单胞菌的研究仍然还停留在初级阶段[20]。

M为DL2000 DNA marker指示条带,1~15为样品扩增结果
盐碱土壤最显著的特征就是土壤盐碱度增加,严重时可导致盐类物质从土壤内部析出覆盖在土壤表层而导致土壤呈现出霜白色。同时还可使土壤颗粒因离子间的相互作用而凝结成块状导致土壤板结[21]。土壤板结会严重破坏土壤的自身结构,导致土壤自身性状的改变[22]。盐碱地土壤最严重的问题除了土壤板结导致自身性状的彻底改变之外,还在于土壤内部微生物种群生态系统的彻底破坏[23]。盐碱地土壤内部微生物种群生态系统被彻底破坏之后,土壤微生物的种群丰度及代谢活动大大减少,导致盐碱地土壤彻底丧失了土壤肥力的内在恢复机制[24]。因此,恢复盐碱地土壤内部的微生物种群生态系统成为了盐碱地土壤修复治理的核心问题[25]。目前盐碱地土壤的修复治理方法主要是物理方法和化学方法,但无论是物理方法还是化学方法,在治理盐碱地土壤的同时也具有严重的副作用,会造成对土壤的二次伤害。因此,运用生物方法选用具有良好的盐碱地土壤改良特性的新型植物对盐碱地土壤进行生物治理成为了未来治理盐碱地土壤的首要选择[26]。
本研究通过选取酸杆菌和鞘氨醇单胞菌物种丰度丰富的菌草“绿洲一号”植株的根际土壤,结合菌落PCR的鉴定方法,成功从菌草“绿洲一号”植株的根际土壤当中分离出了酸杆菌和鞘氨醇单胞菌的纯化菌株,为酸杆菌和鞘氨醇单胞菌的后续研究,尤其是两者的宏基因组学分析和相关菌肥的开发奠定了坚实的理论基础。同时也从侧面印证了菌草“绿洲一号”植株具有良好的盐碱土壤治理作用,为通过生物方法治理盐碱土壤提供了新的方法和思路,具有很好的现实指导意义和应用价值。
4 结 论
相比较于传统的物理和化学治理方法在治理盐碱地的同时需要破坏土壤的物理结构和内部的离子结构而言,运用菌草“绿洲一号”治理盐碱地不需要破坏土壤的物理结构和内部的离子结构,能够有效避免治理过程中对土壤造成的二次伤害;同时能够有效恢复盐碱地土壤内部的微生物种群结构,促进盐碱地土壤肥力的自我恢复,具有更加持续高效的治理效果。因此,运用菌草“绿洲一号”治理盐碱地土壤具有重要的生态应用价值。

