晚期原发性肝癌多学科综合治疗1例报道
原发性肝癌是一种高度侵袭性的恶性肿瘤,癌症相关死亡率排全球第2,其中肝细胞癌(hepatocellular carcinoma,HCC)占85%~90%
。由于HCC起病隐匿,复发率高,早期缺乏典型临床表现,大部分患者确诊时已处于疾病中晚期
。近年来针对HCC的外科治疗、介入治疗、靶向治疗、放射治疗等均取得了显著的进步和发展,但单一的治疗方法已出现“天花板效应”,难以进一步大幅度提高疗效,亟需联合和应用多学科治疗方法来提高疗效
。目前,HCC的治疗模式已从单一的局部治疗转变为包括手术、消融、介入、靶向、免疫治疗等有机结合的多学科综合治疗。南京医科大学第一附属医院(以下简称“我院”)肝胆中心于2014年收治了1例HCC患者,随着病情不断进展,经过多学科协作团队(multidisciplinary team,MDT)讨论后拟采用综合治疗,以期为HCC的综合诊疗模式提供参考。
说到磨课的具体流程,笔者所在教研组总结了“一课多上、一课三磨”的实践流程:(1)基于个人经验独自备课;(2)结合师傅指导进行二次备课;(3)备课组听课、评课;(4)结合修改意见,进行三次备课;(5)教研组听课、评课;(6)撰写教学反思和磨课心得.正所谓“三磨三度、一课三‘劫’”.
1 病例资料
患者,女,45岁。主诉:发现肝脏占位性病变2 d。现病史:患者2 d前于当地医院体检行MRI检查发现肝左叶占位,病程中患者无任何腹痛腹胀等不适主诉。于2003年12月30日经门诊收治入院。既往史:否认高血压、糖尿病、冠心病等病史,既往乙型肝炎病史10余年,未予正规抗病毒治疗,无其他慢性病及传染病史,否认烟酒史。查体:营养良好,皮肤及巩膜无黄染,右上腹深压痛,无腹壁浅表静脉曲张,无腹腔积液。影像学检查:腹部MRI提示左肝可见一6.5 cm×5.0 cm大小的实性占位。
前天晚上,阿花约我在金宜大酒店喝茶。我们坐在一个僻静的包间里。灯光下,阿花的脸蛋像剥了壳的熟鸡蛋,光洁瓷实。阿花穿红衣白裤,佩黄色丝巾,身姿绰约,楚楚动人,如一树桃花开。
2 初次诊疗经过
患者于2004年1月5日于我院行肝左叶+部分左内叶切除术,术后病理提示:肝脏左外叶肝细胞性肝癌,中分化,大小约7.2 cm×4.5 cm×4.5 cm,切缘未见癌组织残留。术后于我院介入科行选择性肝动脉化疗栓塞术(TACE)治疗。2005年11月复查发现肝癌复发,再次行肝部分切除术,术后病理提示:肝细胞性肝癌(复发),中分化型,大小约1.8 cm×1.5 cm×1.5 cm,切缘未见癌组织残留。
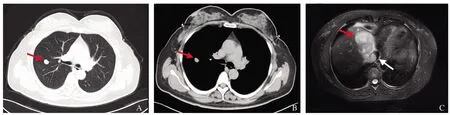
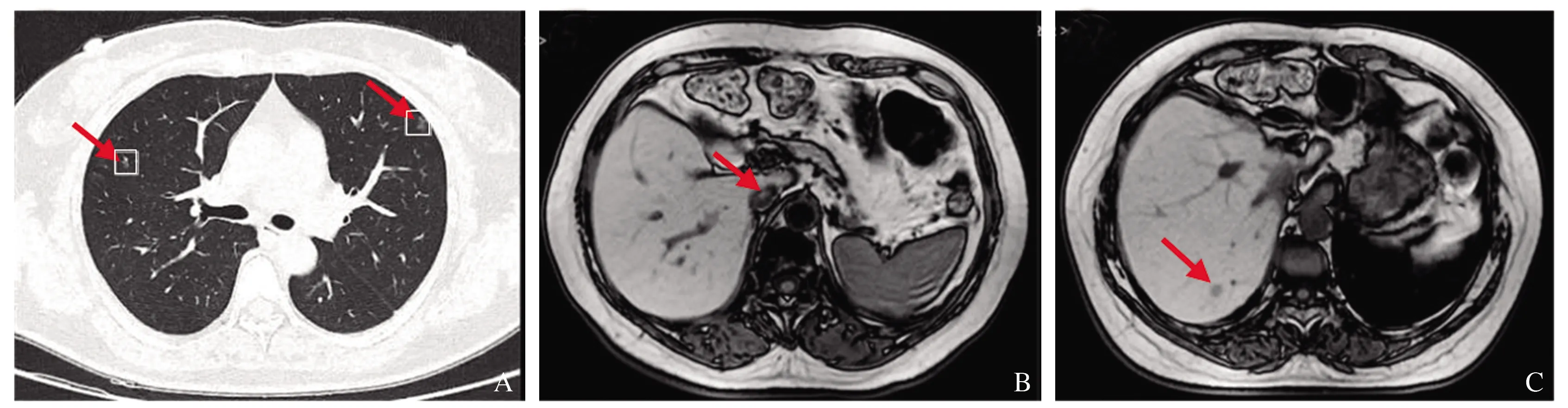
患者出院后定期复查(2014年12月19日):AFP 437.8 ng/ml,CA125 61.2 ng/ml、ALT 23.4 U/L、AST 17.8 U/L、TBil 17.4 μmol/L、Alb 40.2 g/L、HBV-DNA阴性。复查胸部增强CT(2014年12月22日)示:右上肺软组织结节影,考虑转移;肝膈顶不规则软组织影(肝癌)伴右心房、下腔静脉内软组织影,考虑癌栓(见图1A~1B)。腹部MRI(2014年12月23日)示:肝实质内膈顶处一软组织肿块影,大小7.3 cm×5.3 cm,考虑原发性肝癌伴右心房、下腔静脉癌栓形成(见图1C)。
肝切除术仍然是肝癌患者获得长期生存最重要的手段,对于肝功能储备良好的Ⅰa期、Ⅰb期和Ⅱa期肝癌仍是首选手术切除来治疗
。肝切除术要保证肿瘤切除的完整性,同时也要保留足够体积和功能的肝脏,以保证术后肝功能代偿,减少手术并发症、降低手术死亡率
。HCC在肝切除后有40%~70%的患者复发,在早期复发病例中,经常需要积极的联合治疗,但手术切除仍然是肝切除术后复发HCC患者的最佳治疗手段
。而对于晚期肝癌患者,可行综合治疗后对肝癌降期再行手术切除,改善患者预后。手术切除也能在术中结合其他局部治疗措施,降低患者术后复发的概率,提高术后生存率。手术切除在肝癌的治疗中有重要地位。该患者在2004年行根治性肝切除术,在2005年肝癌复发再次手术切除,为患者争取了近10年的无瘤生存期(2005年至2014年),手术切除使患者获得了较为长期的生存时间。
3 MDT讨论
落潮状态下,北水道的潮流自西向东流向烂沙洋深海区域。在落潮初期,北水道的水位高、水深大,潮流流速及水动力较低;随着潮位的不断下落,漫滩的水流顺坡向汇入深槽,且沿着主流方向汇入外海,此时深槽流向与深槽走向一致,浅滩的流向主要受浅滩区坡度影响;在中潮时刻,深槽内部水流流速达到最大(1.41 m/s),深槽的水动力也达到峰值;随着潮位继续下降;工程区域部分浅滩凸出水面,工程海域潮流流速进一步减小。
患者既往HCC病理诊断明确,目前考虑肝癌复发伴下腔静脉癌栓及右肺转移,中国肝癌临床分期为Ⅲb期,无法行根治性手术切除,建议行肝动脉+支气管动脉化疗栓塞术,同时控制肝脏复发病灶和肺部转移灶。我国学者将HCC合并的门静脉癌栓(portal vein tumor thrombus,PVTT)分为4型,Ⅰ型:累及二级上门静脉分支者;Ⅱ型:累及一级门静脉分支者;Ⅲ型:累及门静脉主干者;Ⅳ型:累及肠系膜上静脉、下腔静脉
;患者目前PVTT属于Ⅳ型,建议在TACE的基础上联合靶向和放射治疗。
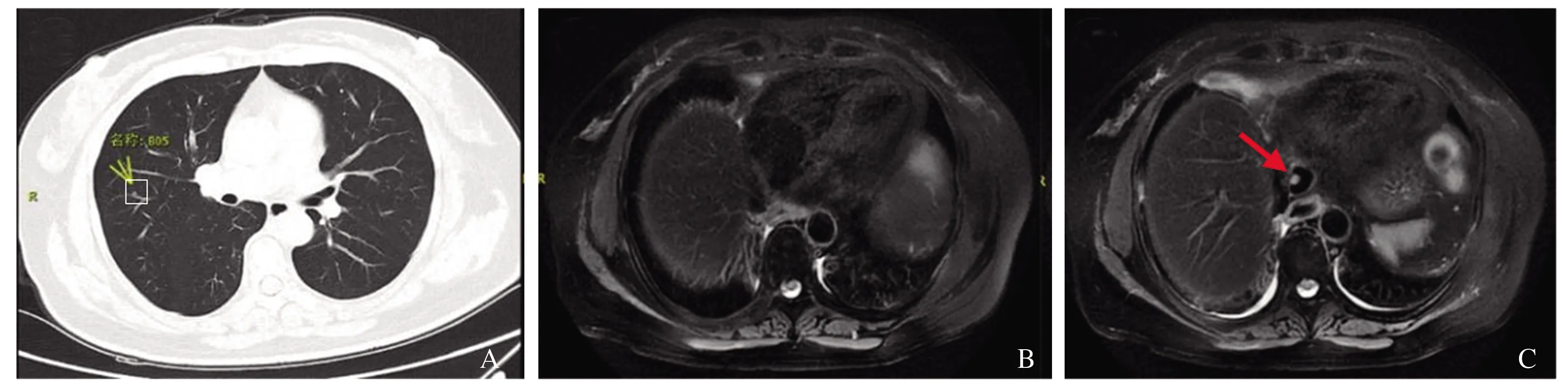
患者出院后继续口服恩替卡韦,行PD-1治疗,2020年10月15日复查胸部CT及腹部MRI未见复发肺部及肝脏活性灶基本消失(见图6)。患者从2014年就诊至今的肝酶及肿瘤标志物检测结果如表1所示。目前仍未出现复发转移,生活质量良好。
胸腹部CT可见肝膈顶部见一不规则软组织影,增强扫描呈不均匀强化,静脉期病变显示更为清晰,右上肺可见一结节影,边缘光滑,增强后可见强化,右心房、下腔静脉可见软组织影,增强可见强化。结合患者既往肝癌手术史,考虑诊断为原发性肝癌伴右心房、下腔静脉癌栓,右上肺结节考虑转移。
HCC的发病率在过去30年中显著上升,我国HCC目前总体5年生存率仅约为12%,高发、难治是其突出特点。70%~80%的肝癌患者在初诊时已为中晚期,失去了手术机会,5年生存率不足20%
。肝癌合并下腔静脉癌栓及两肺转移,可能导致心肺功能衰竭,预后极差
。但在过去的几十年里,很少有治疗方法能有效改善晚期肝癌的预后
。根据中国肝癌分期方案(China Liver Cancer Staging,CNLC),患者在初诊时确诊为Ⅰb期,推荐手术切除治疗,术后患者逐渐进展为Ⅲb期,经本院MDT讨论后决定行术后辅助性TACE+放射治疗+靶向药物治疗+免疫治疗。
4 二次诊疗经过
TACE目前被公认为是肝癌非手术治疗的最常用方法之一
。多项研究证实了TACE在晚期肝癌降期治疗中的作用
,使其从姑息治疗转变为治愈治疗
。自从1983年Yamada等
第1次报道TACE后,TACE已成为不可切除肝癌患者的首选治疗方案
。研究
发现,早期TACE治疗可以用于早期发现及残癌治疗。本例患者在手术后多次行TACE治疗,进一步巩固了手术切除的效果,延长了肿瘤复发的时间。在患者出现肝癌伴双肺转移后行肝动脉+支气管动脉化疗栓塞术,同时阻止了肝脏复发灶和双肺转移灶的发展。
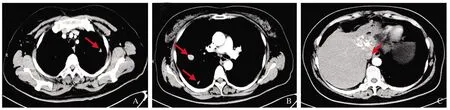
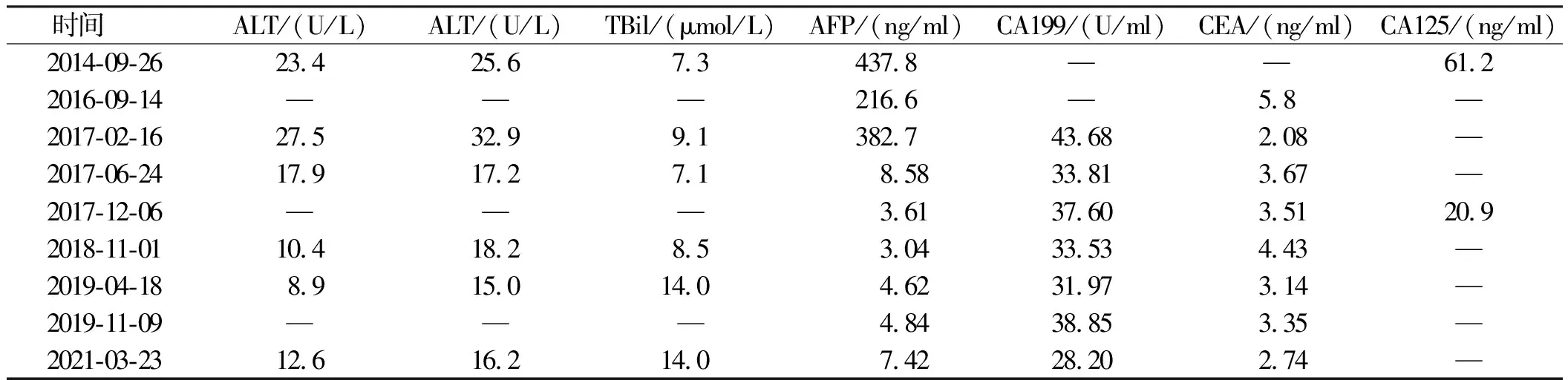
2017年3月开始使用PD-1治疗,静脉注射卡瑞利珠单抗200 mg/次,21 d/次,至今仍在使用PD-1治疗。患者于2018年11月1日复查胸腹部CT及MRI提示肺部转移灶较前明显减小、肝脏活性灶消失,下腔静脉癌栓较前缩小(见图4)。于2019年4月18日复查胸腹部CT及MRI肺部转移灶较前明显减小、下腔静脉癌栓进一步缩小(见图5)。
5 随访
患者目前诊断明确,根据《原发性肝癌诊疗规范(2011年版)》
,患者临床分期为Ⅲb,推荐全身治疗(分子靶向治疗、化疗)、局部治疗(TACE、放疗),该患者可予以TACE联合分子靶向药物及放射治疗。靶向药物建议选择一线索拉菲尼进行治疗。
6 总结和讨论
患者既往乙肝病史,需终身抗乙肝病毒治疗,同时定期检测HBV DNA定量。
The torque dynamic equilibrium equation of the brushless DC motor is
患者既往慢性乙肝病史,既往HCC术后,腹部增强CT和MRI两种影像学结果示肝膈顶占位,同时结合AFP升高,依据《原发性肝癌诊疗规范(2011年版)》
患者目前诊断为原发性肝癌伴下腔静脉癌栓及右肺转移,临床分期为Ⅲb期,考虑失去手术指征,建议行全身治疗。
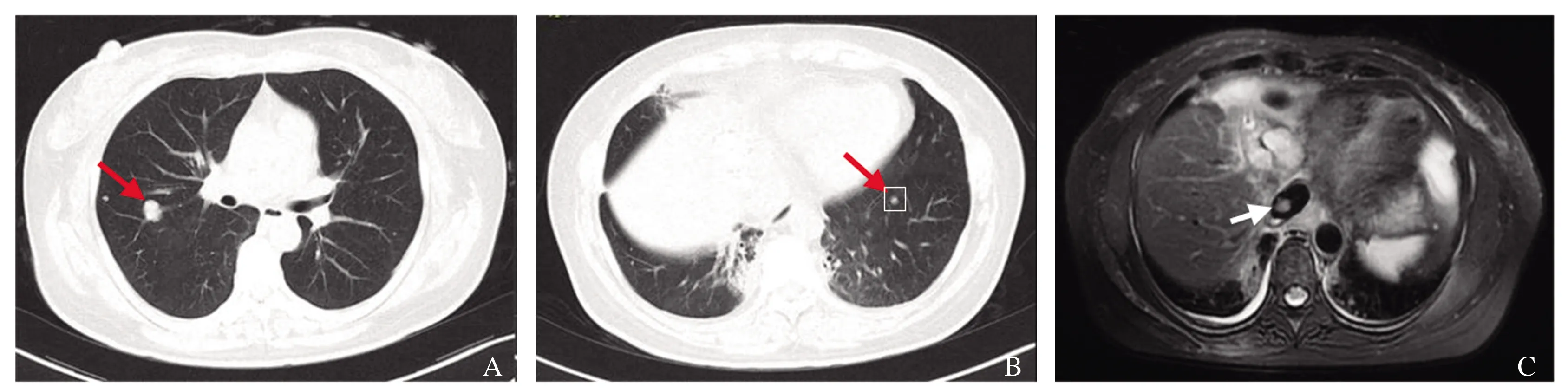
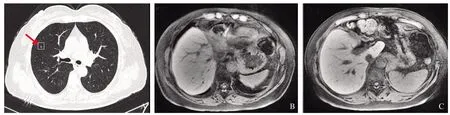
患者于2014年12月29日至2015年2月6日在我院放射科行肝癌姑息性放射治疗。2015年1月至2015年4月口服甲磺酸索拉非尼片0.4 g,2次/d。2015年3月4日、2015年7月31日、2015年10月27日、2015年12月29日、2019年3月5日分别行肝动脉+支气管动脉化疗栓塞术,造影显示肝左叶原有碘油沉积灶周片状肿瘤染色灶,由肝左动脉分支供血,右肺结节状肿瘤染色灶,由右侧支气管动脉分支供血,其供血动脉增粗,血管分支增多紊乱,未见明确动静脉分流征象,诊断为原发性肝癌伴肺转移,以艾达生10 mg和超液化碘油6 ml制备的乳剂8 ml,透视下经微导管缓慢栓塞上述乳剂,见肿瘤内碘油沉积良好,造影显示肿瘤供血动脉闭塞。于腹腔动脉处灌注化疗药物艾达生10 mg、雷替曲赛2 mg。再于右侧支气管动脉肿瘤供血分支灌注化疗药物艾达生20 mg、雷替曲赛2 mg,透视下缓慢栓塞,造影显示右侧支气管动脉肿瘤供血分支闭塞。患者分别于2015年6月23日、2016年9月14日复查胸腹部CT及MRI,提示肺部及肝脏活性灶仍处于进展期(见图2~3)。
对不能手术的HCC伴有门静脉/下腔静脉癌栓患者,指南建议给予外放疗
。李坤等
认为,TACE联合放疗用于不能手术的原发性肝癌,疗效可以得到提高。其机制为:栓塞化疗是可以使抗化疗药物长期滞留在肿瘤中,放、化疗同步,增强放疗敏感性,提高疗效
。本例患者肝癌复发合并下腔静脉及右心房癌栓,予以放射治疗联合TACE,阻止了下腔静脉癌栓的进展。
设计了Z型折叠非稳定光学谐振腔,对N2稀释剂燃烧驱动连续波DF激光器输出光谱特性进行了研究分析.结果表明,相对于He稀释剂,采用N2稀释剂的DF激光输出光谱向长波偏移,波长大于4.0 μm的3P10~3P13谱线有效输出,且各振动能级跃迁谱线为更高转动量子数跃迁谱线.DF激光器输出的各支谱线存在谱带间和谱带内竞争,且竞争表现出中心谱线竞争激烈,边缘谱线向中心谱线转移的趋势.改变燃烧室反应氧化剂过量系数,能够在一定程度上调节DF激光输出谱线分布,在光学参数不变的情况下各单一谱线存在最佳的主反应配比.过量的副燃料主要为满足气动性能需求,在合适范围内变化的副燃料比对输出谱线及分布影响较小.
索拉非尼是一种新型多靶点分子靶向药物,是口服多激酶抑制剂,既能抑制肿瘤生长也能抑制肿瘤血管形成,已被FDA批准用于HCC的一线治疗,能使患者中位生存期显著延长
。索拉菲尼能够有效抑制肿瘤细胞增殖,对血小板源性生长因子和血管内皮生长因子有较强的抑制作用,抗肿瘤作用显著,有较好的临床疗效
。多项研究
显示,TACE联合索拉非尼临床疗效良好,对于延长晚期肝癌合并门静脉癌栓患者的生存时间有益。
免疫治疗是目前最为前沿的一种新型治疗方法,能通过阻断肿瘤细胞的免疫逃逸杀灭肿瘤细胞。而程序性死亡蛋白1(programmed cell death protein 1,PD-1)是一种与免疫功能有关的Ⅰ型跨膜糖蛋白,是CD28/CTLA-4家族T细胞调控器
,在人体免疫细胞和肿瘤细胞中显著表达。目前免疫组化检测PD-1作为HCC的免疫治疗生物学靶点很有前景,PD-1治疗可能成为晚期肝癌患者提高生存率甚至治愈的新的治疗手段
。现有研究
表明,PD-1在乳腺癌、非小细胞肺癌等临床试验中取得了较好的疗效。但针对晚期肝癌的临床研究相对较少。该患者通过持续PD-1治疗,肝脏、下腔静脉及双肺活性灶缩小或消失,复查至今仍未见明显活性灶。免疫检查点抑制剂的出现给晚期肝癌患者带来了新的希望,期待未来免疫检查点抑制剂能够拥有更好的发展。
20世纪90年代美国学者首次提出MDT诊疗模式
,目前MDT诊疗模式已成为了国际肿瘤治疗中最为领先和新型的治疗模式,由于MDT诊疗模式需要极大地综合各个医疗领域的资源,我国肝癌的MDT诊疗模式的建立仍处于萌芽阶段。我国医疗技术和经济的不断发展,医疗体制的深入改革以及信息化时代的到来,均为MDT诊疗模式的发展提供了良好的“土壤”,除了上述治疗方式,目前MDT诊疗模式包括肝移植术、局部消融治疗等多种手段。对于大多数肝癌患者,特别是晚期肝癌患者而言,单一的诊疗模式对于患者预后的改善作用非常局限,MDT诊疗模式的发展是肝癌诊疗的未来趋势,综合多科室诊疗意见,制定更为合理化及个体化的诊疗方案,最大限度地整合医院的诊疗资源,为肝癌患者带来更好的临床结局。本例患者初次就诊,根据《原发性肝癌诊治规范(2019版)》指导选择了手术切除联合TACE,术后肝癌复发,再次行切除治疗。HCC的肝内转移,在保证患者术后剩余肝脏体积和功能良好的前提下,通过手术联合TACE治疗,仍然可以为患者争取较长时间的无瘤生存期及提高患者的生存率,研究
发现,早期肝癌患者可以通过TACE 治疗来发现以及治疗残癌。但由于HCC的高复发率及转移率,患者在术后10年出现肝内转移、下腔静脉癌栓及双肺转移,行肝动脉+支气管动脉化疗栓塞术可同时控制肝脏和双肺转移灶,局部治疗(放射治疗)用于控制肝内转移灶及下腔静脉癌栓,同时联合全身治疗(免疫治疗和靶向治疗)更加有利于晚期肝癌的清除。由此可见,单一的诊疗模式已经不能满足肝癌患者特别是晚期肝癌患者的诊疗需求,MDT诊疗模式出现可以为肝癌患者带来更好的近期疗效和远期生存
。Sinn等
研究发现,MDT诊疗模式可以提高晚期肝癌患者的存活率。MDT诊疗是多个学科共同参与的综合治疗,多个学科互相交流,团结协作,期望能为肝癌患者带来更好的临床效果。目前,对于晚期肝癌的治疗尚无统一标准,单一诊疗模式临床效果不佳,MDT诊疗模式不仅能使肝癌患者收益,也期望能帮助我们在晚期肝癌的诊疗上获得更多的共识。
[1] Sung H, Ferlay J, Siegel RL, et al.Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].CA Cancer J Clin, 2021, 71(3): 209-249.DOI: 10.3322/caac.21660.
[2] Li W, Ni CF.Current status of the combination therapy of transarterial chemoembolization and local ablation for hepatocellular carcinoma[J].Abdom Radiol(NY), 2019, 44(6): 2268-2275.DOI: 10.1007/s00261-019-01943-2.
[3] 中华人民共和国国家卫生健康委员会.原发性肝癌诊疗规范(2019年版)[J].中国临床医学, 2020, 7(1): 5-23.
Bureau of Medical Administration, National Health Commission of the People′s Republic of China.Standardization for diagnosis and treatment of hepatocellular carcinoma(2019 edition)[J].Chinese Journal of Clinical Medicine, 2020, 7(1): 5-23.
[4] Qian K, Zhang F, Allison SK, et al.Image-guided locoregional non-intravascular interventional treatments for hepatocellular carcinoma: current status[J].J Interv Med, 2021, 4(1): 1-7.DOI: 10.1016/j.jimed.2020.10.008.
[5] 樊嘉, 杨欣荣, 王鹏翔.肝癌精准诊疗新进展[J].中国实用外科杂志, 2021, 41(3): 248-252.DOI: 10.19538/j.cjps.issn1005-2208.2021.03.02.
Fan J, Yang XR, Wang PX.New progress in precision diagnosis and treatment of liver cancer[J].Chinese Journal of Practical Surgery,2021, 41(03): 248-252.DOI: 10.19538/j.cjps.issn1005-2208.2021.03.02.
[6] 中华人民共和国卫生部.原发性肝癌诊疗规范(2011年版)[J].临床肝胆病杂志, 2011, 27(11): 1141-1159.DOI: 10.3969/j.issn.1001-5256.2011.11.004.
Ministry of Health of the People′s Republic of China.Diagnosis, management, and treatment of hepatocellular carcinoma(V2011)[J].J Clin Hepatol, 2011, 27(11): 1141-1159.DOI: 10.3969/j.issn.1001-5256.2011.11.004.
[7] 李哲夫, 陈孝平.原发性肝癌并发门静脉癌栓的研究进展[J].齐鲁医学杂志, 2008, 23(2): 182-183, 186.
[8] Bteich F, Di Bisceglie AM.Current and future systemic therapies for hepatocellular carcinoma[J].Gastroenterol Hepatol(N Y), 2019, 15(5): 266-272.PMID: 31360140.
[9] Florman S, Weaver M, Primeaux P, et al.Aggressive resection of hepatocellular carcinoma with right atrial involvement[J].Am Surg, 2009, 75(11): 1104-1108.PMID: 19927515.
[10] Cheng H, Sun G, Chen H, et al.Trends in the treatment of advanced hepatocellular carcinoma: immune checkpoint blockade immunotherapy and related combination therapies[J].Am J Cancer Res, 2019, 9(8): 1536-1545.PMID: 31497341.
[11] Cassinotto C, Nogue E, Morell M, et al.Changing trends in hepatocellular carcinoma management: results from a nationwide database in the last decade[J].Eur J Cancer, 2021, 146: 48-55.DOI: 10.1016/j.ejca.2021.01.009.
[12] Tampaki M, Papatheodoridis GV, Cholongitas E.Intrahepatic recurrence of hepatocellular carcinoma after resection: an update[J].Clin J Gastroenterol, 2021, 14(3): 699-713.DOI: 10.1007/s12328-021-01394-7.
[13] Nahm JH, Lee HS, Kim H, et al.Pathological predictive factors for late recurrence of hepatocellular carcinoma in chronic liver disease[J].Liver Int, 2021, 41(7): 1662-1674.DOI: 10.1111/liv.14835.
[14] He P, Ren E, Chen B, et al.A super-stable homogeneous Lipiodol-hydrophilic chemodrug formulation for treatment of hepatocellular carcinoma[J].Theranostics, 2022, 12(4): 1769-1782.DOI: 10.7150/thno.68456.
[15] Lewandowski RJ, Kulik LM, Riaz A, et al.A comparative analysis of transarterial downstaging for hepatocellular carcinoma: chemoembolization versus radioembolization[J].Am J Transplant, 2009, 9(8): 1920-1928.DOI: 10.1111/j.1600-6143.2009.02695.x.
[16] Kudo M, Han KH, Ye SL, et al.A changing paradigm for the treatment of intermediate-stage hepatocellular carcinoma: asia-pacific primary liver cancer expert consensus statements[J].Liver Cancer, 2020, 9(3): 245-260.DOI: 10.1159/000507370.
[17] Charoenvisal C, Tanaka T, Nishiofuku H, et al.Feasibility and techniques of securing 3D-Safety margin in superselective transarterial chemoembolization to improve local tumor control for small hepatocellular carcinoma: an intend-to-treat analysis[J].Liver Cancer, 2021, 10(1): 63-71.DOI: 10.1159/000512337.
[18] Yamada R, Sato M, Kawabata M, et al.Hepatic artery embolization in 120 patients with unresectable hepatoma[J].Radiology, 1983, 148(2): 397-401.DOI: 10.1148/radiology.148.2.6306721.
[19] Wang Z, Ren Z, Chen Y, et al.Adjuvant transarterial chemoembolization for HBV-related hepatocellular carcinoma after resection: a randomized controlled study[J].Clin Cancer Res, 2018, 24(9): 2074-2081.DOI: 10.1158/1078-0432.CCR-17-2899.
[20] 中国医师协会肝癌专业委员会精确放疗学组, 中国研究型医院学会放射肿瘤学专业委员会肝癌学组, 中国研究型医院学会肿瘤放射生物与多模态诊疗专业委员会, 等.原发性肝癌放射治疗专家共识(2020年版)[J].临床肝胆病杂志, 2021, 37(2): 296-301.DOI: 10.3969/j.issn.1001-5256.2021.02.010.
Precise Radiotherapy Study Group,Chinese Society of Liver Cancer,Chinese Medical Doctor AssociationLiver Cancer Study Group,Committee of Radiation Oncology,Chinese Research Hospital AssociationCommittee of Tumor Radiobiology and Multimodal Imaging and Therapy,Chinese Research Hospital Association, et al.Expert Consensus on Radiotherapy for Primary Liver Cancer(v.2020)[J].J Clin Hepatol,2021, 37(2): 296-301.DOI: 10.3969/j.issn.1001-5256.2021.02.010.
[21] 李坤, 李桂杰, 张建东, 等.肝动脉化疗栓塞联合三维适形放射治疗原发性肝癌的临床疗效[J].中华消化病与影像杂志(电子版), 2013, 3(2): 16-18.DOI: 10.3877/cma.j.issn.2095-2015.2013.02.005.
Li K, Li GJ, Zhang JD, et al.Clinical effect of hepatic arterial chemoembolization combined with three-dimensional conformal radiotherapy for primary hepatocellular carcinoma[J].Chin J Digest Med Imageol(Electronic Edition), 2013, 3(2): 16-18.DOI: 10.3877/cma.j.issn.2095-2015.2013.02.005.
[22] Price TR, Perkins SM, Sandrasegaran K, et al.Evaluation of response after stereotactic body radiotherapy for hepatocellular carcinoma[J].Cancer, 2012, 118(12): 3191-3198.DOI: 10.1002/cncr.26404.
[23] 宋岩.索拉非尼与仑伐替尼肝癌一线治疗之争[J].肝癌电子杂志, 2018, 5(4): 13-15.DOI: 10.3969/j.issn.2095-7815.2018.04.003
[24] Samarin J, Laketa V, Malz M, et al.PI3K/AKT/mTOR-dependent stabilization of oncogenic far-upstream element binding proteins in hepatocellular carcinoma cells[J].Hepatology, 2016, 63(3): 813-826.DOI: 10.1002/hep.28357.
[25] Takano M, Kokudo T, Miyazaki Y, et al.Complete response with sorafenib and transcatheter arterial chemoembolization in unresectable hepatocellular carcinoma[J].World J Gastroenterol, 2016, 22(42): 9445-9450.DOI: 10.3748/wjg.v22.i42.9445.
[26] Zhang X, Wang K, Wang M, et al.Transarterial chemoembolization(TACE)combined with sorafenib versus TACE for hepatocellular carcinoma with portal vein tumor thrombus: a systematic review and meta-analysis[J].Oncotarget, 2017, 8(17): 29416-29427.DOI: 10.18632/oncotarget.15075.
[27] Salmaninejad A, Valilou SF, Shabgah AG, et al.PD-1/PD-L1 pathway: basic biology and role in cancer immunotherapy[J].J Cell Physiol, 2019, 234(10): 16824-16837.DOI: 10.1002/jcp.28358.
[28] Liu B, Song Y, Liu D.Recent development in clinical applications of PD-1 and PD-L1 antibodies for cancer immunotherapy[J].J Hematol Oncol, 2017, 10(1): 174.DOI: 10.1186/s13045-017-0541-9.
[29] Noske A, Ammann JU, Wagner DC, et al.A multicentre analytical comparison study of inter-reader and inter-assay agreement of four programmed death-ligand 1 immunohistochemistry assays for scoring in triple-negative breast cancer[J].Histopathology, 2021, 78(4): 567-577.DOI: 10.1111/his.14254.
[30] Galun D, Mijac D, Filipovic A, et al.Precision medicine for hepatocellular carcinoma: clinical perspective[J].J Pers Med, 2022, 12(2): 149.DOI: 10.3390/jpm12020149.
[31] 罗德, 朱刚, 罗斌, 等.2例肝癌综合降期治疗的MDT讨论[J].中国普外基础与临床杂志, 2020, 27(5): 600-605.DOI: 10.7507/1007-9424.201912064.
Luo D, Zhu G, Luo B, et al.MDT discussion of comprehensive downstaging treatment for 2 cases of liver cancer[J].Chinese Journal of Bases and Clinics in General Surgery, 2020, 27(5): 600-605.DOI: 10.7507/1007-9424.201912064.
[32] Sinn DH, Choi GS, Park HC, et al.Multidisciplinary approach is associated with improved survival of hepatocellular carcinoma patients[J].PLoS One, 2019, 14(1): e0210730.DOI: 10.1371/journal.pone.0210730.

