支持向量机在消化系统疾病诊疗中的应用
支持向量机(support vector machine,SVM)是针对小样本数据分类和回归问题提出的通用机器学习算法,分类性能良好,且随着其理论和应用研究的不断深入和发展,已在多个领域展现出优秀的学习性能和泛化能力,实际应用优势突出。目前,其在临床医学领域的应用研究进展相对较慢,但仍在多种疾病的临床诊断、疾病分型、预后判断等应用中表现明显的优势
。本文将对近年来SVM在消化系统疾病诊疗中的应用状况进行综述,并展望其应用前景。
1 支持向量机的定义及原理
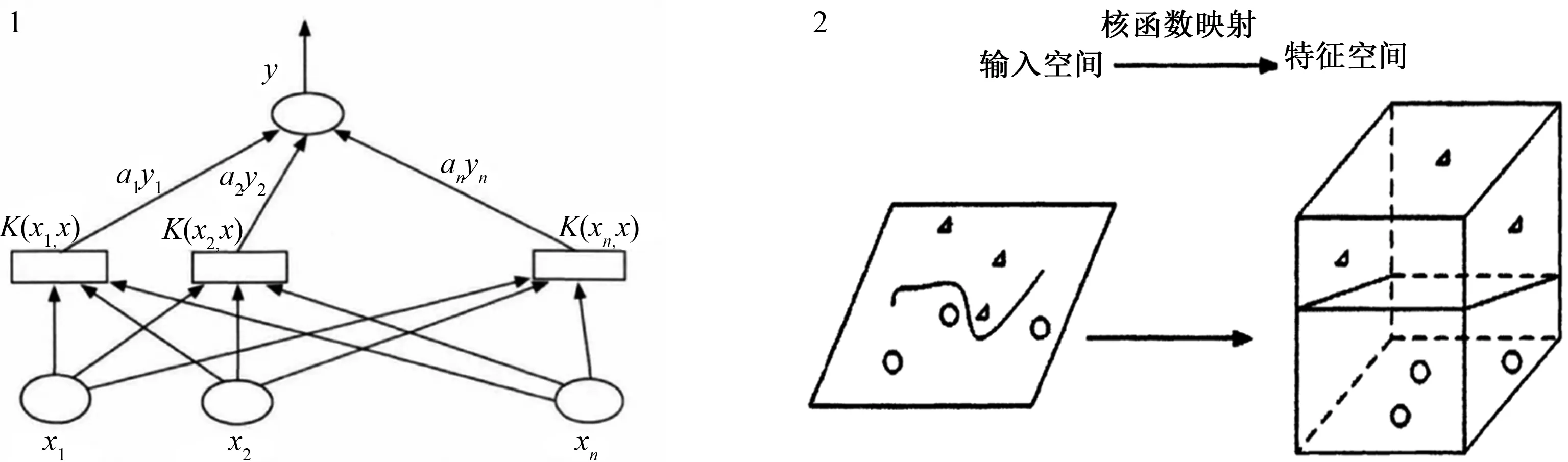
SVM是由Vapnik针对小样本学习问题而提出的一种监督式机器学习算法,它以统计学习理论的VC(Vapnik-chervonenkis)维理论和结构风险最小原理为基础,通过寻找结构化风险最小的路径来增强学习能力,达到在经验风险最小、特定训练样本学习精度最高和无错误识别任意样本能力之间实现最佳平衡,被广泛应用于数据的统计分类和回归分析,在解决小样本、非线性及高维模式识别问题中具有独特优势,泛化能力和分类精准性良好
。
SVM属于二分类模型,基于结构风险最小化原则对服从某个特定分布的数据在二维空间内寻找最佳的分类线性函数,进而有效解决给定数据的二分类问题,而随着核函数的引入,SVM可通过非线性映射将输入向量映射到高维特征空间,寻找和构造最优分类超平面,将复杂的多维分类任务转化成简单的线性可分问题,因此,核函数又被称为SVM的精髓和核心,常用的核函数有高斯核函数、线性核函数、多项式核函数和径向基核函数等
。SVM分类和识别准确性高、泛化能力强,目前已被广泛应用于人脸识别、语音识别、工业制造、交通管理、大数据发掘、图像识别、医疗检测等领域
。
2 SVM在医疗领域的应用
进入21世纪以来,随着计算机技术和大数据技术的飞速发展,针对SVM的研究愈来愈多,聚类SVM、多元分类SVM、转导SVM等多种新型SVM模型相继出现,加上其与基因组学、蛋白质组学、消化内镜、放射影像等有机结合,使其应用领域更加广泛,分类性能愈加优良,在疾病的预测、辅助诊断及预后评估、新药研发、健康管理、医学图像识别等方面表现突出,在消化系统疾病的早期预测、实时诊断及病情判断及治疗效果及预后预测方面同样显示出明显的优势。
针对以往传统的设计对象,主要围绕平面表达方式展开,数据大都通过离散形式在不同图纸和数据表格中得以体现,在开展实际工作时,需要在这些图纸和表格中提取数据,这无疑会增加工作压力。基于此,如果将设计过程中的表达对象转换成三维形式,集中整合这些离散的数据,构建统一的工作数据流,实现数据处理的无缝对接,进而减少数据提取工作的压力。
冯忠园等
基于T2WI影像组学方法,通过建立SVM和逻辑回归两种模型用于探讨其鉴别HCC和肝内胆管细胞癌(intrahepatic cholangiocarcinoma,ICC)的价值,通过逻辑回归降维最终筛选出用于描述区域形状的2个特征及用于描述纹理的5个特征,通过智能SVM平台分析结果显示:SVM对HCC和ICC鉴别的
值为0.861,灵敏度、准确度和特异度分别为0.800、0.777、0.571,结果显示基于T2WI 图像构建的智能影像组学模型能有效鉴别HCC和ICC,提高诊断准确率;刘桐桐
基于常规灰阶超声图像,通过留一法使用SVM模型对原发性肝细胞癌(primary hepatic carcinoma,PHC)患者的微血管侵犯指标和肿瘤分化等级进行预测,结果显示,肝脏的常规灰阶超声图像和微血管侵犯指标和肿瘤分化之间有相关性,SVM模型预测图像中微血管侵犯指标和肿瘤分化的
分别为0.76和0.89,表明使用SVM技术对PHC的灰阶超声图像的微血管侵犯指标和肿瘤分化进行预测有助于患者的术前诊断和预后预测;有研究
对肝脏MR图像的感兴趣区域利用Lloyd算法进行量化和压缩后,使用局部二值模式和灰度共生矩阵方法提取包括对比度、能量、相关性、熵和逆间隙特征等图像纹理的微观和宏观特征,而后针对提取的20个特征使用SVM模型对MR图像进行分类,结果显示,对正常肝组织、早期肝硬化及进展期肝硬化的识别诊断准确度分别为100%、96.3%及92.6%,表明该SVM模型能够准确识别诊断肝硬化并对其进行分级;王进等
曾对154例(其中训练集106例、验证集48例)直肠癌患者术前高分辨T2WI图像进行手动勾画病灶感兴趣区域并提取其影像组学特征后,采用LASSO算法对提取的1 029个特征进行降维选择有价值的病理分期特征,最终获得通过SVM模型分析结果显示验证集的
、灵敏度及特异度分别为0.730、73.1%和66.7%,提示基于MRI高分辨T2WI的影像组学SVM模型有助于判断结肠癌浸润深度,对用于判断其术前T分期,作为直肠癌患者术前评估的有效手段;Ou等
从食管鳞状细胞癌患者的增强CT图像的495个特征中提取出最典型的包括病变形状、强度特征和纹理特征在内的8个代表性特征,并将高斯核SVM与所选的放射性特征相结合构建非线性分类器,对178例食管鳞状细胞癌患者的诊断
为0.79,表现出较好的诊断效能。
近年来,多种临床新成像设备和技术相继问世,不仅大幅度缩短了影像检查扫描时间,降低了辐射剂量,图像质量也得到极大提高,更将疾病的诊断从形态学逐步转向生理学及功能学,对疾病进行综合评估,在脂肪肝、肝硬化、胰腺炎、肝胆肿瘤、消化道肿瘤等多种消化系统常见病的诊断中表现突出,而基于放射影像学的二维灰度图像,使用SVM算法提取、计算和分析病变组织与周边组织的差异,可进一步提高疾病的诊断准确度,减少临床漏诊、误诊。
消化内镜可以使医师直观获得消化道内部的实时影像,利于多种消化道疾病的早期发现和病变组织的活检取材,极大地提高了食管炎、食管癌、胃癌、肠息肉、结肠癌等多种胃肠道疾病的诊断准确性,但由于目前我国先进内镜资源分布不均、内镜医师经验不足和水平差异,加上部分病变如早期胃癌、早期食管癌、扁平型肠息肉等病变组织与周边黏膜差异较小,导致该类病变的漏诊率及误诊率较高,如何有效克服内镜及医师的差异对病变诊断带来的不利影响已成为临床研究热点,而消化内镜与SVM的有效结合可为解决上述问题提供一种方案。
在工程建设和施工中,施工方存在欺瞒工程资料的问题,如材料质保单、抽检报告单不符合实际情况,上述问题对工程监理工作造成了较为明显的影响,无法第一时间发现工程的安全和质量问题,使得监理工作无法充分发挥其作用和价值。这一问题不仅阻碍了监理工作的正常开展,也威胁了工程的综合性能。
张萍萍等
通过检测156例胃癌患者及150例消化道良性病变患者和健康体检者血清中11种肿瘤和炎性标志物的含量,并应用BP算法和SVM算法分别建立胃癌的辅助诊断模型,使用40例患者验证其诊断效果,最终筛选出包括CEA、CA153、CA199和C反应蛋白在内的9种标志物,结果显示基于SVM算法模型的诊断准确率、灵敏性、特异性明显优于BP算法模型(90%
82
、95
85
、85
80%),提示SVM诊断模型对胃癌的早期预测及诊断准确率较高,有重要的临床参考价值;白晶等
通过单项及联合检测甲胎蛋白(alpha fetal protein, AFP)、脱-γ-羟基凝血酶原(Des-gamma-carboxy prothrombin, DCP)和高尔基体蛋白73(Golgi pritein 73, GP73)在健康人、慢性乙型肝炎、乙型肝炎病毒(hepatitis B virus, HBV)相关性肝硬化及HBV相关性肝细胞癌(hepatocellular carcinoma, HCC)患者血清中的表达水平来对其在HBV相关性HCC中的诊断价值进行探讨,并以此构建SVM鉴别诊断模型对肝病的不同阶段进行诊断与识别,结果显示基于AFP、DCP、GP73的SVM模型可用于不同阶段肝病的诊断与识别,为HBV相关性HCC的诊断提供依据;Zheng等
使用基于最小冗余、最大相关性、最小绝对收缩的SVM选择算子对100例HCC和216例非HCC患者血液样本中的基因表达特性进行识别分析,将mRMR和Lasso两种特征选择算法与SVM分类模型相结合,识别癌性和非癌性样本中的特征基因,最终确认22个基因标记在HCC和非癌样本的分类中表现良好,所有样本的识别受试者工作特征曲线下面积(area under curve,
)为0.94,且在AFP阴性样本中
仍为0.93,显示出基于血液基因组学的SVM算法模型在HCC识别与诊断中的突出优势;Chen等
使用SVM模型识别分析胃癌组织中lncRNA的表达特征,对归一化的数据采用主成分分析算法和前向选择算法进行特征选择,最终从12 727个lncRNA中筛选出16个特征lncRNA,在此基础上的SVM模型在训练数据中的诊断
及95
为0.976(0.952~0.999),且验证数据的
及95
为0.950(0.889~0.999),表现出明显的诊断优势,而在十二指肠腺癌的基因组学研究中,Liu等
对十二指肠腺癌、家族性腺瘤性息肉病及正常人的基因表达差异进行功能富集分析,最终基于筛选出的177个基因设计SVM分类模型,验证结果显示分类错误率为零,表明该SVM模型可在转录水平对家族性腺瘤性息肉病患者进行癌症风险预测。
徐文铭等
使用基于像素的RGB颜色空间特征提取方法对消化道出血胶囊内镜图像进行特征提取,并使用SVM集成软件LIBSVM进行分析,结果显示基于线性核函数和多项式核函数的SVM模型诊断准确度均达到80%以上,显示出SVM算法良好的诊断效能;张黎明等
分别使用SVM模型及Logistic回归模型预测结肠腺瘤高级别上皮内瘤变的发生情况,最终确定与其发生相关的12个因素中的2个因素(即病变发生部位及病变大小)有统计学意义,通过反复训练和验证,结果发现相较于Logistic回归模型,SVM模型的预测平均准确度、灵敏度和特异度均较高,显示出SVM预测模型对结肠腺瘤发生高级别上皮内瘤变具有较好的预测效果;而Kominami等
使用基于结直肠腺瘤性息肉表面微结构特征的SVM算法模型创建的实时内镜诊断系统,对118个息肉性病变的识别准确度为94.9%,在88个直径<0.5 cm的微小息肉的识别准确度为93.3%,且对73个腺瘤性息肉进行组织学判断准确度达到93.0%,极大地提高了结直肠腺瘤性息肉的识别与诊断准确性;Kanesaka等
对早期胃癌的放大NBI图片中的不规则微血管应用灰度共生矩阵建立早期胃癌变异特性参数,使用8灰度共生矩阵从早癌病变微血管图像中建立P和Q特性向量,并使用SVM模型对其进行识别分析,结果显示:在61幅癌症图像和20幅非癌症图像的诊断准确性为96.3%,灵敏度为98.3%,特异度为95%,诊断优势明显;Ogawa等
也发现采用SVM进行客观评价,有助于基于色差的早期胃癌诊断;Zhang等
从153例胰腺癌患者超声内镜图片的感兴趣区域提取纹理特征后,在特征选择中引入多重分形维数向量,并采用序列正向选择进行特征筛选,最终从69种纹理特征中确定22种代表性特征,并以此建立SVM预测模型,通过反复训练和验证,结果显示胰腺癌分类准确度高达99.07%,表明该模型可以提高超声内镜诊断胰腺癌的准确性。
近年来,基因组学及蛋白组学研究在医疗领域发展迅速,在多种疾病的预测、诊断、病情及预后判断方面表现突出,但因应用组学方法进行疾病诊疗时,需要检测及观察的指标较多,人工筛选和计算量较大,一定程度上限制了组学方法的应用,而随着人工智能技术的不断发展,以SVW为代表的机器学习方法与组学方法进行有机融合可联合发挥二者在疾病诊疗中的突出优势,在乙肝、非酒精性脂肪性肝病、肝癌、胃癌等多种消化系统疾病的诊疗中得到了良好的应用。
第三,加快推进重大水利工程建设。在着力抓好农村饮水安全、防洪薄弱环节建设、小型农田水利等民生水利建设的同时,加大组织协调力度,稳步推进南水北调东、中线后续工程前期论证和西线工程前期工作,加快滇中引水、引江济淮、珠三角水资源配置、黑龙江三江连通、吉林西部河湖连通等重大引调水和水系连通工程,西江大藤峡、淮河出山店、黄河古贤等控制性枢纽工程,新建大型灌区工程等前期工作,促进工程尽早开工建设。继续推进进一步治理淮河、太湖水环境综合治理等大江大河大湖治理,实施黑龙江、松花江、嫩江干流灾后治理,加快长江、淮河、海河等流域重要蓄滞洪区建设。
李琳等
通过收集386例PHC切除术后患者的临床资料,使用SVM递归特征消除方法和5折交叉验证方法对临床变量进行重要特征排序以确定最优特征子集,并构建患者术后1年、3年无瘤生存期和总体生存率的列线图,最终从34个临床特征中筛选出肿瘤大小及个数、淋巴结转移、脉管侵犯、腹水等指标可明显影响患者术后生存率,患者3年无瘤生存风险和总生存风险的列线图的一致性指数分别为0.701和0.706,提示使用多类SVM递归特征消除方法可提高术后模型预测的准确率;Perakakis等
使用递归特征消除算法对非酒精性脂肪肝及正常人血清中的29类脂质、激素和聚糖进行处理去除冗余特征,最终获得一组包含多种卵磷脂、鞘磷脂、磷脂酸胆碱、磷脂酸乙醇胺片段及酯联素和聚糖片段2592在内的10种脂质、激素和多聚糖组合,并结合使用OvS-SVM模型分析判断患者是否存在非酒精性脂肪性肝炎或肝纤维化,结果显示其对正常人、非酒精性脂肪性肝炎及肝纤维化患者的区分
分别为0.97、0.85及0.97,而由5种脂质组成的组合对肝纤维化的识别灵敏度及特异度可达到97%和99%,表现出极高的诊断准确度,说明该方法可用于非酒精性脂肪性肝病的辅助诊断;Jiang等
通过SVM算法分析肿瘤免疫微环境生物标志物,即肿瘤边缘区域的CD3细胞、CD8细胞、CD66b细胞、肿瘤中央的CD45RO细胞及肿瘤组织的CD34细胞、骨膜蛋白含量、环氧合酶2活性等指标,来预测肿瘤细胞对化疗的灵敏度,进而提高对Ⅱ期及Ⅲ期胃癌患者生存和辅助化疗获益的预测准确度,证实该SVM模型可预测生存期,并有潜力识别Ⅱ期和Ⅲ期胃癌受益于辅助化疗的患者;Saito等
基于苏木精和伊红染色标本的数字病理图像,采用线性和径向基核函数核SVM方法对肝癌切除术后的早期复发进行学习和递推分析预测,预测准确性可达到89.9%,说明数字病理学和SVM的应用可以用于肝癌手术切除后复发,特别是早期复发的高度准确预测。
受自然和人类工程活动的综合作用,乐山市境内地质灾害种类发育较齐全、数量多,但分布不均,且具突发性及不可预见性。地质灾害种类以滑坡、崩塌(危岩)为主,其次为潜在不稳定斜坡、泥石流、地面塌陷(地面裂缝)。其中滑坡约占50%,崩塌约占30%,潜在不稳定斜坡、泥石流、地面塌陷、地裂缝等地质灾害约占20%。
3 总结及展望
SVM是一种优良的新颖小样本学习的机器学习方法,在解决小样本、非线性及高维模式识别问题中具有许多特有的优势,可与多种辅助检查手段相结合,在多种消化系统疾病的预测、诊断及预后判断表现出明显优势,且近年来其在其理论与算法及应用研究方面取得了长足的进步,但在应用研究方面仍比较滞后,限制了其在医疗领域的广泛应用,随着SBM算法及函数的深入研究和扩展及相关软件不断地开发和应用,相信SVM在临床医学领域的应用会更广泛,可为更多疾病的早期诊断、病情预测、后期预防、高危人群筛查等提供更为可靠的依据。
[1] 张会杰, 李恒芬, 李湘露.支持向量机在临床医学中的应用研究进展[J].神经疾病与精神卫生, 2017, 17(11): 812-815.DOI: 10.3969/j.issn.1009-6574.2017.11.013.
Zhang HJ, Li HF, Li XL.Application advances of support vector machine in the clinical medicine[J].Neurological Diseases and Mental Health, 2017, 17(11): 812-815.DOI: 10.3969/j.issn.1009-6574.2017.11.013.
[2] Noble WS.What is a support vector machine?[J].Nat Biotechnol, 2006, 24(12): 1565-1567.DOI: 10.1038/nbt1206-1565.
[3] Cervantes J, Garcia-Lamont F, Rodríguez-Mazahua L, et al.A comprehensive survey on support vector machine classification: applications, challenges and trends[J].Neurocomputing, 2020: 408.DOI: 10.1016/j.neucom.2019.10.118.
[4] Huang S, Cai N, Pacheco PP, et al.Applications of support vector machine(SVM)learning in cancer genomics[J].Cancer Genomics Proteomics, 2018, 15(1): 41-51.DOI: 10.21873/cgp.20063.
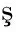
[6] 温宗良.支持向量机在中医临床诊断中的研究进展[J].江苏中医药, 2012, 44(4): 73-75.DOI: 10.3969/j.issn.1672-397X.2012.04.046.
[7] 兰欣.机器学习算法在医疗领域中的应用[J].医疗卫生装备, 2019, 40(3): 93-97.DOI: 10.19745/j.1003-8868.2019076.
Lan X.Application of machine learning algorithm in medical field[J].Chinese Medical Equipment Journal, 2019, 40(3): 93-97.DOI: 10.19745/j.1003-8868.2019076.
[8] Jain V, Jain A, Chauhan A, et al.American Sign Language recognition using Support Vector Machine and Convolutional Neural Network[J].Int J Inf Technol, 2021, 13(3): 1193-1200.DOI: 10.1007/s41870-021-00617-x.
[9] Steardo L, Carbone EA, de Filippis R, et al.Application of support vector machine on fMRI data as biomarkers in schizophrenia diagnosis: a systematic review[J].Front Psychiatry, 2020, 11: 588.DOI: 10.3389/fpsyt.2020.00588.
[10] 张泽瑞, 陈杰, 宋楚平.支持向量机在物品智能推荐中的应用[J].现代计算机, 2020,(31): 19-22.DOI: 10.3969/j.issn.1007-1423.2020.31.003.
Zhang ZR, Chen J, Song CP.Application of support vector machine in item intelligent recommendation[J].Modern Computer, 2020,(31): 19-22.DOI: 10.3969/j.issn.1007-1423.2020.31.003.
[11] 张萍萍, 张建华, 尹咪咪.血清标记物检测结合智能算法在胃癌诊断中的应用[J].郑州大学学报(医学版), 2016, 51(2): 196-200.DOI: 10.13705/j.issn.1671-6825.2016.02.015.
Zhang PP, Zhang JH, Yin MM.Application of serum marker detection combined with intelligence algo-rithm in diagnosis of gastric cancer[J].Journal of Zhengzhou University(Medical Sciences), 2016, 51(2): 196-200.DOI: 10.13705/j.issn.1671-6825.2016.02.015.
[12] 白晶, 刘海顺, 万鸿飞, 等.乙型肝炎相关性肝癌血清标志物诊断价值及支持向量机鉴别诊断模型的建立[J].中国医学装备, 2019, 16(7): 119-125.DOI: 10.3969/J.ISSN.1672-8270.2019.07.029.
Bai J, Liu HS, Wan HF, et al.The diagnostic value of serum biomarkers of hepatitis B-related HCC and the establishment of differential diagnosis model of SVM[J].China Medical Equipment, 2019, 16(7): 119-125.DOI: 10.3969/J.ISSN.1672-8270.2019.07.029.
[13] Zheng J, Zhu MY, Wu F, et al.A blood-based 22-gene expression signature for hepatocellular carcinoma identification[J].Ann Transl Med, 2020, 8(5): 195.DOI: 10.21037/atm.2020.01.93.
[14] Chen T, Zhang C, Liu Y, et al.A gastric cancer lncRNAs model for MSI and survival prediction based on support vector machine[J].BMC Genomics, 2019, 20(1): 846.DOI: 10.1186/s12864-019-6135-x.
[15] Liu W, Dong J, Ma S, et al.A support vector machine model predicting the risk of duodenal cancer in patients with familial adenomatous polyposis at the transcript levels[J].Biomed Res Int, 2020, 2020: 5807295.DOI: 10.1155/2020/5807295.
[16] 徐文铭, 颜国正, 王志武, 等.一种基于SVM的胶囊内窥镜出血智能识别方法[J].中国医疗器械杂志, 2015, 39(1): 9-12.DOI: 10.3969/j.issn.1671-7104.2015.01.05.
Xu WM, Yan GZ, Wang ZW, et al.A method for bleeding detection in endoscopy images using SVM[J].Chinese Journal of Medical Instrumentation, 2015, 39(1): 9-12.DOI: 10.3969/j.issn.1671-7104.2015.01.05.
[17] 张黎明, 刘玉兰, 康晓平.支持向量机预测结肠腺瘤高级别上皮内瘤变效果研究[J].中国实用内科杂志, 2013, 33(11): 872-875.
Zhang LM, Liu YL, Kang XP.Comparison the prediction effect of colon adenoma high grade intraepithelial neoplasia by support vector machine and logistic regression analysis[J].Chinese Journal of Practical Internal Medicine, 2013, 33(11): 872-875.
[18] Kominami Y, Yoshida S, Tanaka S, et al.Computer-aided diagnosis of colorectal polyp histology by using a real-time image recognition system and narrow-band imaging magnifying colonoscopy[J].Gastrointest Endosc, 2016, 83(3): 643-649.DOI: 10.1016/j.gie.2015.08.004.
[19] Kanesaka T, Lee TC, Uedo N, et al.Computer-aided diagnosis for identifying and delineating early gastric cancers in magnifying narrow-band imaging[J].Gastrointest Endosc, 2018, 87(5): 1339-1344.DOI: 10.1016/j.gie.2017.11.029.
[20] Ogawa R, Nishikawa J, Hideura E, et al.Objective assessment of the utility of chromoendoscopy with a support vector machine[J].J Gastrointest Cancer, 2019, 50(3): 386-391.DOI: 10.1007/s12029-018-0083-6.
[21] Zhang MM, Yang H, Jin ZD, et al.Differential diagnosis of pancreatic cancer from normal tissue with digital imaging processing and pattern recognition based on a support vector machine of EUS images[J].Gastrointest Endosc, 2010, 72(5): 978-985.DOI: 10.1016/j.gie.2010.06.042.
[22] 冯忠园, 叶靖.基于T2WI影像组学鉴别肝细胞癌与肝内胆管细胞癌的研究[J].临床医学研究与实践, 2020, 5(22): 1-4.DOI: 10.19347/j.cnki.2096-1413.202022001.
Feng ZY, Ye J.Study on the identification of hepatocarcinoma and intrahepatic cholangiocarcinoma based on T2WI radiomics[J].Clinical Research and Practice, 2020, 5(22): 1-4.DOI: 10.19347/j.cnki.2096-1413.202022001.
[23] 刘桐桐.基于影像组学方法的原发性肝细胞癌微血管侵犯和肿瘤分化等级预测[J].中国医学计算机成像杂志, 2018, 24(1): 83-87.DOI: 10.3969/j.issn.1006-5741.2018.01.017.
Liu TT.Prediction of microvascular invasion and hepatocellular carcinoma by ultrasound based on radiomics approach[J].Chin Comput Med Imag, 2018, 24(1): 83-87.DOI: 10.3969/j.issn.1006-5741.2018.01.017.
[24] Chunmei X, Mei H, Yan Z, et al.Diagnostic method of liver cirrhosis based on MR image texture feature extraction and classification algorithm[J].J Med Syst, 2019, 44(1): 11.DOI: 10.1007/s10916-019-1508-x.
[25] 王进, 李智慧, 沈浮, 等.基于高分辨T2WI的影像组学对直肠癌术前分期的应用价值[J].放射学实践, 2019, 34(11): 1251-1254.DOI: 10.13609/j.cnki.1000-0313.2019.11.016.
Wang J, Li ZH, Shen F, et al.The value of high resolution T2WI-based radiomics in the preoperative staging of rectal cancer[J].Radiology Practice, 2019, 34(11): 1251-1254.DOI: 10.13609/j.cnki.1000-0313.2019.11.016.
[26] Ou J, Li R, Zeng R, et al.CT radiomic features for predicting resectability of oesophageal squamous cell carcinoma as given by feature analysis: a case control study[J].Cancer Imaging, 2019, 19(1): 66.DOI: 10.1186/s40644-019-0254-0.
[27] 李琳, 杨日东, 王哲, 等.基于多类支持向量机递归特征消除方法特征选择的原发性肝癌患者预后预测[J].生物医学工程研究, 2019, 38(1): 32-36.DOI: 10.19529/j.cnki.1672-6278.2019.01.07.
Li L, Yang RD, Wang Z, et al.Prognosis prediction of hepatocellular carcinoma patients based on recursive feature elimination based on multiple support vector machine feature selection[J].Journal of Biomedical Engineering Research, 2019, 38(1): 32-36.DOI: 10.19529/j.cnki.1672-6278.2019.01.07.
[28] Perakakis N, Polyzos SA, Yazdani A, et al.Non-invasive diagnosis of non-alcoholic steatohepatitis and fibrosis with the use of omics and supervised learning: a proof of concept study[J].Metabolism, 2019, 101: 154005.DOI: 10.1016/j.metabol.2019.154005.
[29] Jiang Y, Xie J, Huang W, et al.Tumor immune microenvironment and chemosensitivity signature for predicting response to chemotherapy in gastric cancer[J].Cancer Immunol Res, 2019, 7(12): 2065-2073.DOI: 10.1158/2326-6066.CIR-19-0311.
[30] Saito A, Toyoda H, Kobayashi M, et al.Prediction of early recurrence of hepatocellular carcinoma after resection using digital pathology images assessed by machine learning[J].Modern Pathol, 2020, 34(2): 417-425.DOI: 10.1038/s41379-020-00671-z.

