大肠侧向发育型肿瘤合并息肉的临床特征及其癌变分析
大肠侧向发育型肿瘤(laterally spreading tumor,LST)是指直径10 mm以上、沿肠黏膜表面侧向扩展而非垂直生长的表浅型病变,最初由日本学者Kudo
发现并报道。LST是大肠癌的一种癌前病变,组织病理学以腺瘤为主,具有特殊的形态特征及较其他隆起性腺瘤高的恶性潜能,在数年内即可发展为癌,甚至有部分病灶在初次发现时就已癌变
。然而,结肠镜检查发现LST时往往不是独立存在的,经常可以发现合并息肉样隆起,目前国内外已有部分文献对LST内镜下形态学类型、部位大小、组织学类型等与其恶变的相关关系进行了研究
,也有对LST与息肉共存现象的描述
,但尚缺乏针对LST合并息肉的临床特征以及对其癌变的影响分析,因此,本研究通过对武汉大学人民医院近几年收治的LST患者合并息肉的临床病理特征和内镜下表现进行对比分析,探讨其与LST恶变的关系。
对于多星行星机构行星架上同一组行星轮更多,太阳轮与齿圈之间的安装、调整空间更大,因此,同心条件变得更宽松,即
1 资料与方法
选取2017年1月1日至2020年8月1日在武汉大学人民医院消化内镜中心经内镜检查诊断并接受内镜黏膜下剥离术(endoscopic mucosal dissection,ESD)治疗的大肠LST患者132例,所有的病变都由经验丰富的内镜医师识别和登记。LST的诊断标准依据2008年日本京都举行的多个国家共同参与的多学科研讨会关于非息肉样肿瘤的专家共识
。该研究征得患者知情同意,并签署相关手术、治疗知情同意书。纳入标准:(1)位于结直肠呈侧向扩展,而非垂直生长的浅表型肿瘤病变;(2)肿瘤直径≥10 mm;(3)临床、病理资料完整。排除标准:(1)家族性腺瘤性息肉病(familial adenomatous polyposis,FAP)患者;(2)炎症性肠病(inflammatory bowel disease,IBD)患者;(3)遗传性非息肉病性结直肠癌(hereditary nonpolyposis colorectal cancer,HNPCC)患者;(4)既往有结直肠肿瘤手术史者;(5)肠道清洁度为3级,即肠道准备不满意,肠腔有粪便残渣或粪块,影响内镜下黏膜观察者
;(6)临床和病理资料不完整者。
根据内镜检查下是否合并息肉将132例LST患者分为合并息肉组和不合并息肉组,整理记录两组患者的人口统计学资料(性别、年龄),调取132例患者的内镜及病理报告,请2位有10年以上工作经验的内镜医师重新阅片,记录病灶内镜下表现,主要包括LST的形态学类型、大小、部位、是否合并息肉样隆起、合并息肉的相对部位、合并息肉的数目、合并息肉的大小、合并息肉的组织病理学类型等,分析是否合并息肉与LST癌变的相关性,利用Logistic回归进行单因素和多因素分析,分析合并息肉组LST癌变的相关危险因素。
1.2.1 内镜检查及LST形态分型:根据结肠镜下LST的表面形态,分为颗粒型LST(granular type,LST-Gs)和非颗粒型LST(non-granular type,LST-NGs),前者又分为颗粒均一型(homogenous type,LST-GH)和结节混合型(mixed type,LST-GM),后者分为扁平隆起型(flat elevated type,LST-F)和假凹陷型(pseudo depressed,LST-D)
。
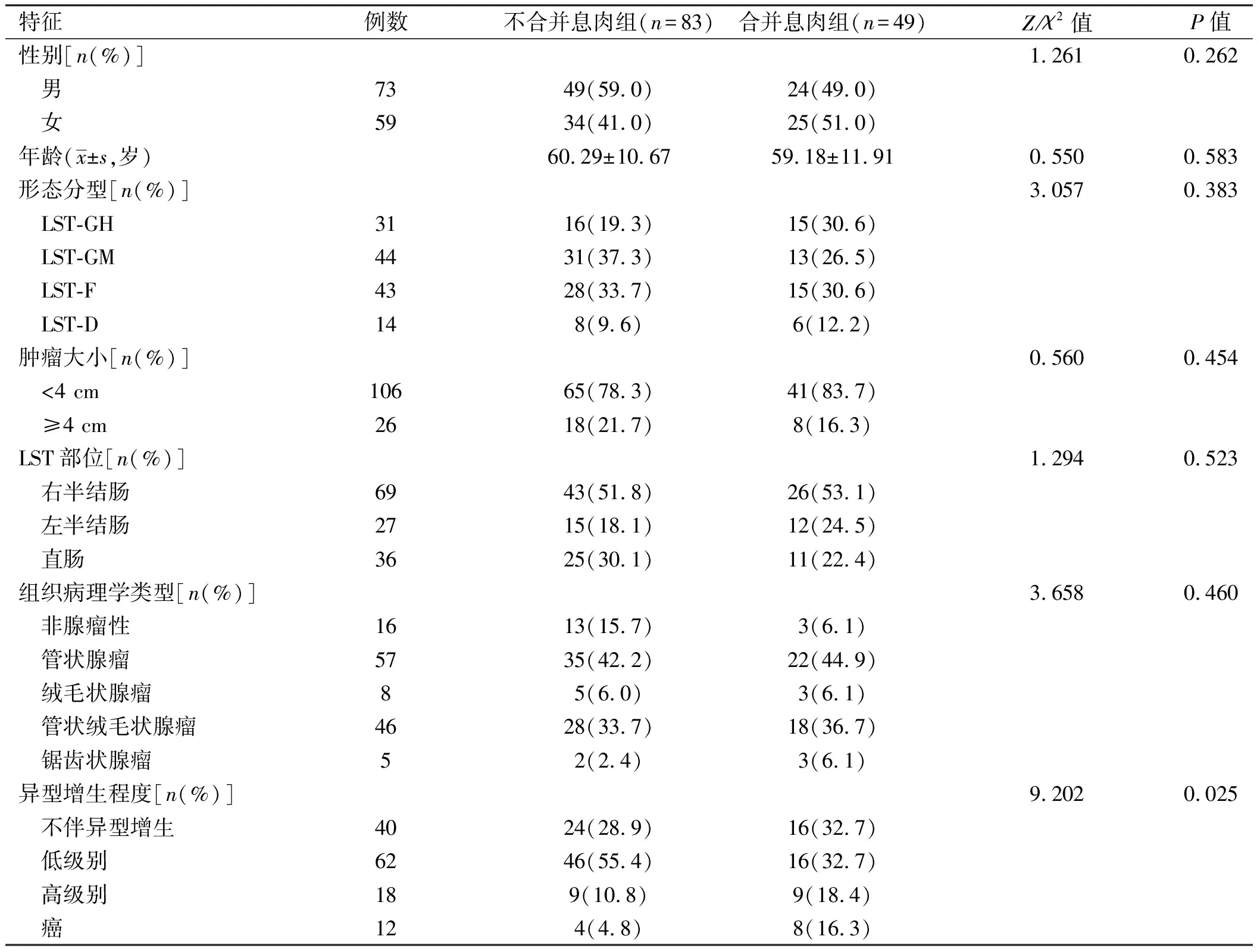
本研究将合并息肉的LST组与不合并息肉组进行对比研究发现,两组在年龄、性别、LST形态分型、LST的部位、肿瘤大小和组织病理学类型上差异均无统计学意义。合并息肉的LST患者中女性所占比例较高(51.0%),年龄为(59.18±11.91)岁,但年龄分布范围较广(24~86岁),最小仅24岁,且为LST伴高级别上皮内瘤变患者,因此,对于合并息肉的LST患者,无论年龄大小,均应引起重视。
武夷山民族地区属于贫困地区,这一地区的地形地貌使得这一地区很难发展迅速。山区的自然地理特征主要表现为地表崎岖不平,自然条件不如平原地区好,发展比平原地区要慢。这一地区的交通条件差、信息不畅通,交通是一个城市得以迅速发展的关键,但山区的条件有限,使武夷山地区的交通很难获得像平原地区那样的发展。武夷山地区的城市化虽然在“量”上有较大的提升,但是“质”的优化却还有待提升。
合并息肉组49例,男24例(49.0%),女25例(51.0%),年龄(59.18±11.91)岁(24~86岁);不合并息肉组 83例,男49例(59.0%),女34例(41.0%),年龄(60.29±10.67)岁(33~89)岁;两组在年龄、性别、LST的部位、形态分型、肿瘤大小和组织病理学类型上差异均无统计学意义(
>0.05),统计结果显示,合并息肉组中LST最大径多在4 cm以下(83.7%),且多位于右半结肠(53.1%),组织病理学类型以管状腺瘤(44.9%)和管状绒毛状腺瘤(36.7%)为主。两组伴异型增生的程度比较,差异有统计学意义(
=0.025),合并息肉组中LST伴癌变的概率(16.3%)显著高于不合并息肉组(4.8%)(见表1)。合并息肉是LST为恶性类型的危险因素(
=2
861,95
:1
242~6
590,
=0.014)。
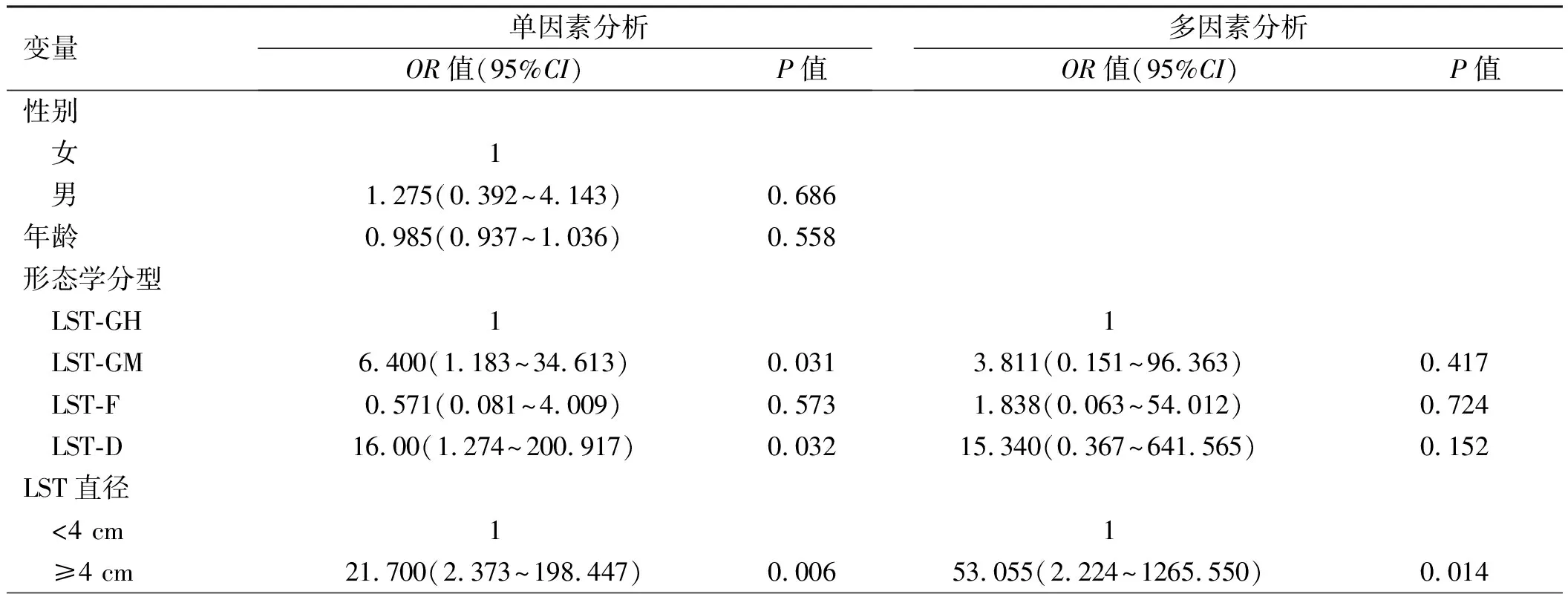
将合并息肉组中LST患者的一般资料、内镜下表现及合并息肉的特征对其癌变的影响分别进行单因素Logistic回归分析,发现LST病变是假凹陷型、结节混合型、直径≥4 cm、位于直肠、息肉≥1 cm是发生恶变的危险因素,进一步多因素Logistic回归分析结果显示,LST直径≥4 cm、合并息肉≥1 cm是病变恶变的独立预测因素(见表2)。
1.2.4 LST的组织病理学类型包括非腺瘤性、腺瘤性伴或不伴有异型增生。其中非腺瘤性包括炎性、增生性、幼年性息肉等,腺瘤性又包括管状腺瘤、绒毛状腺瘤、管状绒毛状腺瘤和锯齿状腺瘤。本研究将伴有高级别上皮内瘤变、黏膜内癌及黏膜下浸润癌定义为恶性类型,而非腺瘤性、腺瘤不伴异型增生和伴有低级上皮内瘤变被定义为良性类型。
合并的结直肠息肉大多直径<1 cm且根据内镜下判断属于炎性增生性息肉,这部分息肉在切除后未进行组织病理学检查,另部分息肉在切除后送检病理,回报为增生性或腺瘤性。因此,综合内镜下息肉直观特点与病理结果,将合并息肉分为增生性息肉和腺瘤性息肉(管状腺瘤、绒毛状腺瘤、绒毛管状腺瘤)。

2 结果
1.2.2 LST的部位:根据病变距肛门外缘的距离以及其所在肠腔的形态来判断,分为右侧结肠、左侧结肠和直肠,右侧结肠包括回盲部、升结肠、肝曲和横结肠,左侧结肠包括脾曲、降结肠和乙状结肠。
推荐理由:十九大以来,我国水环境治理工作迈入新的历史发展阶段。本书全面系统地总结了近20年以来我国河道治理过程中的经验和成绩,并以杭州市为例,形成了杭州特色的水环境治理理论和技术体系,应用新技术、新方法,建立全国示范工程。本书案例丰富、新颖,图文并茂。正因为杭州市在水环境治理方面一直引领全国,本书旨在更大范围内共享先进治水理念与经验。
1.2.3 LST大小:测量切除后标本的长、宽、高,根据病灶最大径将病变分为直径<4 cm组和直径≥4 cm组。
文学是人学。蒙古史诗《罕哈冉惠传》属于民间文学范畴。因此,我们不仅要从宗教的视角,还更应从文学的视角审视评判这部史诗。作品中主人公哈冉惠这一形象所表现出来的文学审美价值,应当是研究者们关注的焦点之一。有些研究者在分析哈冉惠的艺术形象时,紧紧抓住以下两句诗文:
结直肠癌是临床常见的消化道恶性肿瘤之一,根据2018年国际癌症研究署发布的全球恶性肿瘤估计统计数据,结直肠癌的发病率在男性和女性中均居世界第三,是导致癌症死亡的第二大主要原因,而我国结直肠癌的发病率和死亡率均位居前列,且随着饮食习惯及生活方式的改变有逐年上升的趋势
。结直肠癌早期筛查和控制危险因素对于提高结直肠癌患者的5年生存率具有重要意义
。
3 讨论
132例LST患者均采用ESD治疗,术中均未见明显出血,2例术后迟发性出血内镜钛夹止血(2/132,1.5%),4例切除标本水平切缘阳性,1例垂直和水平切缘均为阳性(5/132,3.8%),其中1例可见大量脉管内癌栓,已追加外科手术及术后6次标准化疗(1/132,0.76%)。
LST是结直肠癌一种重要的癌前病变类型,其具有较其他大型隆起型息肉样腺瘤(直径≥10 mm)高的恶性潜能(风险比=2.9,95%
:1.8~4.6),与结直肠癌密切相关
。研究发现,45%~79%的LST中存在高级别上皮内瘤变或具有黏膜下侵袭性
。因此,合理预测LST的病理类型、浸润深度及选择恰当的治疗术式对于降低结直肠癌的发病率和死亡率具有重要意义。LST癌变与其形态学分型、部位、大小以及组织学类型等因素相关。临床工作中通过内镜初次发现LST时合并结直肠息肉样隆起的情况并不少见,内镜医师在首次内镜下治疗会先处理息肉样病变,择期行ESD治疗LST,而部分患者由于术式选择的不恰当,造成如本次收集的病例中出现术后迟发性出血、手术病变切缘阳性等不良事件而追加手术,大大增加了患者的躯体、心理及医疗负担。因此,根据合并息肉样隆起的情况及LST的内镜特征初步预测LST的恶性程度,并结合内镜辅助技术,如染色放大、超声内镜等进一步判断其浸润深度,合理选择是否需要进行术前活检,根据组织病理学结果选择手术方式及是否需要扩大病变切除范围,对减少手术次数及提高治疗效果有重要意义。
柳州之所处,在于柳江,柳江之所为,在于西江干线。摊开地图,柳州正是西江干线的起点之一。凭借柳州及西江干线的黄金航道,柳州上通贵州,下达南宁和珠三角。
现如今,城市住房的消费市场上已经不只包括城市居民了,还包括了许多迁移进入城市的流动人口,他们在城市中租房甚至买房,而这势必会影响到城市居民对于住房的消费,因为按照供求原理,供给没有变,但是需求却随着外来迁移人口的进入而大大增加了。
LST根据内镜下表面形态是否呈结节样,分为LST-Gs和LST-NGs,前者根据病变表面是否存在较大结节分为LST-GM和LST-GH,后者按病变中央是否存在凹陷分为LST-F和LST-D,不同形态学类型的临床病理特征也不同
。本研究结果显示,LST-D和LST-GM发生癌变的风险明显高于其他两种类型,这与以往的多项研究结果相同
,所幸的是,无论是否合并息肉,LST-D均为较少见的一种类型(14/134,10.4%)。
本研究合并息肉组中LST主要位于右半结肠(53.1%),单因素分析结果表明位于直肠的病变发生癌变的风险高于结肠(
=15
000,
=0.003)。一项澳大利亚的前瞻性研究认为LST位于直肠和乙状结肠交界部位是发生癌变的独立危险因素
。
荟萃分析表明,随着LST体积的增大,发生黏膜下浸润癌的风险升高
。本研究资料合并息肉组中LST最大径多在<4 cm(83.7%),直径≥4 cm显著增加LST的恶性风险(
=21
700,
=0.006),将LST直径≥4 cm纳入多因素分析,进一步证明了其为LST恶变的独立预测因素(
=53
055,
=0.014),故当内镜下发现体积较大的LST时,尤其是巨大型,需要行活检明确其病理性质,对于内镜下切除困难者可考虑行根治性手术治疗。
本研究资料合并息肉组中LST组织病理学类型以管状腺瘤(44.9%)和管状绒毛状腺瘤(36.7%)为主,而据文献报道,绒毛状腺瘤的癌变率最高,混合管状绒毛状腺瘤次之
。合并息肉组LST伴癌变的概率(16.3%)显著高于不合并息肉组(4.8%),两组伴异型增生的程度差异有统计学意义。通过单因素Logistic回归分析发现合并息肉是LST为恶性类型的危险因素(
=2
861,95
:1
242~6
590,
=0.014)。因此,在发现LST合并结直肠息肉样隆起时,均应高度怀疑LST癌变可能,应完善术前活检及早期整块切除,以减少不良事件的发生及提高结直肠癌的诊治率。
本研究中LST合并的结直肠息肉大多直径<1 cm(41/49,83.7%),合并的息肉直径≥1 cm时,LST的恶性风险增加,通过多因素分析进一步证实了合并≥1 cm的息肉是LST发生癌变的独立危险因素(
=38
212,
=0.024),而与合并息肉的数目、组织病理学类型无关。此外,本研究资料显示息肉无论是位于LST的近端还是远端,对LST良恶性均无明显影响,且合并的息肉与LST相对位置不固定,以LST远端为主(35/49,71.4%),资料显示两者之间的肠管均无特殊表现,故内镜操作中发现结直肠直径≥1 cm的息肉,应高度怀疑息肉本身或合并LST癌变可能,即使是息肉位于结直肠远端,仍需继续进镜,直至完成全结肠检查,以防止漏诊。
综上,本研究结果提示,合并结直肠直径较大的息肉是LST为恶性类型的强预测因素,因此,当LST同时出现大肠息肉时,我们应该同时结合合并息肉的大小、LST的部位、大小和形态分型来综合预测LST的恶性风险,对于怀疑为恶性类型需采取术前活检或整块切除的方式,以减少二次手术率,同时对降低结直肠癌的发生率及早期大肠癌的筛查及治疗具有重要意义。
[1] Kudo S.Endoscopic mucosal resection of flat and depressed types of early colorectal cancer[J].Endoscopy, 1993, 25(7): 455-461.DOI: 10.1055/s-2007-1010367.
[2] Holme Ø, Bretthauer M, Eide TJ, et al.Long-term risk of colorectal cancer in individuals with serrated polyps[J].Gut, 2015, 64(6): 929-936.DOI: 10.1053/j.gastro.2019.06.039.
[3] 施海韵, 许瑶, 曹飞, 等.结直肠侧向发育型肿瘤癌变的内镜学特征[J].中华消化内镜杂志, 2020, 37(6): 404-408.DOI: 10.3760/cma.j.cn321463-20200513-00249.
Shi HY, Xu Y, Cao F, et al.Endoscopic characteristics associated with malignancy in colorectal laterally spreading tumors[J].Chin J Dig Endosc, 2020, 37(6): 404-408.DOI: 10.3760/cma.j.cn321463-20200513-00249.
[4] Li DH, Liu XY, Huang C, et al.Pathological analysis and endoscopic characteristics of colorectal laterally spreading tumors[J].Cancer Manag Res, 2021, 13: 1137-1144.DOI: 10.2147/CMAR.S286039.
[5] Burgess NG, Hourigan LF, Zanati SA, et al.Risk stratification for covert invasive cancer among patients referred for colonic endoscopic mucosal resection: a large multicenter cohort[J].Gastroenterology, 2017, 153(3): 732-742.DOI: 10.1053/j.gastro.2017.05.047.
[6] Shen X, Zhang Y, Zhao Y, et al.The coexistence of colorectal polyps in the right colon increases the malignant risk of laterally spreading tumors[J].Gastroenterol Res Pract, 2020, 2020: 3180420.DOI: 10.1155/2020/3180420.
[7] Kudo Se, Lambert R, Allen JI, et al.Nonpolypoid neoplastic lesions of the colorectal mucosa[J].Gastrointest Endosc, 2008, 68(4 Suppl): S3-S47.DOI: 10.1016/j.gie.2008.07.052.
[8] Hassan C, East J, Radaelli F, et al.Bowel preparation for colonoscopy: European Society of Gastrointestinal Endoscopy(ESGE)Guideline-Update 2019[J].Endoscopy, 2019, 51(8): 775-794.DOI: 10.1055/a-0959-0505.
[9] Facciorusso A, Antonino M, Di Maso M, et al.Non-polypoid colorectal neoplasms: Classification, therapy and follow-up[J].World J Gastroenterol, 2015, 21(17): 5149-5157.DOI: 10.3748/wjg.v21.i17.5149.
[10] Ferlay J, Colombet M, Soerjomataram I, et al.Estimating the global cancer incidence and mortality in 2018: GLOBOCAN sources and methods[J].Int J Cancer, 2019, 144(8): 1941-1953.DOI: 10.1002/ijc.31937.
[11] Miller KD, Nogueira L, Mariotto AB, et al.Cancer treatment and survivorship statistics, 2019[J].CA Cancer J Clin, 2019, 69(5): 363-385.DOI: 10.3322/caac.21565.
[12] Bogie RMM, Winkens B, Retra SJJ, et al.Metachronous neoplasms in patients with laterally spreading tumours during surveillance[J].United European Gastroenterol J, 2021, 9(3): 378-387.DOI: 10.1177/2050640620965317.
[13] Zhao X, Zhan Q, Xiang L, et al.Clinicopathological characteristics of laterally spreading colorectal tumor[J].PLoS One, 2014, 9(4): e94552.DOI: 10.1371/journal.pone.0094552.
[14] Saito T, Kobayashi K, Sada M, et al.Comparison of the histopathological characteristics of large colorectal laterally spreading tumors according to growth pattern[J].J Anus Rectum Colon, 2019, 3(4): 152-159.DOI: 10.23922/jarc.2018-036.
[15] Kobayashi K, Tanaka S, Murakami Y, et al.Predictors of invasive cancer of large laterally spreading colorectal tumors: a multicenter study in Japan[J].JGH Open, 2019, 4(1): 83-89.DOI: 10.1002/jgh3.12222.
[16] Soliman H, Brieau B, Guillaumot MA, et al.Invasive pit pattern, macronodule and depression are predictive factors of submucosal invasion in colorectal laterally spreading tumours from a Western population[J].United European Gastroenterol J, 2018, 6(10): 1569-1577.DOI: 10.1177/2050640618804713.
[17] Bogie RMM, Veldman MHJ, Snijders LARS, et al.Correction: Endoscopic subtypes of colorectal laterally spreading tumors(LSTs)and the risk of submucosal invasion: a meta-analysis[J].Endoscopy, 2018, 50(3): 263-282.DOI: 10.1055/s-0043-124018.
[18] Dekker E, Tanis PJ, Vleugels JLA, et al.Colorectal cancer[J].Lancet, 2019, 394(10207): 1467-1480.DOI: 10.1016/S0140-6736(19)32319-0.

