胃楔形切除术在裸鼠早期胃癌中的应用
早期胃癌(early gastric cancer,EGC)定义为局限于黏膜层或黏膜下层的肿瘤,无论是否存在淋巴结转移。目前,对于T1a的黏膜内癌主要采取内镜黏膜下剥离和内镜下黏膜切除,但对于T1b的黏膜下癌,指南仍推荐胃切除联合淋巴结清扫术
。随着手术理念逐步趋于微创化、精准化和个体化,EGC的手术治疗也逐步向局部切除联合区域淋巴结清扫的方向发展。然而,由于缺乏合适的动物实验数据,EGC在缩小手术方面的可行性和安全性尚未达成一致
。为了解决这一问题,首先需要一种用于手术的模拟人类EGC的实验动物模型。如今,小鼠胃癌模型的制作已相当成熟,但在如何精准制备小鼠EGC模型的方面仍缺少相关报道
。同时,当下的小鼠胃癌模型多应用于抗肿瘤药物治疗和肿瘤侵袭转移过程等方面的研究
,在手术治疗方面仍存在明显的空缺。
试验原料为产自辽宁宽甸的天然菱镁矿,其主要化学组成为:MgO(47.61%)、CaO(0.50%)、SiO2(0.66%),纯度约为99.58%。将菱镁矿于750 ℃的马弗炉中煅烧3.0 h后获得轻烧氧化镁,其MgO含量为96.89%。
本研究中,我们首先建立了一种裸鼠EGC原位移植模型,然后在该模型上分别行显微镜辅助下胃楔形切除术(microscopic assisted wedge gastrectomy,MAWG)和显微镜辅助下开关腹术(microscopic assisted open & close surgery,MAOCS),比较两组的肿瘤生长、淋巴结转移和远处转移情况,用于评估MAWG的技术可行性和肿瘤学安全性。本研究中的裸鼠模型是研究EGC的有效工具,并且MAWG可能为后续裸鼠EGC的缩小手术提供一定的参考价值。
1 材料与方法
SNU638鼠源性胃癌细胞由大连大学附属新华医院实验中心提供;6~8周龄,BALB/c品系裸鼠共12只,体质量18~22 g,雌雄兼有,由大连大学附属新华医院中心实验室代为购买。SMZ-B2/T2体视显微镜、异氟烷吸入麻醉药和动物麻醉系统由大连大学附属新华医院中心实验室提供。
1.2.2 实验动物:所有实验裸鼠均独笼饲养在无菌、安静的环境中;设置温度(21±2)℃、湿度(50±10)%和照明(12 h/12 h光暗循环)。实验开始前所有裸鼠均保持1周的适应期,禁止一切刺激性操作。所有小鼠的操作和治疗均是按照《实验动物管理和使用指南》中规定的程序进行的。该实验方案已获得大连大学附属新华医院伦理委员会批准(伦理批号:2022-020-1)。在研究结束时,所有裸鼠在全身麻醉下处死。
1.2.1 细胞培养:SNU638鼠源性胃癌细胞接种于100 π培养皿中,并在37 ℃、体积分数为5%的CO
、含质量浓度为100 g/L小牛血清的RPMI-1640培养基内传代培养。每2~3 d更换1次培养液。培养细胞融合为80%~90%时,经过PBS润洗细胞、胰酶(0.25% Trypsin-0.53 mmol/L EDTA)消化后,1 500 r/min,4 ℃,离心5 min。然后补加无血清的培养基,洗涤3次。显微镜下计数,用无小牛血清培养基调整细胞浓度至4×10
ml
,制备成1 ml细胞悬液。将制备的细胞悬液放置冰浴中保存,备30 min内完成接种。
德国垃圾管理方面的政策法规可追溯至20世纪70年代初期。当时建设标准不一的垃圾堆放场和垃圾填埋场遍布整个国家,虽然绝大多数在郊外,但是随着这些垃圾堆放场对地下水资源的危害被逐步证实,政府开始重新考虑当时立法的可行性。
肌肉的绞痛,韧带、关节囊的钝痛,神经根的放射痛,神经的闪电样锐痛,交感神经的灼痛,骨的深部痛,骨折的剧痛,脉管系统的弥散性痛……不管发生在什么地方,骨骼肌肉系统疾病与疼痛关系友好。
1.2.3 研究设计:首先,建立裸鼠EGC原位移植模型。饲养3周后,将所有裸鼠随机分成两组(每组6只),研究组行MAWG,对照组行MAOCS。术后观察4周,观察期结束后将所有实验裸鼠处死,立即行解剖和组织病理学检查。
(1)建立裸鼠EGC模型:实验裸鼠用小动物麻醉机异氟烷吸入麻醉(氧气1~2 L/min+异氟烷1.5~3.0 L/min),固定、备皮、消毒、铺巾,全程无菌操作,并在显微镜辅助下进行。首先,在上腹正中部位取5~10 mm切口进入腹腔,利用无损伤镊确认裸鼠胃体并将其外置。然后,用31号无损伤针头,迷路进针0.2 mm,将SNU638细胞悬液50 μl(细胞数为2×10
)缓慢注入裸鼠的胃体大弯侧的黏膜下层。确认注射部位无渗漏后,将胃送入腹腔,用4-0缝线逐层关腹,单纯吸氧至裸鼠苏醒,独笼饲养。
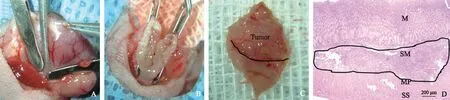
(2)建立MAWG模型:手术前夜移除饲料。麻醉消毒及开腹显露同上述,全程无菌操作,并在显微镜辅助下进行。首先,在胃壁下用湿润的无菌盐水纱布保护,确认肿瘤的位置,标记距离肿瘤约5 mm的范围。然后,用裸鼠专用肠钳楔形夹闭标记部位的远近端胃壁,楔形切除以肿瘤为中心半径约5 mm的胃壁,残端消毒,采用10-0血管缝合线端-端吻合胃壁(见图1A~1B)。最后,松开肠钳,确认吻合部位缝合完整、血运良好、无出血、无渗漏后,将胃送回腹腔,逐层关腹,后续处置同上。
即孟子认为小孩的“良知”“良能”会促使其敬爱其父母兄长的。孟子的“良知”“良能”就是陆九渊的“本心”。所以陆九渊的“本心”也同样具有发动道德行为的能力。这样我们就可以认为“本心”除了是一种积极的精神,同时也是一种能动的精神。

(3)建立MAOCS模型:术前准备、麻醉消毒及术后处置同前,仅行单纯开关腹手术。
1.2.5 组织病理学检测:对所有标本进行病理学检测。用4% PFA固定标本,脱水、透明和石腊包埋,将其切成4 μm厚的切片,再用苏木精-伊红染色(HE染色)。采用相位收缩显微镜对染色切片进行评估。
1.2.4 解剖裸鼠和观察指标:常规观察记录实验裸鼠的精神状态、饮食、活动和体质量情况。手术4周后,在全麻状态下处死所有实验裸鼠后立即解剖,记录吻合口及周围组织、血性腹水、淋巴结及腹腔内脏器转移的情况,凡可疑病灶均取材送检。
老崔看到他,摇下了车窗玻璃,说,你找我有事吗?冯一余说,没事,我散步呢,看到这个车里有亮光,以为是什么呢,不料是你,你怎么坐在车里?老崔笑笑说,我不坐在车里坐在哪里呢?冯一余说,你等人啊?老崔说,我不等人,我等想法。冯一余笑道,你等什么想法呢?老崔说,我等停车的想法,我家小区车停满了,我这会儿回去,也停不了车,我得等怎么停车的想法想出来了,才能开车回去。
2 结果
SNU638鼠源性胃癌细胞移植3周后,裸鼠胃壁上可见肿瘤组织生长,呈不规则状,质地较硬,病理检测见肿瘤细胞均位于黏膜下层,手术切缘阴性(见图1C~1D)。制模过程顺利,术后两组裸鼠的精神状态、饮食、活动和体质量均无差异,整个实验过程中无裸鼠死亡。裸鼠EGC原位移植模型成功率为100%(12/12),MAWG模型和MAOCS模型的手术成功率均为100%(6/6,6/6)。
老福慢吞吞地回答:“根据法律,如果你姑妈没留下遗嘱,找个律师,按法律分配;如果有遗嘱就按遗嘱办。所以我不能告诉你们能得到多少,还是得由你姑妈决定。”
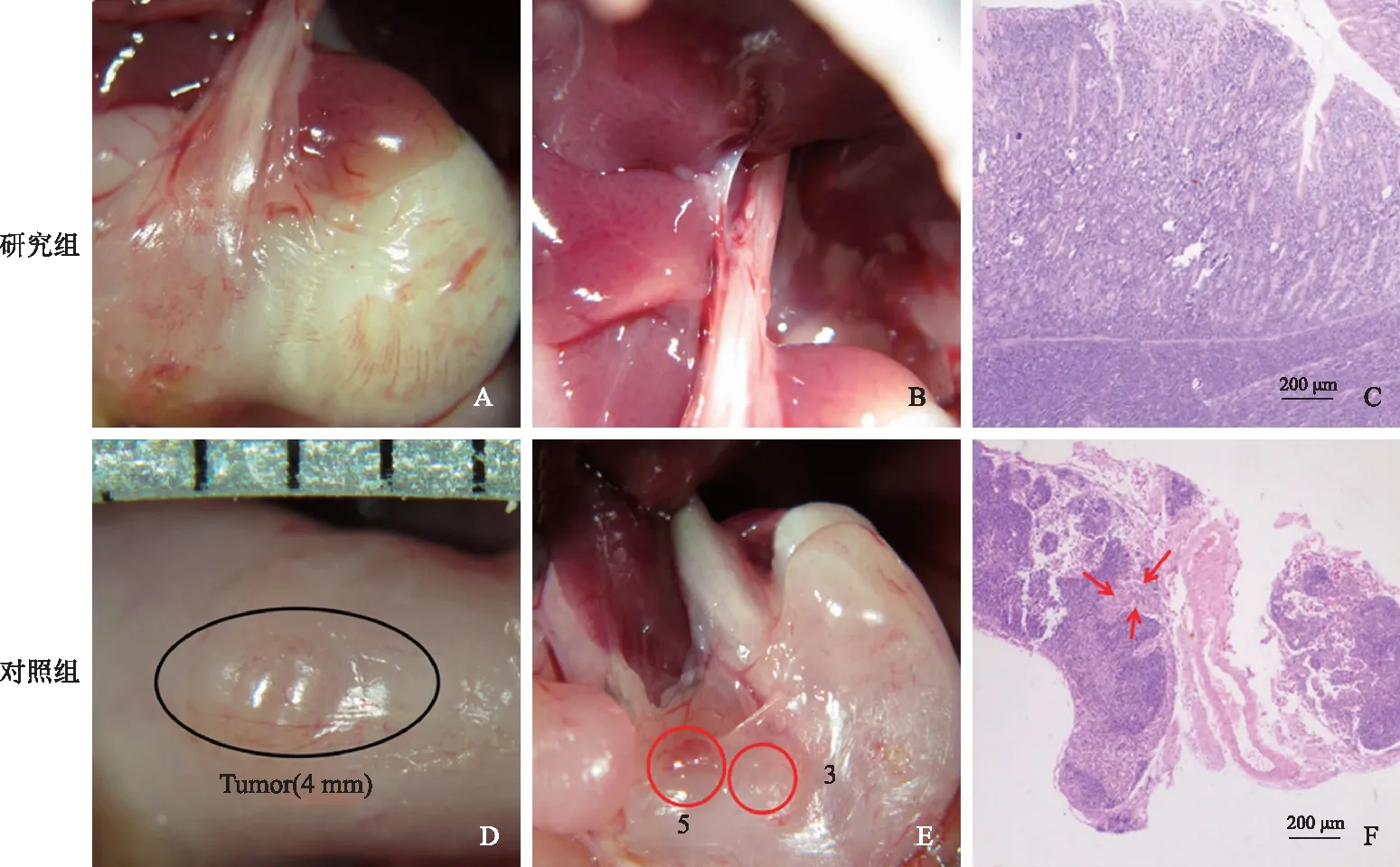
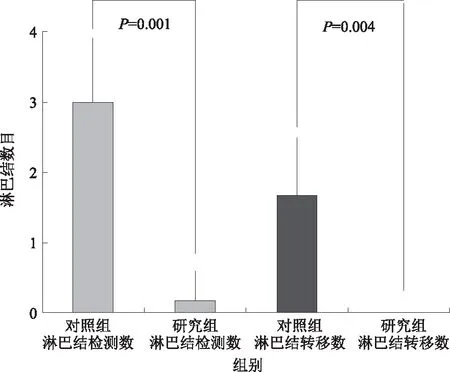
手术4周后,在全麻下处死所有实验裸鼠并立即解剖。研究组裸鼠解剖见吻合口愈合良好,胃壁无肿瘤组织,胃周无淋巴结肿大,无血性腹水,无其他脏器转移病灶(见图2A~2B);对照组裸鼠解剖见胃体部有一长径约4 mm的肿物,明显突出胃壁,部分裸鼠可见有第3组、第5组、第12组、第16组淋巴结肿大,无血性腹水,无其他脏器转移病灶(见图2D~2E)。取胃体、胃周淋巴结及可疑组织行病理学检测。研究组裸鼠吻合口处无肿瘤细胞生长(见图2C),而对照组裸鼠见肿瘤细胞侵及浆膜下层(见图2F);研究组裸鼠的淋巴转移率明显低于对照组,差异有统计学意义(
<0.05)(见图3)。研究组裸鼠EGC模型全部达到根治性切除,近期未见肿瘤复发和转移。
3 讨论
建立稳定可靠的裸鼠EGC模型是验证MAWG可行性和安全性的前提。长期诱导造模
和基因工程造模
均可准确地建立EGC模型,但其制模周期长、实验成本高、成功率偏低,大大降低了实验效率。Yamaguchi等
采用细胞悬液原位种植的方法将AZ521人胃癌细胞系注入胃窦浆膜下层,6周后小鼠全部出现肿瘤生长。本实验在此基础上做出了改进,选用来源于原发性肿瘤和具有高转移潜能的SNU638鼠源性胃癌细胞系
,将细胞悬液注入胃体黏膜下层沉积,靠近黏膜层,即人类胃癌的起始部位,3周后行MAWG,病理检测仅在黏膜下层有肿瘤细胞的生长;术后4周处死所有裸鼠行解剖和病理检测,研究组无肿瘤复发和转移。本研究结果证实:(1)该裸鼠EGC模型制作周期短(3周),成瘤率高(100%),模拟了人胃癌细胞在体内侵袭和转移的生物学行为,值得推广应用;(2)MAWG模型组达到了对裸鼠EGC的根治性切除,验证了该技术在手术操作上的可行性,在近期肿瘤学行为上的安全性。但由于小鼠自身条件的限制,使本实验关键的制模过程存在较高的操作难度,并且缺少对裸鼠术后长期生存率和肿瘤复发率等方面的进一步探索。
制作裸鼠EGC模型的难点在于肿瘤细胞的注射,其部位、深度、角度、剂量、速度、针头粗细和实验员熟练度等均能影响制模的成功率。Busuttil等
在显微镜下用29 g U-100胰岛素注射器将50 μl细胞悬液(细胞数为0.5×10
)成功注入胃窦部的浆膜下层。本实验制模的优势在于:(1)小鼠胃体大弯侧胃壁较厚,活动度大,易于术野暴露和手术操作;(2)选用31号无损伤针头,迷路进针,将50 μl细胞悬液缓慢注射(约20 s),可以防止因压力过大而发生肿瘤细胞的渗漏;(3)进针深度0.2 mm,可以将肿瘤细胞直接注入黏膜下层,过深则易注入胃腔内,过浅则易造成进展期胃癌模型。
MAWG的关键是要达到肿瘤的根治性切除和避免裸鼠在实验过程中死亡。研究组在术后4周对胃体、胃周淋巴结和腹部脏器行病理检测,均无肿瘤细胞生长,从而验证该手术达到了对侵及黏膜下层EGC的根治性切除。此外,吻合技术和无菌操作则是影响实验中裸鼠生存的重要因素。本手术优势和技巧在于:(1)选用可放大40倍的体视显微镜、小动物麻醉机、裸鼠专用肠钳和电刀;(2)楔形切除以肿瘤为中心5 mm范围的胃壁,既可以保证手术切缘的阴性,又可以充分保留胃的正常解剖和生理功能;(3)采用10-0血管缝合线连续全层端-端吻合胃壁,针距2~3 mm,避免发生出血、梗阻、吻合口瘘等术后并发症,但实验前需要在显微镜下利用胶皮手套反复练习缝合技巧。近年来,有研究采用荧光素酶标记的肿瘤细胞系
,实现对肿瘤的定位和监测。这使得在后续的实验中,我们可以在荧光腹腔镜辅助下直观准确地辨认肿瘤的位置、大小以及转移的淋巴结,从而更科学地实现对肿瘤的精准切除。
本实验中,我们通过解剖和病理学检测来验证MAWG的近期疗效,以至于无法长期观察裸鼠术后的生存率和肿瘤复发率。但近年来,随着小动物PET/CT、生物发光成像、磁共振成像等技术逐渐成熟,已经实现了在活体动物上对肿瘤细胞的生长和转移进行实时监测
。这不仅有助于我们对模型成瘤率的早期判断,还有助于我们继续观察裸鼠术后12周内的生存率和肿瘤复发率。目前有研究
表明,微转移与肿瘤的早期复发以及预后显著相关,但常规的影像学检查和病理学检查对微转移灶的敏感性相对较低。令人感兴趣的是,Kelly等
对胰腺癌术后的腹腔灌洗液进行RT-PCR检测,其阳性率明显高于常规细胞学检查。有鉴于此,在以后的实验结束时,取裸鼠的骨髓、肝脏等器官行RT-PCR检测,可以实现对EGC精准切除术后是否存在微转移做出准确的评估,从而进一步判断手术在肿瘤学行为上的安全性。
综上所述,制作裸鼠EGC模型和MAWG模型均需要熟练、精准的外科操作,并且其术后长期生存率和肿瘤复发率有待进一步研究,但本实验为裸鼠EGC的模型建立和手术治疗提供了一个新的研究方向。同样,对于进展期胃癌,按照本实验类似的方法,也可以在裸鼠模型上进行手术方式的改进和以手术为主多学科综合治疗的探索。
[1] Hatta W, Gotoda T, Koike T, et al.早期胃癌内镜下切除日本指南的历史和未来展望[J].中华胃肠内镜电子杂志, 2020, 7(1): 1-10.DOI: 10.3877/cma.j.issn.2095-7157.2020.01.001.
Hatta W, Gotoda T, Koike T, et al.History and future perspectives in Japanese guidelines for endoscopic resection of early gastric cancer[J].Chin J Gastrointestinal Endoscopy(Electronic Edition), 2020, 7(1): 1-10.DOI: 10.3877/cma.j.issn.2095-7157.2020.01.001.
[2] 王书昌, 余四特, 徐佳, 等.保留功能胃切除在早期胃癌手术中的应用[J].中华胃肠外科杂志, 2017, 20(10): 1141-1144.DOI: 10.3760/cma.j.issn.1671-0274.2017.10.012.
Wang SC, Yu ST, Xu J, et al.Valuation and prospect of function preserving gastrectomy[J].Chin J Gastrointestinal Surg, 2017, 20(10): 1141-1144.DOI: 10.3760/cma.j.issn.1671-0274.2017.10.012.
[3] 朱纯超, 赵刚.腹腔镜-内镜联合局部胃切除治疗早期胃癌[J].中华胃肠外科杂志, 2020, 23(10): 939-943.DOI: 10.3760/cma.j.cn.441530-20200713-00417.
Zhu CC, Zhao G.Combined laparoscopy-endoscopy local resection for early gastric cancer[J].Chin J Gastrointestinal Surg, 2020, 23(10): 939-943.DOI: 10.3760/cma.j.cn.441530-20200713-00417.
[4] 黄秋月, 叶晖, 史宗明, 等.胃癌鼠模型研究[J].胃肠病学和肝病学杂志, 2020, 29(5): 485-489.DOI: 10.3969/j.issn.1006-5709.2020.05.002.
Huang QY, Ye H, Shi ZM, et al.The research in mouse model of gastric cancer[J].Chin J Gastroenterol Hepatol, 2020, 29(5): 485-489.DOI: 10.3969/j.issn.1006-5709.2020.05.002.
[5] Wang ZH, Zhan-Sheng H.Catalpol inhibits migration and induces apoptosis in gastric cancer cells and in athymic nude mice[J].Biomed Pharmacother, 2018, 103: 1708-1719.DOI: 10.1016/j.biopha.2018.03.094.
[6] Badr El-Din NK, Abdel Fattah SM, Pan D, et al.Chemopreventive activity of MGN-3/Biobran against chemical induction of glandular stomach carcinogenesis in rats and its apoptotic effect in gastric cancer cells[J].Integr Cancer Ther, 2016, 15(4): NP26-NP34.DOI: 10.1177/1534735416642287.
[7] Wang TC, Dangler CA, Chen D, et al.Synergistic interaction between hypergastrinemia and Helicobacter infection in a mouse model of gastric cancer[J].Gastroenterology, 2000, 118(1): 36-47.DOI: 10.1016/s0016-5085(00)70412-4.
[8] Yamaguchi K, Ura H, Yasoshima T, et al.Liver metastatic model for human gastric cancer established by orthotopic tumor cell implantation[J].World J Surg, 2001, 25(2): 131-137.DOI: 10.1007/s002680020047.
[9] Choi BD, Jeong SJ, Wang G, et al.Secretory leukocyte protease inhibitor is associated with MMP-2 and MMP-9 to promote migration and invasion in SNU638 gastric cancer cells[J].Int J Mol Med, 2011, 28(4): 527-534.DOI: 10.3892/ijmm.2011.726.
[10] Busuttil RA, Liu DS, Di Costanzo N, et al.An orthotopic mouse model of gastric cancer invasion and metastasis[J].Sci Rep, 2018, 8(1): 825.DOI: 10.1038/s41598-017-19025-y.
[11] Metildi CA, Kaushal S, Lee C, et al.An LED light source and novel fluorophore combinations improve fluorescence laparoscopic detection of metastatic pancreatic cancer in orthotopic mouse models[J].J Am Coll Surg, 2012, 214(6): 997-1007.e2.DOI: 10.1016/j.jamcollsurg.2012.02.009.
[12] Hansen AE, Fliedner FP, Henriksen JR, et al.Liposome accumulation in irradiated tumors display important tumor and dose dependent differences[J].Nanomedicine, 2018, 14(1): 27-34.DOI: 10.1016/j.nano.2017.08.013.
[13] Sonoda H, Tani T.Clinical significance of molecular diagnosis for gastric cancer lymph node micrometastasis[J].World J Gastroenterol, 2014, 20(38): 13728-13733.DOI: 10.3748/wjg.v20.i38.13728.
[14] Kelly KJ, Wong J, Gladdy R, et al.Prognostic impact of RT-PCR-based detection of peritoneal micrometastases in patients with pancreatic cancer undergoing curative resection[J].Ann Surg Oncol, 2009, 16(12): 3333-3339.DOI: 10.1245/s10434-009-0683-2.

