生物炭对镉污染土壤中紫花地丁的生长及生理生态的影响
简敏菲,何旭芬,彭雨露,朱 宏,雷 雯,丛明旸
(江西师范大学生命科学学院,江西省亚热带植物资源保护与利用重点实验室,江西 南昌 330022)
0 引言
随着工农业与社会经济的快速发展,越来越多的工业活动导致土壤资源受到严重污染与破坏[1],土壤重金属污染问题日趋严重[2].在土壤中的重金属污染物主要有镉、铅、铜、锌、锡、镍、钴、锑、汞和铋等[3],相比于其他重金属,镉(Cd)具有更强的迁移性、持久性、隐蔽性与毒效性,易积累在土壤中被植物根系吸收累积、影响植物的生长及生理生态等[4].同时,Cd易通过食物链被摄入人体并可能导致肾、肝、肺、骨骼和生殖器官等部位中毒,并对免疫系统、心血管系统等产生有害影响[5],甚至引发癌症,对人类健康构成严重危害[6].
国内外针对土壤镉污染的修复进行了诸多尝试,传统方法主要有物理客土法、玻璃化法、电动修复法、化学淋洗法、改良剂固定法等[7],这些方法大多存在修复成本高、易产生二次污染、导致土壤退化等缺陷,不适合大范围使用[8];生物法(如植物法)对吸收重金属有一定效果,但也存在超积累植物品种的适应性、修复周期长和效率低等瓶颈问题[9].有关重金属污染土壤的联合修复技术也已开展相关研究,主要有生物联合技术[10]、物理化学联合技术和物理化学-生物联合技术[11]、生物炭-生物联合技术等方面[12],但各种修复技术之间的相互作用效应及其机制仍需深入研究[13].生物炭-生物联合技术是当前修复土壤重金属污染问题的研究热点,盆栽模拟法是探索植物修复重金属污染土壤的主要研究手段.
生物炭是生物质在限氧条件下通过热化学裂解转化而成的炭基固体材料[14],具有丰富的含氧官能团、比表面积大、孔隙发达且吸附力强等特点[15],能改善土壤质量促进植物生长,并能吸附固定在土壤中的重金属离子从而减轻植物的吸收量,还能改变土壤的酸度提高土壤pH值,这有助于将土壤中的重金属从有效态转化成无效态,从而显著降低土壤中重金属的生物有效性,并具有省时省力、资源广泛、不易造成二次污染等特点而被广泛应用于土壤重金属污染的修复中.如Cui Liqiang等[16]和张燕等[17]研究秸秆生物炭对镉污染的稻田土壤修复,研究结果发现:在土壤中的镉从酸可提取态及可还原态逐渐向可氧化态及残渣态转化;鲁秀国等[18]发现:在施加质量分数为10%的核桃壳生物炭后,在土壤中镉的有效利用性显著降低;牛晓丛等[19]探究了用秸秆生物炭和酵素渣钝化修复土壤中的Pb、Cd、Zn,研究结果发现:施加质量分数为5%的酵素渣和质量分数为5%的秸秆生物炭能显著降低土壤镉的生物有效性;汪玉瑛等[20]和安梅等[21]研究生物炭对Cd污染土壤修复,研究结果发现:生物炭将土壤中Cd从酸可提取态、可还原物质结合态向可氧化态、残渣态转化,有效降低了镉的生物可利用性.另外,生物炭缓解镉污染对植物安全性及生长方面的影响也有相关报道,如在镉污染土壤中施加玉米秸秆生物炭可以缓解镉对植物的株高、生物量、叶绿素含量和抗氧化酶活性的抑制作用,并降低镉积累对植物造成的影响[22].而生物炭对重金属的固定效应取决于生物炭的性质及其制备原料[23],因为生物炭的制备材料及制备条件不同,所以其理化性质也存在差异,对土壤镉污染的修复效果也有所不同.玉米秸秆生物炭比其他材料制备的生物炭具有孔隙发达、较高的阳离子交换量、良好的结构功能和广泛的材料来源等优点,是农业废弃物有效利用的重要途径.
紫花地丁(Violaphilippica)别名又称光瓣堇菜、野堇菜、地丁菜和辽堇菜等,是堇菜科(Violaceae)堇菜属(Viola)的一种多年生草本植物,广泛生长于郊野、路旁、荒地、草丛和灌丛等[24].花紫色,耐寒、耐贫瘠、耐旱、不择土、适应性极强,具有一定的药用和观赏价值.已有研究报道堇菜属植物对土壤镉具有一定的富集能力及耐受性,如宝山堇菜(V.baoshanensis)、早开堇菜(V.prionantha)、紫花地丁等均对土壤镉具有较强的富集作用和耐受性[25-26],这表明紫花地丁是修复土壤重金属镉污染的一种良好植物材料.目前有关紫花地丁的化学成分及繁殖特性等方面的研究也有相关报道[27-28],但有关生物炭对在土壤镉污染条件下紫花地丁修复方面的研究鲜见报道.本文以紫花地丁为供试材料,研究施加生物炭对在镉污染土壤中紫花地丁生长及生理生态的影响,以期为生物炭修复土壤重金属污染问题提供理论和数据支撑.
1 材料与方法
1.1 供试材料与试验设计
1.1.1 供试材料 供试土壤采自江西师范大学校园内未受污染的0~20 cm深的表层土,经室内自然风干处理,剔除粗枝、根、叶和碎石等杂质,将土块粉碎后过4 mm筛,经混匀后保存、备用.供试植物采自江西师范大学校园内长势基本一致、株高约5 cm的紫花地丁幼苗,经室内驯化培养7 d后备用.供试生物炭购自郑州邦金环保科技有限公司生产的玉米秸秆生物炭,经在450~500 ℃条件下制备而成,粒径为1~2 mm,pH值为8.86.
1.1.2 在土壤中镉溶液施加处理 在供试土壤经除杂处理后测定其pH值、镉含量背景值及其他主要理化指标,然后均分成3组样.选用CdCl2·2.5H2O(分析纯)配制镉添加溶液,参照文献[26,29]报道的镉污染土壤现状,分别设置3个梯度:0 mg·kg-1(0施加,CK组)、5 mg·kg-1(中浓度组,M组)和10 mg·kg-1(高浓度组,H组),将它们分别施加CdCl2溶液至上述3组土样中,经搅拌均匀后分装入口径为23 cm×底径14 cm×高18 cm的实验盆中,每个梯度处理组各分装20盆等量平行样,共60盆,每盆装入2.5 kg处理土壤,各盆底部均放入滤纸及托盘防止土壤和重金属流失,置于室内避光驯化平衡14 d.
1.1.3 在镉污染土壤中生物炭施加与植物培养 参照文献[20,30-31]的方法,生物炭施加按在土壤中生物炭质量分数设置,分别选取0%(0)、2%(2)、4%(4)和6%(6)共4个水平,将生物炭分别施加至上述3组镉处理土壤中,将60盆处理成12组,各处理组代码分别如表1所示,每组5个平行.在每盆土样均匀搅拌并稳定14 d后,移植生长一致的紫花地丁幼苗,每盆7株,置于室内培养,每日设置光照12 h,控制温度为(25±1) ℃,在培养期间,以称质量法定量加入蒸馏水,并重复利用底部托盘中的水,各盆每隔2 d加入等质量的蒸馏水,确保土壤持水量为60%;在培养45 d后,采集各组植物样及土壤样,经处理并测定相关指标.
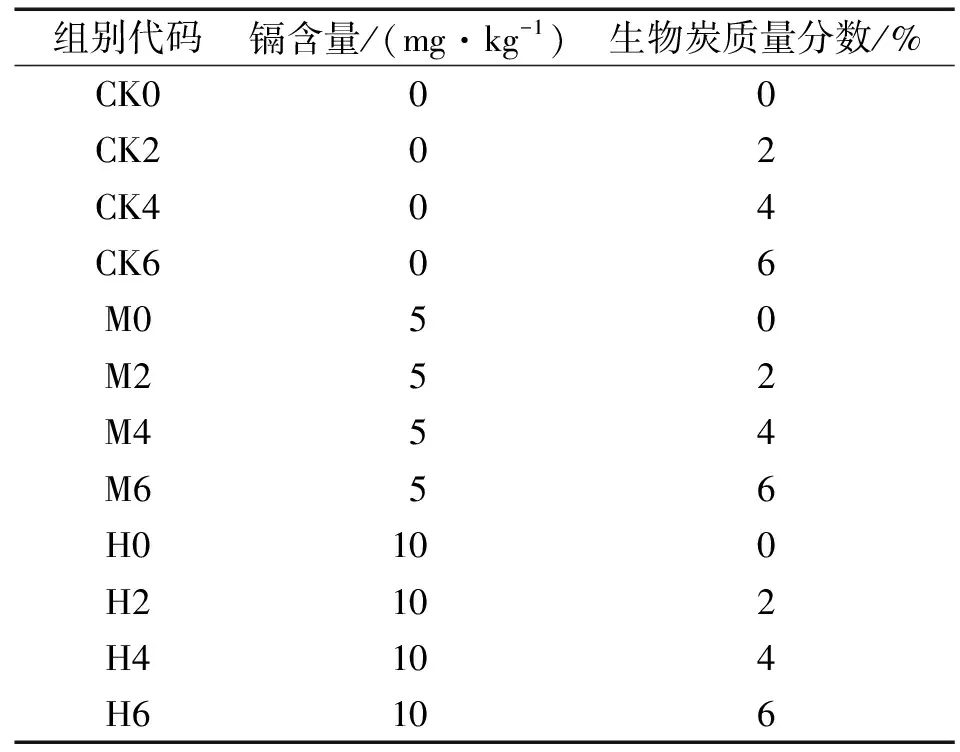
表1 在镉污染土壤中生物炭施加试验设计与处理组对应代码
1.2 测定方法
1.2.1 植物株高 在培养处理45 d后,随机采收各组紫花地丁植株,用卷尺(精确到0.1 cm)测量每株植物株高,每平行样分别采集3株,统计每处理组株高平均值.
1.2.2 植物生物量 将测定株高后的植株体用自来水洗净植物全株泥土后,用超纯水冲洗全株2~3遍,随后用吸水纸吸干植株表面的水分,测定单株鲜质量;在室内自然风干后于65 ℃下烘干至恒质量,用电子天平称其鲜质量和干质量(精确到0.1 mg),统计各处理组每株植物鲜质量平均值.
1.2.3 叶绿素含量 采集并称取各盆供试植物样完全展开叶0.1 g于研钵中,全程在避光条件下进行.加入5 mL 100%的二甲基亚砜(DMSO)进行研磨,在4 ℃、转速为7 000 rpm的条件下离心20 min,并用二甲基亚砜定容至10 mL,分别在645 nm和663 nm波长下测定其吸光度值[32],参照Arnon方法[33]计算叶绿素各指标,分别为叶绿素a(Chlorophylla,Ca,mg·L-1)、叶绿素b(Chlorophyll b,Cb,mg·L-1)和叶绿素总量(Total chlorophyll,Ct,mg·L-1),计算公式为Ca=12.70A663-2.69A645,Cb=22.90A645-4.68A663,Ct=8.02A663+20.21A645.
1.2.4 抗逆酶活性 分别选择超氧化物歧化酶(Superoxide dismutase,SOD) 、过氧化物酶(Peroxidase,POD)及过氧化氢酶(Catalase,CAT)等3种抗逆酶指标进行测定.
从各培养盆中取出受试植物紫花地丁,准确称取每平行样叶片各0.1 g,分别加入0.05 mol·L-1磷酸缓冲液(pH值为7.8,内含0.1%二硫苏糖醇(DTT)和1%聚乙烯吡咯烷酮(PVP)),为防止酶活性失活,在-20 ℃下预冷处理研钵,并于冰浴上迅速研磨成匀浆,采用台式高速冷冻离心机(卢湘仪BIORIDGE(TGL-16M))在4 ℃、转速为7 000 rpm条件下离心20 min,提取上清液测定酶活指标.采用氮蓝四唑法测定SOD瞬时值[34];采用愈木创酚法测定POD值,每隔30 s记录1次,吸光度以在1 min内A470上升0.1 为1个活性单位;采用紫外分光光度吸收法测定CAT,每隔1 min记录1次,以在1 min内A240下降0.1为1个酶活力单位[35].
1.3 数据处理
采用Excel2019软件进行数据整理,并利用SPSS19.0对相关数据进行统计分析,使用单因素ANOVA进行方差分析,并用最小显著差异法(LSD)分析(α=0.05),对生物炭施加下在镉污染土壤中紫花地丁的生理生长指标变化进行差异性比较.计算结果均采用平均值±标准差表示,采用Origin18.0软件进行制图.
2 结果与分析
2.1 生物炭对镉污染土壤中紫花地丁生长的影响
2.1.1 在不同条件下紫花地丁株高的变化特征 在不同处理条件下紫花地丁株高的变化如图1所示.未受镉污染的CK0组紫花地丁株高高于有镉污染处理各组的;而未施加生物炭的M0组和H0组间的植株高无统计学意义上显著性差异.在施加不同量生物炭后,未受镉污染的CK2组和CK4组的紫花地丁株高高于CK0组的;在相同生物炭量施加条件下,H2组与CK2组相比植株高无统计学意义上显著性差异,2组株高均显著高于M2组;CK4组的株高显著高于H4组,M4组的株高高于H4组;在施加不同量的生物炭后,M组的株高均高于未施加生物炭的M0组的,在不同量生物炭施加条件下各组株高变化无统计学意义上显著性差异;H2组株高显著高于其他各处理组的.
2.1.2 在不同条件下紫花地丁鲜质量的变化特征在不同处理条件下紫花地丁的鲜质量变化如图2所示.在无镉污染条件下CK0组紫花地丁鲜质量显著高于有镉污染处理各组的;在未施加生物炭条件下,紫花地丁的鲜质量随镉含量的增加呈显著下降趋势.在施加不同量的生物炭后,无镉污染的CK组中紫花地丁的鲜质量有一定增加,但效果并不显著;CK各组紫花地丁鲜质量均显著高于M组和H组在相同生物炭量施加条件下紫花地丁的鲜质量.在有镉污染的M组与H组中施加不同比例的生物炭后,分别以在M2或H2条件下的紫花地丁鲜质量为最高,且均显著高于其他各处理组的.随着生物炭施加量的增加,M组与H组在镉污染条件下紫花地丁的鲜质量均呈下降趋势;除2%生物炭的施加组外,在相同生物炭量施加条件下,M组紫花地丁的鲜质量显著高于H组的.
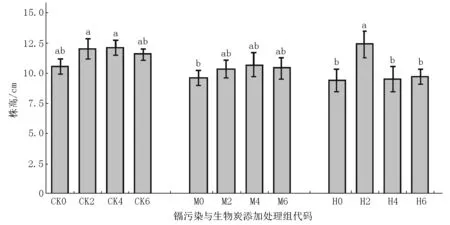
注:不同字母表示差异显著(P<0.05).以下各图均同.
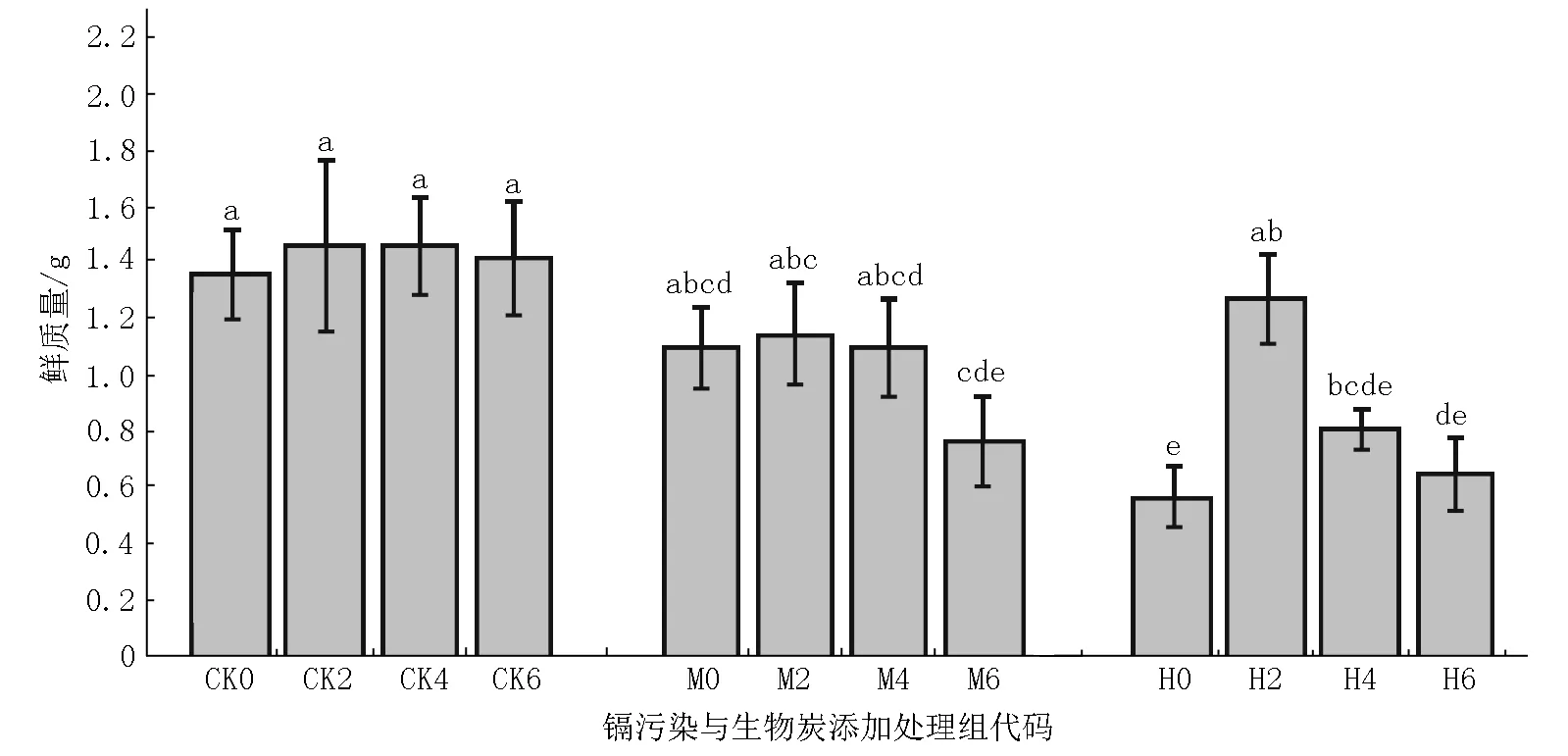
图2 生物炭施加对镉污染土壤中紫花地丁生物量的影响
2.2 生物炭施加对镉污染土壤中紫花地丁主要生理指标的影响
2.2.1 紫花地丁叶绿素的变化特征 在不同处理条件下紫花地丁各种叶绿素含量和叶绿素a/b(Ca/Cb)的变化分别如图3(a)、(b)所示.在未施加生物炭条件下,与CK0相比,在不同强度镉污染土壤中紫花地丁Ca和Ct均显著降低;但Cb的变化不显著;M0组Ca/Cb的变化不显著,H0组的Ca/Cb显著升高.CK各组紫花地丁的Ca和Ct均随生物炭量施加量增加而显著提高,CK2组的Ca和Ct变化量最显著;施加不同量生物炭对CK组紫花地丁的Cb含量有显著影响,且随着生物炭量增加各CK组植物的Cb呈缓慢增加趋势;而Ca/Cb的变化总体上随生物炭量增加呈下降趋势,Ca/Cb的变化在2%生物炭的施加条件下不显著,但在4%和6%生物炭的施加条件下的变化较显著.
在不同强度镉污染土壤中施加不同量生物炭后,中污染(M2、M4)组和高污染(H2、H4)组的Ca和Ct含量均显著高于M0或H0的,而Cb含量均未产生显著变化;M6组和H6组植物的Ca和Ct均呈下降趋势,且与M0或H0组相比,M6和H6这2组的Ca含量、H6组的Ct含量值均无显著变化,仅M6组和H4组的Cb含量显著提高.
在CK各组中紫花地丁的Ca/Cb值随生物炭量的增加呈下降趋势,但CK2组的变化不显著,而CK4和CK6组的变化较一致且均显著低于CK0组的;M组或H组紫花地丁的Ca/Cb值随生物炭施加量的增加表现出不一致的变化,M组Ca/Cb值随生物炭量增加呈先显著上升后显著下降趋势,M4组达最高;而在H组中施加生物炭量后,紫花地丁的Ca/Cb值均显著低于H0组的,且不同施加量各组间无统计学意义上显著性差异.
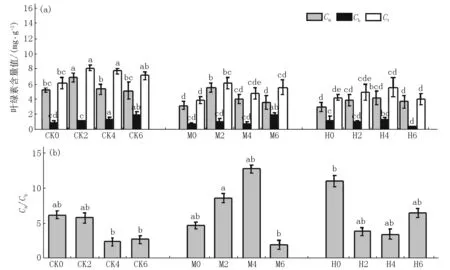
图3 生物炭施加对镉污染土壤中紫花地丁各种叶绿素的影响
2.2.2 紫花地丁抗逆酶活性的变化 在不同处理条件下紫花地丁的SOD、CAT和POD这3种抗逆酶的酶活性的变化如图4所示.在未施加生物炭条件下,M0组紫花地丁的SOD、CAT和POD抗氧化酶活性均显著高于CK0对照组和H0组对应的指标值;H0组植物的SOD和POD值显著高于CK0组对应的指标值,而CAT指标无显著变化.在CK各组中,随着生物炭施加量的增加,紫花地丁各抗氧化指标值呈不同变化,但并未表现出明显的规律,总体上表现出生物炭的施加降低了紫花地丁的SOD酶活性,并提高了CAT的酶活性,而POD活性随生物炭量的增加呈缓慢增加趋势,且CK4组的SOD和CAT指标值均显著高于CK各组的.
在镉污染土壤中施加不同量的生物炭后,随着生物炭量的施加,M组和H组紫花地丁的SOD值均呈先升后降趋势,以在M2组和H2组条件下的SOD值为最高,均显著高于未施加生物炭的M0组或H0组的;在相同量生物炭施加条件下,H组的SOD值显著高于M组,且H组和M组的SOD值均显著高于CK0组的.在不同强度镉污染处理组中,不同量生物炭施加对植株体CAT的影响并不显著,对H组的POD活性影响也不显著,但M组的POD值在施加不同量生物炭后呈现显著变化,M2组和M4组的POD值均显著低于M0组的,而M6组的POD值显著高于M0组的.在相同量生物炭的施加条件下,受污染各组的POD值均显著高于对应的未受污染各组的.
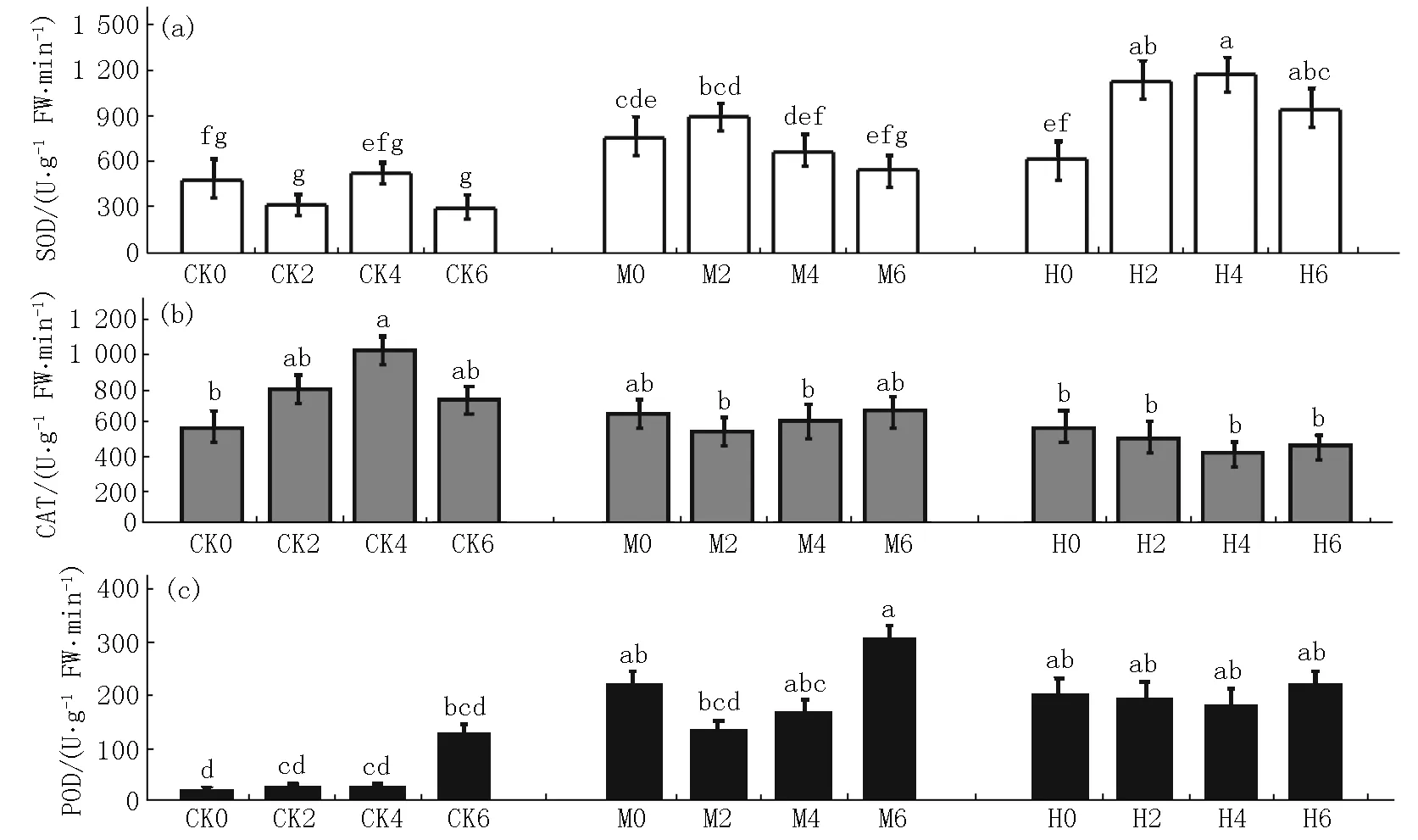
图4 生物炭施加对镉污染土壤中紫花地丁抗氧化酶活性的影响
3 讨论与结论
生物炭在土壤改良中有诸多作用,通过向土壤中释放K+、Ca2+、Mg2+、Mn2+和Na+等可交换态离子为植物生长提供营养元素[36],从而促进植物的正常生长[37].通过表面特殊的多孔结构吸附重金属等污染物[38],这有利于缓解重金属对植物的毒害作用[39].
本文研究发现:在不同镉污染土壤中施加不同量玉米秸秆生物炭后,紫花地丁的株高及鲜质量均有所提高,这表明生物炭能促进植株体生长并减缓重金属镉对紫花地丁的毒害影响;在镉污染较高浓度处理土壤中,在低适量(质量分数2%~4%)生物炭施加条件下,紫花地丁的鲜质量和株高均显著高于未施加生物炭的高镉污染组的,这表明适量生物炭施加有助于缓解镉污染对紫花地丁生长的影响,这与蒋欣梅等[40]和郭军康等[41]研究发现施用一定量的生物炭能增加蔬菜生物量的结果相一致.李康[29]研究也发现施加低适量玉米骨生物炭能提高龙葵(Solanumnigrum)的株高和干质量;黄连喜等[42]研究发现生物炭可对土壤重金属产生钝化作用,促进蔬菜的生长,这些结果均与本文的结果较一致.此外,当施加质量分数为4%的生物炭时,对照组CK4的紫花地丁鲜质量和株高显著高于受镉污染的处理组M4组和H4组的,这表明在无镉污染影响下,相同量生物炭施加更有利于植物的鲜质量和株高增加,这与王义祥等[43]的研究结果较一致.但随着生物炭施加量继续增加紫花地丁的鲜质量和株高反而会出现下降,可能原因是:在土壤孔隙中吸附生物炭也会趋于饱和,继续提高生物炭施加量会影响紫花地丁根系对矿质营养元素的吸收[40],或者是生物炭过量导致土壤电解质浓度增高,导致紫花地丁在一定程度上失去水分,从而影响紫花地丁的生长[22].
本文研究还发现:与未施加生物炭的镉污染组(M0或H0)相比,在施加质量分数为2%或4%的生物炭的条件下,中污染(M2、M4)组和高污染(H2、H4)组的Ca和Ct含量均显著升高,而Cb含量均未产生显著变化.低适量的生物炭施加能有效缓解镉对紫花地丁叶绿素的影响,显著增加叶绿素总量Ct.不同处理组紫花地丁的Ca/Cb值呈无规则变化,M组呈先升后降趋势,而CK组和H组的Ca/Cb值随生物炭施加量增加呈下降趋势,这表明Ca比Cb对镉污染胁迫更敏感,也可能原因是:植物叶片衰老导致,或者其他环境因素导致的结果[44];还可能原因是:在叶绿素的提取中,由于研磨充分性问题而没有使叶片中全部叶绿素被提取出来[45].
当环境遭到其他因素破坏时,植物体内正常的代谢平衡会失调,从而会导致大量活性氧产生并积累,引起膜脂过氧化,对植物造成伤害[46].而抗氧化酶是一种清除剂,用以消除植物体内过多的活性氧从而达到平衡.本文研究发现紫花地丁在不同Cd污染影响下,植株体内抗氧化酶SOD与POD均呈显著增加趋势,主要原因是镉进入紫花地丁植株体后导致其活性氧增加,需依靠抗氧化酶的活性清除植株体内过多的活性氧.在镉污染土壤中施加生物炭后,随着生物炭施加量的增加,紫花地丁植株体的抗氧化酶活性呈下降趋势.在施加低适量生物炭(质量分数为2%或4%)条件下,植物体的CAT和POD酶活性最低,在施加质量分数为6%的生物炭时紫花地丁的SOD酶活性最低,这表明一定量的玉米秸秆生物炭能激活紫花地丁的应激机制以抵抗镉污染胁迫,并缓解镉破坏紫花地丁的膜脂氧化过程,活性氧的产生减少,进而缓解镉对紫花地丁的胁迫效应,降低抗氧化酶的活性[40].金睿等[47]也发现生物炭能缓解镉对南瓜幼苗的膜质化,其抗氧化酶的酶活性也呈下降趋势,这与本文的研究结果相一致.但只有在适量生物炭的施加条件下才有助于紫花地丁抵抗外界环境的影响,施加过量的生物炭也会对紫花地丁的生长产生不利影响,由于过量生物炭会产生一些矿物质并导致土壤营养及其结构特征发生改变,因而影响植物的正常生长[48].
综上分析,在盆栽模拟条件下不同镉污染土壤中施加不同质量分数的生物炭对紫花地丁的生长与生理生态均有一定影响.低适量玉米秸秆生物炭施加能显著增加高浓度镉污染处理土壤中紫花地丁的株高和鲜质量,并显著增加在不同镉污染条件下紫花地丁的叶绿素a和叶绿素总量.低适量生物炭能激活紫花地丁的应激机制以抵抗镉污染胁迫,缓解镉破坏紫花地丁的膜脂氧化过程,减少活性氧的产生,降低镉对紫花地丁的胁迫.

