老年晚期胰腺癌病人组织MGMT表达水平对吉西他滨化疗临床疗效的影响
石宇 钱静 严晓娣 姚宁华 马剑波
胰腺癌(pancreatic cancer)是一种恶性程度比较高且临床预后比较差的实体瘤,通常确诊时约50%的病人已是晚期[1]。胰腺癌的发病率与病死率近年逐渐升高[2],其发病率与死亡率几乎相当[3],在全球癌症死亡率排名中,胰腺癌位于第4位[4],5年生存率不足6%[5]。目前吉西他滨或以吉西他滨为主的联合方案是进展期胰腺癌的标准治疗方案。由于部分病人存在对吉西他滨先天性及获得性的耐药性,导致胰腺癌的整体化疗效果并不理想[6]。肿瘤细胞产生耐药性是导致化疗失败的主要原因之一,其中有关耐药机制十分复杂。O-6-甲基鸟嘌呤-DNA甲基转移酶(methylgua-nine-DNA methyltransferase,MGMT)是一种重要的DNA修复酶,可以修复由各种烷化剂造成的细胞DNA烷基化损伤[7]。MGMT在胰腺癌中高度表达,并且MGMT可作为胰腺癌一种新的潜在生物标志物[8]。肿瘤细胞对烷化剂的耐药性通常与MGMT蛋白水平升高相关,而MGMT蛋白水平是否与吉西他滨治疗胰腺癌的临床疗效有关未见报道。本研究回顾性分析接受吉西他滨化疗的晚期胰腺癌病人肿瘤组织MGMT蛋白水平与病人临床疗效和预后的关系,为该类癌症病人的临床治疗提供参考依据。
1 资料和方法
1.1 研究对象 本研究属于回顾性病例分析,共收集2017~2019年在我院确诊并且接受吉西他滨化疗的92例晚期胰腺癌病人病历。病人纳入标准:(1)经影像学和病理学检查确诊为胰腺癌;(2)根据国际抗癌联盟和美国抗癌联合会胰腺癌TNM 分期标准为Ⅲ~Ⅳ期;(3)接受吉西他滨≥2个疗程的化疗;(4)未合并其他严重疾病;(5)临床资料和随访资料完整,可用于临床分析和评价。排除标准:(1)TNM分期为Ⅲ期但接受手术治疗的病人;(2)有其他恶性肿瘤病史,或曾接受过其他化疗、放疗。本研究92例病人中男54例(58.70%),女38例(41.30%);年龄55~71岁,平均(60.76±8.49)岁;肿瘤原发部位在胰头59例(64.13%)、胰尾33例(35.87%);肿瘤直径2.1~11.4 cm,平均(5.47±1.64)cm;肿瘤TNM分期Ⅲ期61例(66.30%)、Ⅳ期31例(33.70%);临床和(或)病理证实发生胰腺外转移42例(45.65%)。
1.2 方法
1.2.1 化疗方案:所有病人接受吉他西滨单药化疗。化疗起始剂量为1000 mg/m2,每疗程第1天、第8天进行化疗,根据病人对吉西他滨的耐受性可调整化疗剂量。3周为1个疗程,所有病人完成连续化疗≥2个疗程。
1.2.2 近期临床疗效:所有病人在完成化疗后根据实体瘤疗效评价标准(RECIST)对病人的临床疗效进行评价,根据病灶变化情况分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD)。总有效率=(CR+PR)/(CR+PR+SD+PD)×100%,疾病控制率=(CR+PR+SD)/(CR+PR+SD+PD)×100%。
1.2.3 远期临床疗效:以病人总生存时间(胰腺癌确诊至死亡)评价病人的远期临床疗效。通过电话或门诊对病人进行出院后随访,随访截止时间为2020年12月30日。
1.2.4 胰腺癌组织MGMT表达的测定:取受试者胰腺癌石蜡包埋组织,常规切片后采用免疫组化SP法进行染色。将组织切片经二甲苯脱蜡,采用乙醇梯度洗脱(100%→95%→90%→80%→70%),采用高温高压法对抗原进行修复,3% 双氧水消除内源性过氧化物酶,加入一抗(北京中杉公司),4 ℃冰箱过夜,PBS冲洗后滴加二抗,37 ℃孵育后进行DAB显色,苏木精复染,1%盐酸乙醇快速分化,放入0.2%氨水返蓝,梯度乙醇溶液进行脱水(70%→80%→90%→95%→100%),二甲苯透明,滴加中性树胶并盖上盖玻片进行封片。MGMT在细胞核内出现棕黄色着色为阳性细胞。在高倍视野下计数100个细胞,阳性细胞数≥10%为MGMT阳性表达,阳性细胞数<10%为MGMT阴性表达。
1.3 统计学分析 所有数据采用SPSS 20.0统计软件分析。计量资料采用均数±标准差表示,组间比较采用t检验;计数资料用频数和百分率表示,组间比较采用卡方检验。以P<0.05为差异有统计学意义。
2 结果
2.1 胰腺癌组织MGMT的表达情况 92例病人中有62例(67.39%)胰腺癌组织MGMT呈阳性表达,而30例(32.61%)病人胰腺癌组织MGMT呈阴性表达。
2.2 本组病人近期临床疗效 本组病人经2个疗程化疗后,CR、PR、SD和PD分别为19例(20.65%)、21例(22.83%)、18例(19.56%)和34例(36.96%),总有效率为43.48%,疾病控制率为63.04%。
2.3 本组病人远期临床疗效 本组病人6、9、12个月分别有65例(70.65%)、34例(36.96%)和14例(15.21%)生存。
2.4 胰腺癌组织中MGMT表达与临床病理特征的关系 胰腺癌组织中MGMT阳性表达病人和阴性表达病人的性别、年龄、肿瘤原发部位和肿瘤直径差异均无统计学意义(P>0.05),但是TNM分期和肿瘤转移情况差异有统计学意义(P<0.05)。见表1。
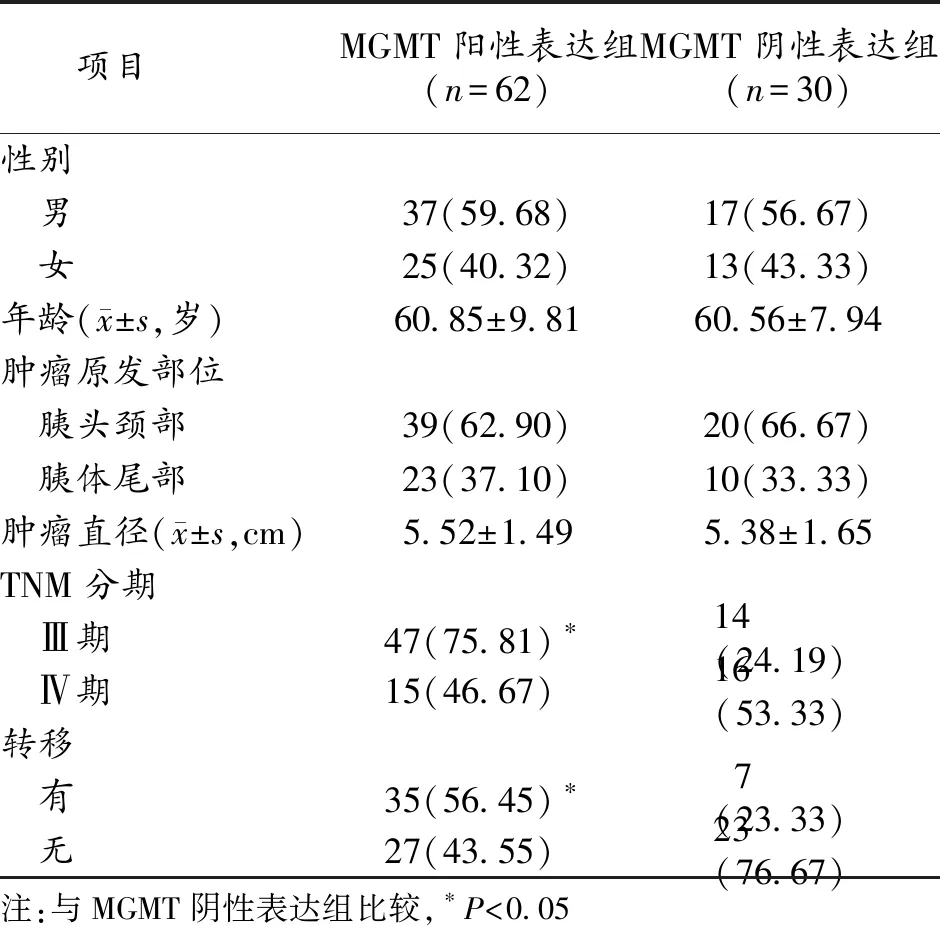
表1 胰腺癌组织中MGMT表达与临床病理特征的关系(n,%)
2.5 胰腺癌组织中MGMT表达与近期疗效的关系 胰腺癌组织中MGMT阳性表达病人的临床总有效率和疾病控制率分别为35.48%和53.23%,均显著低于MGMT阴性表达病人,差异具有统计学意义(P<0.05)。见表2。
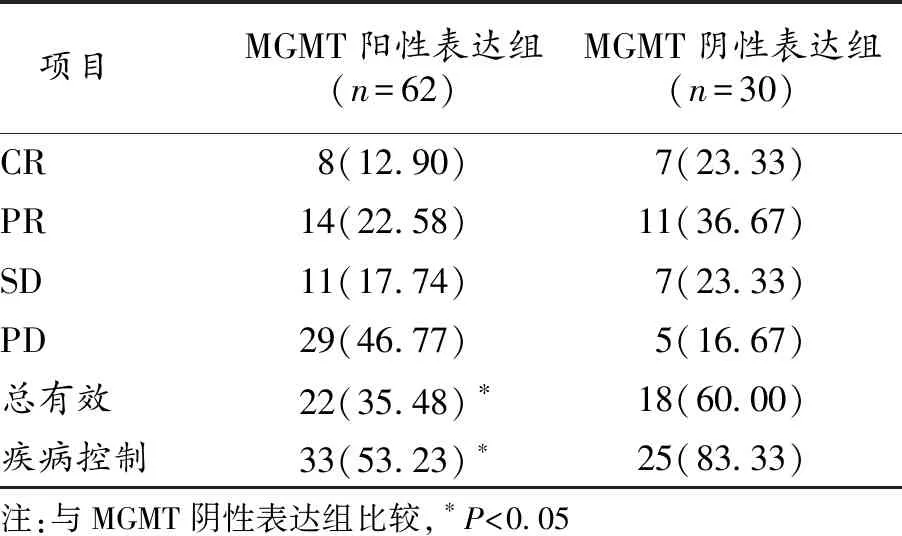
表2 胰腺癌组织中MGMT表达与近期疗效的关系(n,%)
2.6 胰腺癌组织中MGMT表达与远期疗效的关系 胰腺癌组织中MGMT阳性表达病人的9个月和12个月生存率分别为17.40%和6.51%,均较MGMT阴性表达病人显著降低(P<0.05);2组病人6个月生存率差异无统计学意义(P>0.05)。见表3。
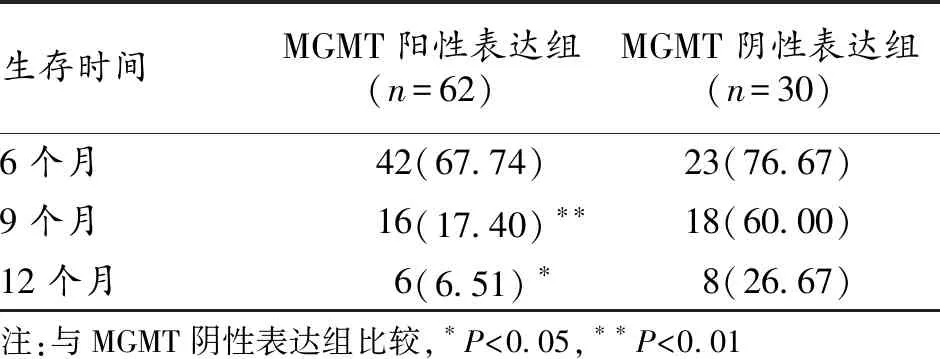
表3 胰腺癌组织中MGMT表达与病人远期疗效的关系
3 讨论
胰腺癌为恶性程度最高的实体恶性肿瘤[9],属于发病于机体胰腺外分泌腺的恶性肿瘤,其发病部位来自于内分泌腺、胰腺相关外分泌腺、非上皮组织等。近年来我国恶性肿瘤的发病率呈显著上升,其中胰腺癌的发病率增长4倍[10]。胰腺癌发病隐匿,早期临床表现缺乏特异性,并且缺乏特异的肿瘤标志物,早期诊断困难,多数胰腺癌病人确诊时已经发生远处转移,错过根治性切除机会[11]。即使少数病例存在根治性手术机会,仍有大部分病人出现复发和转移,术后生存率也比较低,严重影响了胰腺癌的治疗效果[12]。
近年来,吉西他滨已被公认为治疗晚期胰腺癌的化疗标准药物。吉西他滨是一种胞嘧啶核苷类似物,在多种酶的催化下生成吉西他滨二磷酸盐(dFd-CDP)和吉西他滨三磷酸盐(dFd-CTP)两种活性物质,两者协同作用减少DNA修复所需脱氧核苷酸的量,导致DNA链合成停止、DNA链断裂及细胞凋亡。另有研究显示,吉西他滨可诱导肿瘤细胞凋亡,但其机制尚不确切[13]。吉西他滨在胰腺癌治疗中可显著改善病人的生存质量,但是接受吉西他滨治疗的病人的中位生存期较短,其中,原发性和获得性耐药是导致吉西他滨单药治疗失败的主要原因[14]。本研究观察近期疗效发现,经2个疗程化疗的总有效率和疾病控制率分别为43.48%和63.04%,6个月、9个月和12个月病人生存率分别为70.65%、36.96%和15.21%。
MGMT是一种能够修复DNA损伤的DNA修复酶,是目前发现唯一的一种能修复O-6-甲基鸟嘌呤损伤的DNA甲基转移酶。此外,MGMT 还可以减轻烷化剂对细胞的不良反应,起到保护细胞作用[15]。MGMT 表达状态与多种恶性肿瘤的发生和侵袭有关[16-18]。已有研究显示,基于替莫唑胺化疗方案的疗效与 MGMT 在肿瘤组织中的表达状态相关,MGMT 阴性组病人化疗6个疗程的客观缓解率显著高于MGMT阳性组,MGMT阴性组病人的中位无进展生存时间显著长于MGMT 阳性病人[19],说明MGMT的表达与否可以用作胃肠胰神经内分泌瘤病人对替莫唑胺治疗反应的生物学指标。另有研究显示,胶质瘤组织中MGMT 阳性表达的病人中位生存时间低于阴性者,在不同级别胶质瘤的预后评价中具有重要意义。在本研究中,胰腺癌组织中MGMT阳性表达病人的临床总有效率和疾病控制率均显著低于MGMT阴性表达病人,9个月和12个月生存率均较MGMT阴性表达病人显著降低。
总之,肿瘤组织中MGMT表达水平对胰腺癌晚期病人接受吉西他滨化疗的临床疗效具有影响作用,胰腺癌组织MGMT阳性表达病人的近期临床疗效和远期临床疗效均较差,因此可考虑将胰腺癌组织MGMT表达水平作为评估吉西他滨治疗晚期胰腺癌临床预后的影响因素。

