短期氮添加对荒漠草原土壤微生物特征的影响
宋珂辰, 王 星, 许冬梅,2, 李永康, 撒春宁, 马 霜
(1.宁夏大学农学院,银川 750021;2.宁夏大学西北土地退化与生态恢复国家重点实验室培育基地,银川 750021)
土壤是一切陆地植物赖以生存的基础,也是陆地生态系统中最大的氮沉降承受者。在过去的一个世纪里,由于工业和农业的快速发展,全球氮沉降量增加了3~5倍。已有研究表明,短期或少量N沉降在一定程度上可缓解植物生长所受的N限制,但持续的外源氮输入会造成土壤养分流失,微生物群落结构改变和多样性的丧失的严重后果。土壤微生物具有生命周期短,生存环境敏感的特点,它们驱动土壤养分循环,并对土壤环境变化迅速做出反应,最终发生结构组成上的改变。王志瑞等、Zhao等认为,长期氮添加会降低土壤微生物生物量,但短期氮添加对土壤微生物生物量的影响至今仍没有一致的结论;Zhang等综合分析了来自全球的151项研究结果认为,氮添加降低了总微生物生物量、细菌生物量、真菌生物量、生物量碳和微生物呼吸,且这些负面效应随着氮的施用速率和试验时间的延长而增加。
土壤微生物驱动的氮素转化过程主要包括生物固氮和氨化、硝化、反硝化作用,固氮菌相关基因nifH、氨氧化古菌基因amoA—AOA、氨氧化细菌基因amoA—AOB和反硝化相关基因nirK被广泛应用于氮转化微生物的研究。Shi等研究发现,连续施氮6年后,中国亚热带森林土壤中AOA丰度显著增加,且施氮对AOA驱动的自养硝化存在潜在的促进作用。在内蒙古贝加尔针茅草原,低氮添加显著增加了nirK的相对丰度,高氮添加显著抑制了nirK的相对丰度。与以上研究结果不同,Zhang等分析了大量氮添加对土壤微生物影响的资料认为,氮添加对陆地生态系统中所有土壤微生物的生长、组成和功能均具有一定程度的负面影响,且随着氮沉降速率和持续时间的增加,影响愈发显著,结构方程模型表明,施氮对土壤微生物数量和组成的负面影响可能导致土壤微生物呼吸的减弱。在相关机制的研究方面,薛璟花等认为,过量氮沉降会减少土壤微生物量、真菌生物量和真菌/细菌生物量比率,改变土壤pH,进而导致微生物群落结构发生改变。土壤呼吸率、土壤酶活性的减少和微生物对底物的利用模式的改变也会导致微生物功能的改变。总体来说,氮添加对土壤微生物的影响和驱动因素存在很大不确定性,需要更多的研究验证和发现。
荒漠草原占宁夏天然草地面积半数以上,是典型的干旱生态系统,也是防风固沙、保持水土的重要生态屏障。目前,有关氮添加对荒漠草原土壤影响的研究主要集中在土壤结构及理化性质的方面,有关土壤微生物特征的研究还相对较少。为探究荒漠草原土壤微生物特征对短期氮添加的响应,本研究对不同氮添加量下荒漠草原土壤氨硝态氮含量、微生物数量进行了测定,对amoA—AOA、nirK基因进行了测序分析,并结合土壤环境因子的变化,探讨荒漠草原土壤微生物特征对短期氮添加的响应,以期为荒漠草原生态系统的保护和科学管理提供理论依据。
1 材料与方法
1.1 研究区概况
研究区位于宁夏东部的盐池县四墩子行政村(37°04′—38°10′N,106°30′—107°41′E),海拔1 430 m,地势为缓坡丘陵,土壤类型为灰钙土、淡灰钙土,土壤质地以沙壤、粉沙壤为主,属中温带大陆性气候、干旱、少雨、多风,昼夜温差大。年平均气温9.1 ℃,最热月(7月)平均气温23.9 ℃;当年降水量205.2 mm,较历年平均雨量偏少77.1 mm;年均无霜期180天,年均蒸发量1 231.5 mm,年均日照时间2 769 h。草地类型为荒漠草原,主要物种有草木樨状黄芪()、华北白前()、牛枝子()等。
1.2 试验设计
选取较为平坦的荒漠草原为研究对象,于2018年5月开始进行氮添加处理,参照国内外同类研究和当地的氮沉降量设5个施氮梯度,即N0、N1、N2、N3、N4,其纯氮添加量分别为0,2.5,5,10,15 g/(m·a),使用尿素(CO(NH))作为N源,将每个小区每次所需喷施的尿素溶解于等量水中,每月1次,分5次均匀喷洒在各小区内。按照处理水平的要求,对照小区(N0)喷洒相同量的水。试验采用随机区组设计,每个梯度重复3次,总计15个小区,每小区面积5 m×4 m,氮添加后各处理的土壤理化性质见表1。
1.3 植被调查与样品采集
2020年7月,在每个小区内随机选取3个取样点,用灭过菌的铲子分0—10,10—20 cm采集土壤样品,去除杂物及植物残体等,将同层的3个样品混合均匀,迅速装入灭菌袋中带回实验室。一部分用液氮冷冻后进行测序分析;另一部分置于4 ℃冰箱中保存,用于土壤生物学指标的测定;部分风干后过2 mm筛,用于土壤pH及养分指标测定。同时,用环刀分层采集土壤样品,用于土壤容重和含水率的测定。
2020年8月,在每个小区随机设置1个1 m×1 m的样方,调査植物群落物种组成,分种测定各个物种的生物量。其中,地上生物量以1 m样方中各物种的风干重量计测,根系生物量采用根钻法测定。
1.4 测定指标与方法
土壤理化性质的测定参照《土壤农化分析》,土壤容重()采用环刀法测定;土壤pH采用酸度计测定(土水比为1∶5)。土壤有机碳(SOC)采用Elemental rapid CS cube元素分析仪(德国Elementar公司)测定;土壤全氮(STN)采用KjeltecTM 8400全自动凯氏定氮仪(瑞典Foss公司)测定。土壤微生物量碳(MBC)和土壤微生物量氮(MBN)均采用氯仿熏蒸浸提法,MBC采用TOC—VCPH总有机碳分析仪(日本岛津公司)测定,MBN采用Auto Analyzer 3—AA3流动分析仪测定(德国Seal公司);土壤铵态氮(NH-N)和硝态氮(NO-N)均采用1mol/L的氯化钾浸提,Auto Analyzer 3—AA3流动分析仪测定。
土壤微生物数量采用平板涂抹培养计数法测定,以牛肉膏蛋白胨培养基培养细菌,马铃薯葡萄糖琼脂培养基(PDA)培养真菌,改良的高氏一号放线菌培养基培养放线菌。土壤氮转化微生物采用DNA测序方法测定。由上海天昊生物科技有限公司对样本进行DNA提取和质量检测(Nanodrop+琼脂糖电泳)、PCR扩增、文库构建和上机测序(Illumina 2×250 bp)。土壤固氮基因(nifH)、氨氧化古菌基因(amoA)和反硝化细菌基因(nirk)的定量扩增引物见表2。
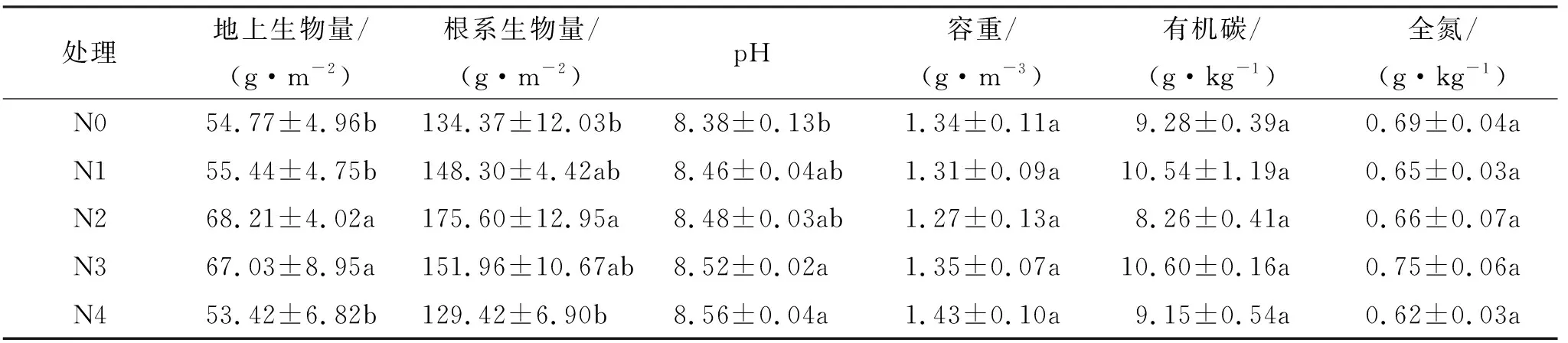
表1 不同氮添加处理下的土壤理化性质

表2 定量PCR扩增引物
1.5 数据统计与分析
采用Excel 2010软件对数据进行基础处理,SPSS 23软件进行数据的统计分析,Origin 2018和R软件进行制图;采用one-way ANOVA和Duncan法进行方差分析和多重比较。
2 结果与分析
2.1 氮添加对土壤微生物量碳、氮的影响
0—10 cm土层,MBC含量以N2处理草地最高,为180.17 mg/kg,N3处理草地最低,为142.01 mg/kg。氮添加显著降低了荒漠草原土壤MBN含量(<0.05),与N0相比,N1、N2、N3和N4处理草地土壤MBN含量分别降低了37.54%,38.11%,28.56%,29.81%,但各处理草地间差异不显著(>0.05)。10—20 cm土层,MBC含量以N3处理草地最高,为175.59 mg/kg,N0处理草地最低,为124.00 mg/kg(图1)。土壤MBN随氮添加量的增加呈波动性变化,N1处理草地的12.17 mg/kg显著高于N0处理草地的7.81 mg/kg(<0.05)。这说明氮添加主要对0—10 cm土层土壤微生物生物量产生影响,且土壤MBN对氮添加的敏感程度高于MBC。
2.2 氮添加对土壤微生物数量的影响
由表3可知,荒漠草原土壤微生物以细菌为主,约占微生物总量的68.86%~81.59%;其次为放线菌,约占微生物总量的17.42%~31.01%;真菌占微生物总量的比例最小,仅为0.05%~0.16%。氮添加显著抑制了荒漠草原0—10 cm土层土壤真菌、细菌的生长,但对放线菌的影响未达到差异显著性水平。0—10 cm土层,随氮添加量的增加,荒漠草原土壤真菌数量的变化范围为17.70×10~58.30×10cfu/g,呈逐渐下降趋势,N0、N1处理草地显著大于N3、N4处理草地(<0.05);细菌数量的变化范围为17.70×10~35.70×10cfu/g,N0处理显著大于N3处理(<0.05)。放线菌数量的变化范围为59.00×10~94.00×10cfu/g。10—20 cm土层,不同氮添加处理对荒漠草原土壤真菌、细菌、放线菌数量均无显著影响(>0.05)。

注:图柱上方不同小写字母表示相同土层不同施氮处理间差异显著(P<0.05);不同大写字母表示同处理不同土层间差异显著(P<0.05)。下同。
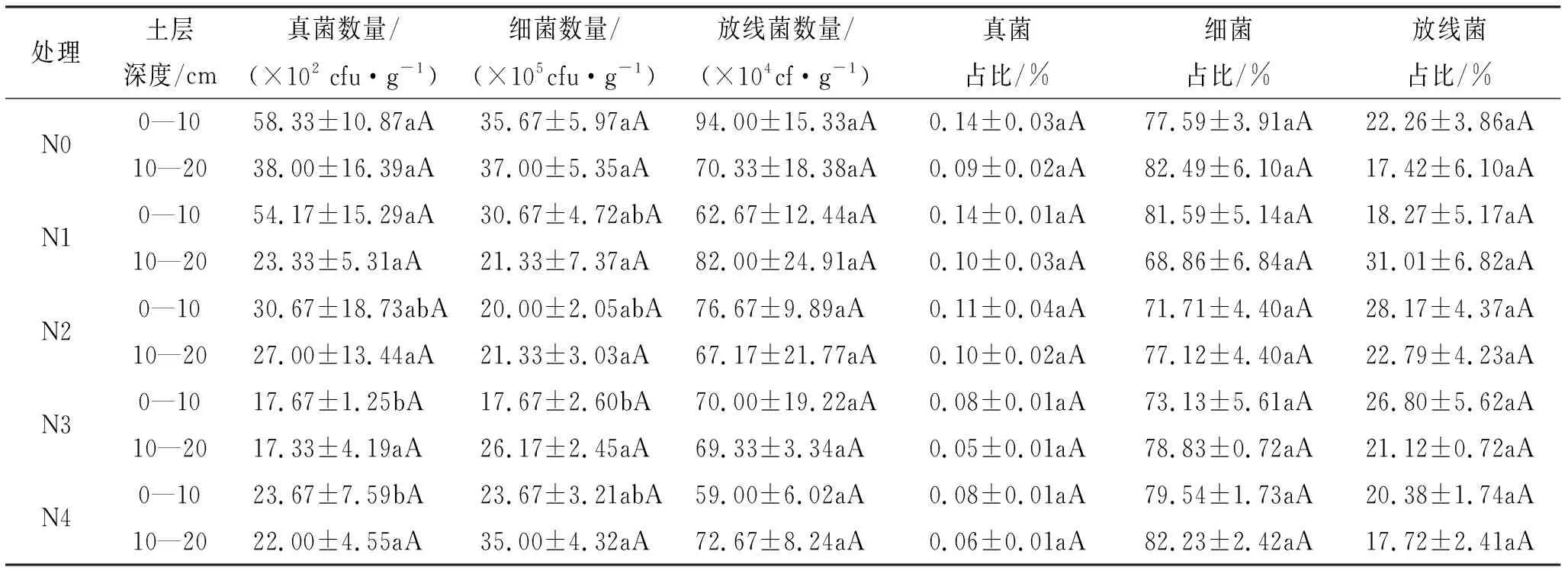
表3 氮添加对荒漠草原土壤真菌、细菌、放线菌数量及其占微生物总量的影响
2.3 氮添加对土壤氮转化微生物的影响
2.3.1 氮添加对土壤铵态氮、硝态氮的影响 由表4可知,氮添加增加了荒漠草原土壤NH-N含量,在0—10 cm土层,与N0相比,N1、N2、N3、N4处理草地土壤的NH-N含量分别增加了109.61%,136.52%,197.19%和198.88%;10—20 cm土层,NH-N含量增长较缓,N1、N2、N3、N4处理草地分别增加了4.71%,34.90%,96.47%和92.55%。从剖面变化看,N0处理草地10—20 cm土层NH-N含量显著高于0—10 cm土层(<0.05),其他氮添加处理草地均以0—10 cm土层最高,但与10—20 cm土层之间差异不显著。NH-N/STN的变化趋势与NH-N含量的变化趋势基本一致,在0—20 cm土层土壤中均以N4处理草地最高,显著高于N0和N1处理草地,N3处理草地显著高于N0处理草地(<0.05)。各处理草地0—10 cm土层土壤NH-N/STN总体高于10—20 cm土层,其间差异不显著(>0.05)。
随氮添加量的增加,荒漠草原0—10 cm土层土壤NO-N含量呈先上升后下降的变化趋势,变化范围为7.15~13.61 mg/kg,以N2处理草地最高,显著高于N0、N3、N4处理草地;NO-N/STN为1.23%~2.22%,N1处理草地显著高于N0、N3处理草地(<0.05)。10—20 cm土层土壤NO-N含量为3.59~7.47 mg/kg;NO-N/STN变化范围为0.43%~1.13%,N1处理草地显著高于N0处理草地(<0.05)。各氮添加处理草地中,土壤NO-N含量和NO-N/STN均表现为0—10 cm土层高于10—20 cm土层。荒漠草原土壤NO-N主要分布在0—10 cm土层,且在低氮添加条件(N1、N2)下含量最高。
2.3.2 氮添加对荒漠草原土壤氮转化微生物丰度的影响 对不同氮添加水平下荒漠草原0—20 cm土层土壤的amoA区微生物进行高通量测序,共获得1 151 411条高质量序列,每个样品的序列数为39 653~108 247条。供试土壤样品中共检测到2个古菌门,每个古菌门下均检测到1个古菌种,其中,泉古菌门的泉古菌()为优势菌,相对丰度占监测基因总数的99.93%以上。奇古菌门的奇古菌()含量极低,占0.05%左右(表5)。

表4 氮添加对荒漠草原土壤氨态氮、硝态氮的影响

表5 不同氮添加处理下荒漠草原土壤amoA基因丰度变化 单位:%
对不同氮添加水平下,荒漠草原0—20 cm土层土壤的nirK区微生物进行高通量测序,分别从科、属、种3个层次对其丰度进行分析发现,供试土壤中共检测出8个细菌科,11个细菌属,25个细菌种。在检测到的所有细菌中,不同氮添加处理下相对丰度均大于1%的细菌有3种(表6),分别为根瘤菌科、大豆根瘤菌属中的中华根瘤菌(1),相对丰度为78.21%~93.01%,慢生根瘤菌科、大豆根瘤菌属中的大豆根瘤菌(471),相对丰度为2.02%~16.39%,产碱杆菌科、无色杆菌属中的无色杆菌(),相对丰度为2.35%~5.26%。对占优势的中华根瘤菌的相对丰度比较发现,随氮添加量的增加,中华根瘤菌的丰度总体呈下降趋势,但不同处理之间差异不显著(>0.05)。
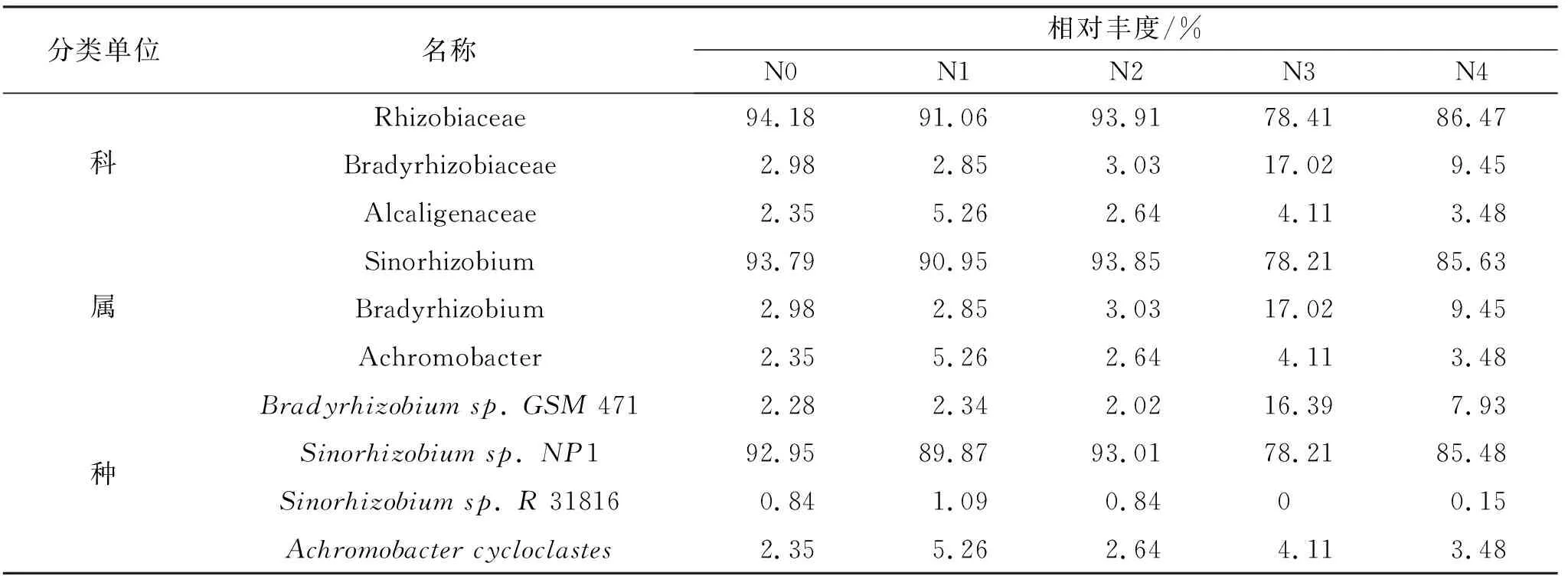
表6 科、属、种水平上的nirK区微生物丰度
2.3.3 氮添加对荒漠草原土壤氮转化微生物多样性的影响 Shannon、Simpson、Chao1、ACE均为反映土壤微生物多样性的指数。由图2可知,随氮添加量的增加,荒漠草原土壤amoA区基因微生物的Shannon、Chao1指数总体呈下降趋势;Simpson指数和ACE指数波动性变化。由图3可知,nirK区基因微生物的Shannon、Chao1、ACE、指数总体呈上升趋势,Simpson指数呈下降趋势。但amoA区和nirK区基因微生物的多样性指数在不同处理草地之间均无显著差异(>0.05)。
2.3.4 氮添加对荒漠草原土壤氮转化微生物β多样性的影响 不同氮添加量处理下amoA区和nirK区(图4)微生物OTUs相对丰度的PCoA分析结果显示,前2个主成分对amoA区微生物群落变异的贡献率分别为74.02%和24.50%,累计贡献率98.52%。高氮添加处理(N4)主要位于PC1右侧,而对照(N0)与低、中氮添加处理(N1、N2和N3)主要位于PC1左侧,并与高氮添加处理(N4)有显著差异,说明高氮添加下的荒漠草原土壤amoA区微生物群落组成发生了明显的变化。

注:框图中□表示均值;表示25%~75%;表示1.5IQR内的范围;——表示中位线;◇表示异常值。下同。

图3 氮添加对荒漠草原土壤nirK区基因微生物多样性指数的影响
前2个主成分对nirK区微生物群落变异的贡献率分别为76.89%和14.27%(图4)。其中,N3、N4处理分布于PC1两侧,N0、N1、N2处理全部位于PC1左侧,且重合区域较多,说明N0、N1和N2处理草地的丰度组成相似,高氮添加处理(N3、N4)对荒漠草原土壤nirK区微生物群落产生了较为显著的影响。
2.4 土壤微生物特征与土壤环境因子的相关关系
由表7可知,土壤NH-N含量与土壤pH、amoA—AOA优势菌丰度呈极显著正相关关系;与nirK优势菌丰度呈极显著负相关关系(<0.01),与真菌数量(FM)呈显著负相关关系(<0.05)。土壤amoA—AOA优势菌丰度与nirK优势菌丰度呈极显著负相关关系(<0.01),与细菌数量(BM)呈显著负相关关系(<0.05)。土壤pH与amoa—AOA优势菌丰度呈极显著正相关关系(<0.01),与nirK优势菌丰度和FM呈显著负相关关系(<0.05)。说明影响amoA—AOA和nirK优势菌丰度的主要因素有土壤真菌数量、细菌数量、pH和NH-N含量,且土壤pH、NH-N含量对土壤真菌数量有显著影响。

图4 不同氮添处理荒漠草原amoA区和nirK区微生物丰度的PCoA图
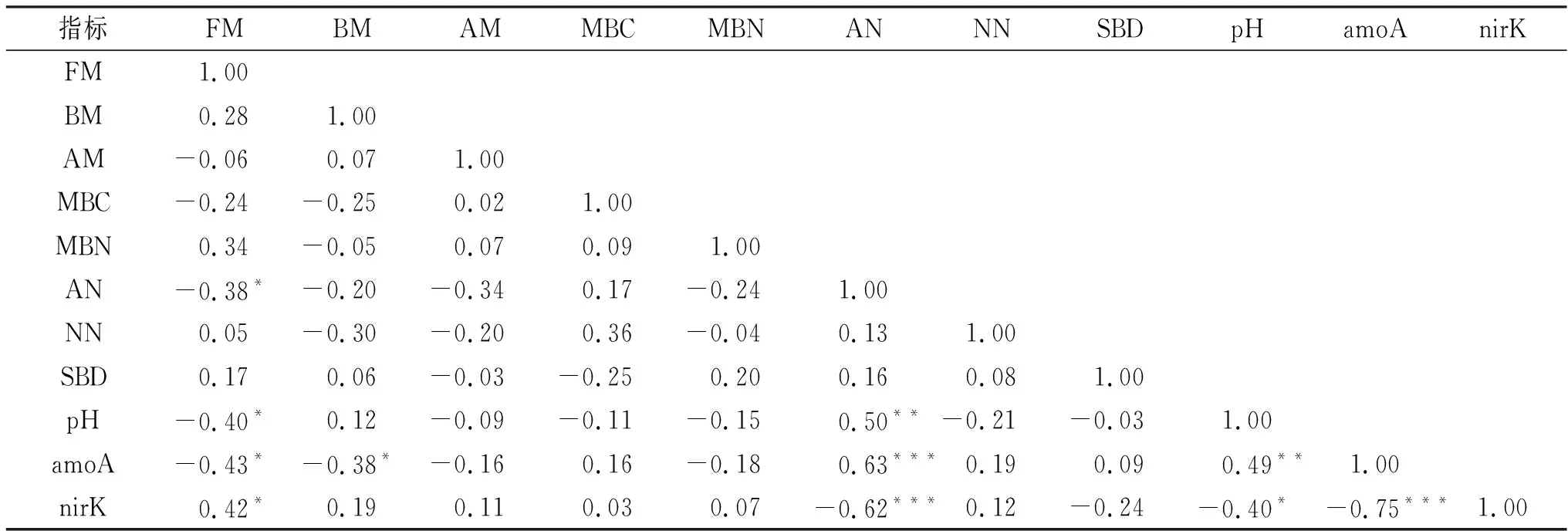
表7 土壤微生物特征与土壤环境因子的相关关系
3 讨 论
3.1 氮添加对荒漠草原土壤微生物量碳、氮及微生物数量的影响
土壤微生物生物量指土壤微生物体内的碳、氮总和,是评价土壤生物学性状和养分状况的常用指标。本研究中,氮添加显著降低了0—10 cm土层土壤真菌数量和MBN含量,此结果与Zhou等的研究结果基本一致,真菌群落的生物量C∶N显著高于细菌群落,而氮添加可能减少真菌群落生物量,进而降低土壤微生物量。土壤真菌数量的下降可能与土壤性质的改变和养分的不均衡分配相关,细菌比真菌更适宜碱性土壤环境,氮添加导致土壤pH的增加对真菌的发育更为不利,本研究相关分析中,土壤真菌数量与pH、铵态氮的负相关关系也证实了这一结论。但氮素不是影响土壤微生物生物量的唯一因子,当氮添加量增加时,过量的氮输入可能造成土壤氮饱和,使土壤微生物受到pH、水分、SOC等因子的制约,造成MBC含量不显著变化。从剖面变化上看,本研究0—10,10—20 cm土层MBC、MBN含量没有显著差异,但多数研究认为,表层土壤中含有更多的植物凋落物和有机质,可用于促进土壤微生物的生长,故无论添加氮素与否,0—10 cm土层MBC、MBN含量都应高于10—20 cm土层,原因可能是荒漠草原植被稀疏,表层土壤风蚀严重、蒸发强烈,植物凋落物等输入表层土壤的有机质较少,加之土壤结构松散,保水保肥能力差,养分流失和水分蒸发的双重限制降低了荒漠草原土壤表层的微生物量。
3.2 氮添加对荒漠草原土壤氮转化微生物的影响
氮添加增加了土壤无机态氮含量,有利于微生物的生长,同时会使土壤微生物数量下降、活性降低。尿素能够分解释放铵根离子,增加土壤中铵态氮含量,在微生物群落的驱动下发生硝化反应,有研究认为,氮添加会增加土壤中NH-N和NO-N含量,并促进土壤氨化和硝化作用。本研究中随氮添加量的增加,荒漠草原土壤NH-N含量逐渐增加,但NO-N含量先增加后减少,此结果与上述研究结果部分相同,但存在一定差异。一是适宜浓度的氮添加可以补充受氮素限制生态系统中的氮素,但添加量的增加可能会使植物群落对无机氮的需求达到饱和,若受氮素限制的生态系统能够有效地固定外源氮素,并且植物有较强的吸收利用能力,则多数进入土壤的NH-N和NO-N会被植物吸收而退出土壤生态系统;二是植物会优先吸收土壤中的NO-N作为生长发育所需的养分,从而降低土壤中NO-N的净剩余量;三是相较于带正电荷的NH-N,带负电荷的NO-N更容易通过淋溶作用而损失。
氮添加会改变土壤固氮菌、硝化菌、反硝化菌的群落结构,并在分子水平上影响土壤细菌种群。PCoA分析显示高氮添加处理(N3、N4)对荒漠草原土壤amoA区、nirK区微生物的群落结构均有显著改变。其原因为荒漠草原气候干旱、土壤贫瘠,微生物活性较低,而氮添加增加了土壤中的有效氮含量及土壤碳氮比,改变了氨化、硝化作用的有机底物,促进了amoA丰度和nirK多样性的增加;高氮添加具有的毒害作用对氮转化各环节及相关功能微生物产生了不同的影响,可能造成了nirK丰度和amoA物种多样性的降低,并改变了amoA和nirK的群落结构。
氮添加下土壤微生物特征的变化可能与土壤理化性状的变化相关。由氮添加下土壤pH与土壤NH-N含量、amoA—AOA优势菌丰度、nirK优势菌丰度、真菌数量的显著相关关系推测,氮添加可以通过对土壤微生物群落的直接影响及土壤pH等环境因子的间接影响改变土壤氮转化过程,且氮添加导致的土壤pH变化可能是造成土壤微生物群落变化的主要因素之一。
4 结 论
(1)氮添加显著增加了荒漠草原土壤的铵态氮含量,同时降低了0—10 cm土层土壤真菌数量和微生物量氮含量(<0.05)。
(2)与N0相比,低氮添加处理(N1、N2)的荒漠草原土壤含有较多的硝态氮和微生物量碳氮,氮转化微生物的优势菌丰度较高,且群落结构无明显改变,高氮添加处理(N3、N4)的荒漠草原土壤铵态氮含量较高,但氮转化微生物群落结构发生了显著改变。

