双萘酰亚胺衍生物用于检测水溶液中的苦味酸
赵永梅,穆叶舒,洪 琛,罗 稳,田智勇
(1.河南应用技术职业学院制药工程学院,开封475004;2.河南大学药学院,3.天然药物与免疫工程重点实验室,4.淮河医院,开封475004)
硝基芳烃类炸药对公共安全、人类健康和自然环境的危害极大,对此类爆炸物的检测十分重要[1].在硝基芳烃类炸药中,2,4,6-三硝基甲苯(TNT)和2,4,6-三硝基苯酚(TNP)的应用最广泛,包括炸药、烟花、火柴、制药和染料等领域[2].TNT和TNP的广泛使用导致其在自然界中残留量较大,不可避免地对人类和环境造成危害.尤其是TNP(又称苦味酸),其在水中的溶解度比TNT高,更容易被人体和动物吸收,从而引起严重的疾病[3].然而,与其它炸药相比,人们对TNP的关注较少.因此,有必要开发一种快速、灵敏、便捷的方法来检测TNP,特别是检测水相中的TNP.
迄今,已经有一些文献报道了可用于检测TNP的材料,包括石墨相氮化碳[4,5]、碳量子点[6~8]、聚合物[9~12]和金属有机框架等[13~17].然而这些材料大多性质稳定,在自然界中不易降解,会对环境和生物体产生蓄积毒性,因此其应用存在一定限制.相比之下,有机荧光纳米粒子(FONs)因其反应灵敏、制备简单和低成本的优点而备受关注,特别是有机分子与生物体具有良好的相容性,更容易被降解,减少了蓄积毒性,更具有应用潜力[18,19].近年来,关于利用FONs检测TNP的研究已经取得了一些良好的结果,但将FONs用于检测水相中的TNP仍然面临挑战[20].
传统的有机荧光小分子在水溶液中容易发生“聚集引起的猝灭”(ACQ)[21].而唐本忠院士发现的一些在聚集态有强荧光的“聚集诱导发射”(AIE)或“聚集诱导增强发射”(AIEE)[22]小分子,为在水相中进行荧光检测提供了可能.
萘酰亚胺类化合物具有良好的荧光性质和生物活性,广泛应用于医药、生物、化学和材料等领域[23~26].例如安奈菲特、米托萘胺和依利奈法德[图1(A)~(C)]都曾进入临床用于肿瘤治疗,其中安奈菲特近期再次进入III期临床试验用于治疗继发性急性髓细胞白血病[27].本课题组曾报道了一些具有靶向亚细胞器和抗肿瘤活性的新型萘酰亚胺衍生物[图1(D)~(E)][28,29],在后续评价时发现部分化合物显示出了AIEE效应.本文报道了一种新的双萘酰亚胺衍生物Bis-Nph[图1(F)]用于水相中TNP的检测.Bis-Nph是受体(A)-供体(D)-受体(A)型分子,其中受体为1,8-萘酰亚胺单元,供体由苯环单元组成,其发射归因于1,8-萘酰亚胺单元到苯环的分子内电荷转移(ICT).TNP可以使Bis-Nph质子化,导致其与TNP阴离子之间发生强的静电相互作用,从而阻碍ICT效应,导致荧光猝灭.Bis-Nph的合成路线如Scheme 1所示.
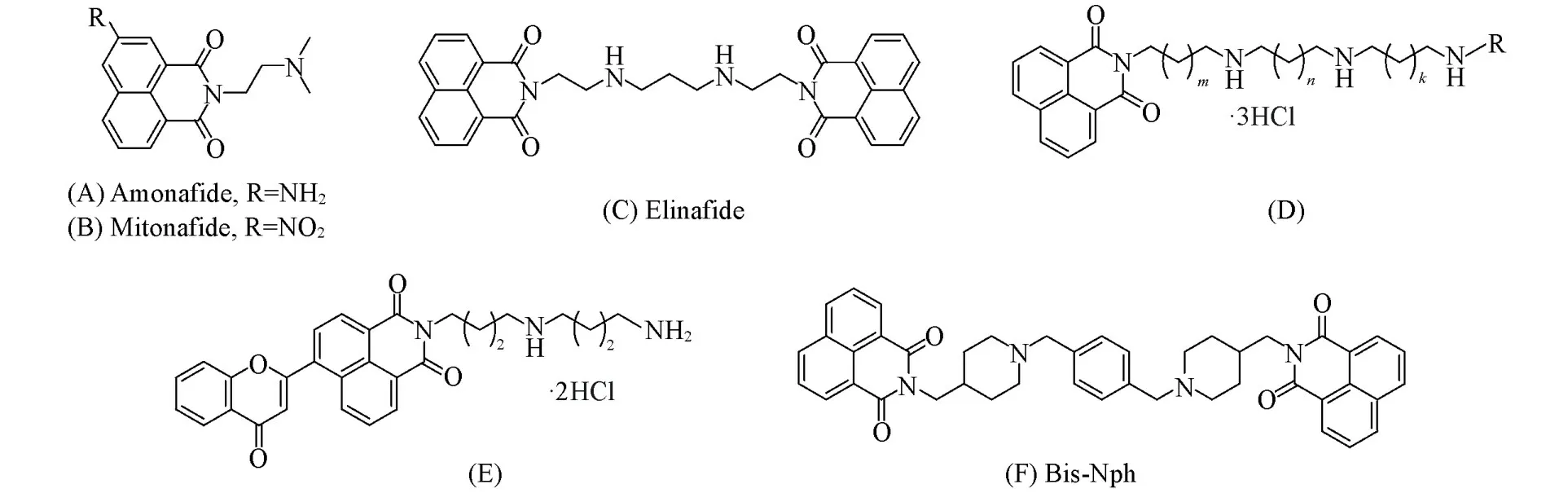
Fig.1 Chemical structures of Amonafide(A),Mitonafide(B),Elinafide(C),our previous compounds(D,E)and Bis⁃Nph(F)
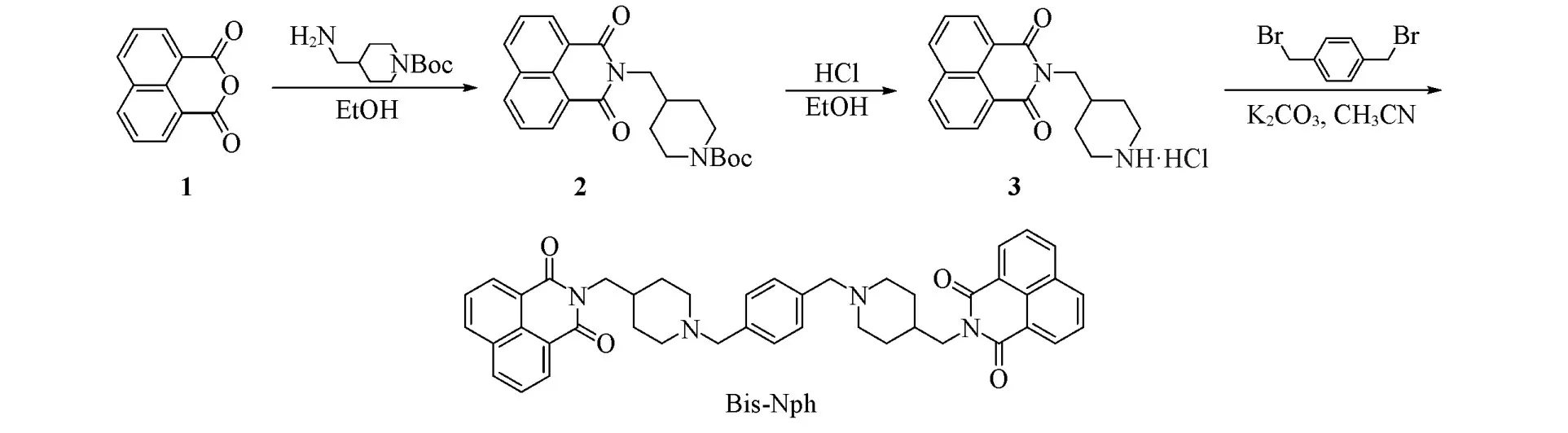
Scheme 1 Synthetic route of Bis⁃Nph
1 实验部分
1.1 试剂与仪器
硅胶(200~300目)购自青岛海洋硅胶厂;1-Boc-4-(氨基甲基)哌啶(纯度97%)和1,4-二(溴甲基)苯(纯度97%)购自上海阿拉丁试剂公司;TNT的甲醇溶液(1.00 mg/mL)和DNT的甲醇溶液(1.00 mg/mL)购自麦克林试剂公司;TNP的乙腈溶液(100µg/mL)购自德国DRE公司;其它试剂均为市售分析纯,未做进一步处理.
DPX-300型超导核磁共振波谱仪(1H NMR,13C NMR,瑞士Bruker公司),以四甲基硅烷(TMS)为内标;Esquire3000型质谱仪[MS,电喷雾模式(ESI),美国Bruker公司];1260-6230型高精度飞行时间质谱仪(HRMS,ESI,美国安捷伦公司);LC-20AB型高效液相色谱仪(HPLC,日本岛津公司);FS5型荧光光谱仪(PL,英国爱丁堡公司);X-6型显微熔点仪(温度未校正)(上海精密仪器公司);WFH2204B型手提式紫外灯(UV,上海精科仪器公司).
1.2 化合物的合成
1.2.1 中间体2的合成 将萘二甲酸酐(1,2.0 mmol)与1-叔丁氧羰基-4-氨甲基哌啶(0.43 g,2.0 mmol)加入到30 mL无水乙醇中,于80℃加热回流5 h;冷却至室温,蒸干溶剂;向残余物中加入50 mL氯仿,用2 mol/L的稀盐酸洗涤3次,每次30 mL;有机相用无水硫酸钠干燥,蒸干溶剂,得到0.67 g白色固体2,产率85%.
1.2.2 中间体3的合成 将中间体2(2.0 mmol)加入到10 mL无水乙醇中,冰浴下加入5 mL 4 mol/L的盐酸乙醇溶液(V浓盐酸∶V乙醇=1∶2),搅拌1 h后撤去冰浴,自然升至室温,继续搅拌12 h.反应完毕减压蒸除溶剂,硅胶柱层析(V二氯甲烷∶V甲醇=50∶1)得0.48 g白色固体3,产率82%.1H NMR(300 MHz,D2O),δ:7.67(s,2H),7.64(s,2H),7.22(t,J=7.8 Hz,2H),3.55(d,J=6.6 Hz,2H),3.39(d,J=12.9 Hz,2H),2.90(t,J=12.6 Hz,2H),1.89~1.74(m,3H),1.51~1.38(m,2H).HRMS,m/zcalcd.for C18H18N2O2[M+H]+:295.1447;found:295.1461.
1.2.3 化合物Bis-Nph的合成 将中间体3(2.1 mmol)、1,4-二(溴甲基)苯(1.0 mmol)和无水碳酸钾(4.0 mmol)加入到30 mL乙腈中,于60℃搅拌反应6 h.反应结束冷却至室温,过滤,滤饼用乙腈洗涤3次.合并滤液,浓缩,剩余物用硅胶柱层析(V二氯甲烷∶V甲醇=30∶1)分离,得1.02 g白色固体,收率74%.m.p.:244.5~246.2℃.1H NMR(300 MHz,CDCl3),δ:8.59(d,J=7.2 Hz,4H),8.22(d,J=8.1 Hz,4H),7.76(t,J=7.8 Hz,4H),7.26(s,4H),4.14(d,J=6.9 Hz,4H),3.51(s,4H),2.91(d,J=11.1 Hz,4H),2.08~1.88(m,6H),1.71(d,J=11.4 Hz,4H),1.62~1.50(m,4H).13C NMR(75 MHz,CDCl3),δ:164.46,133.88,131.57,131.29,129.12,128.18,126.94,122.63,62.79,53.19,45.27,35.04,29.98.MS(ESI),m/z:691.25[M+H]+.HRMS(ESI),m/zcalcd.for C44H42N4O4:691.3284;found:691.3287[M+H]+;purity:95.7%(HPLC).
1.3 紫外和荧光光谱测试
向一系列测试管中加入适量Bis-Nph储备液(用DMSO溶解,10 mmol/L)和一定体积的检测物储备液(用超纯水或DMSO溶解,10 mmol/L),用超纯水和THF(体积比7∶3)的混合溶液稀释,摇匀后放置15 min.将样品液加入到石英比色皿中,记录紫外-可见吸收光谱和荧光光谱.
1.4 试纸制备和检测
将普通定性滤纸用20µmol/L的Bis-Nph溶液(V水∶VTHF=9∶1)浸泡3 h,取出后真空干燥,用玻璃板压平备用.将市售TNP的THF溶液置于烧杯中挥发至干,将烧杯底部粉末按压在试纸上,在紫外灯下(365 nm)观察并拍照.另取TNP溶液,蒸干后加入少量自来水溶解,稀释到待测浓度备用,用直径0.3 mm的薄层层析(TLC)点样毛细管轻轻沾取样品,迅速点至试纸上,吹干后在紫外灯下观察拍照.
1.5 细胞毒性测试
采用噻唑蓝(MTT)法测试化合物对细胞存活率的影响.取对数生长周期的细胞株,调整细胞数为5×103cell/mL加入到96孔板中,随后在培养板中加入不同浓度的化合物,每个浓度4个复孔,在37℃,含5%CO2的恒温箱中培养48 h.然后,每孔加入50µL MTT溶液(1 mg/mL),继续孵育4 h.除去上清液后,加入100µL DMSO在室温下溶解晶体产物15 min.用酶标仪测试570 nm处的吸光度.根据抑制率=(A对照-A样品)/(A对照-A空白)×100%计算不同浓度下的抑制率,实验重复3次,结果取平均值.
2 结果与讨论
2.1 目标化合物的合成
以1,8-二萘甲酸酐和1-叔丁氧羰基-4-氨甲基哌啶为起始原料,在无水乙醇中加热回流生成中间体2,蒸干萃取后可直接用于下一步反应.中间体2经稀盐酸脱保护生成盐酸盐3,快速柱层析后可得到纯品,产率较高.盐酸盐3与1,4-二(溴甲基)苯在碱的作用下发生亲核取代反应,化学计量比应略大于2∶1,这样可以避免单取代产物的生成.所得目标产物Bis-Nph为新化合物,未见文献报道.其结构通过1H NMR、13C NMR及HRMS确证,纯度通过HPLC测定.
2.2 光谱学性质
萘酰亚胺类具有强荧光发射,常作为报告基团用于检测金属离子和生物分子等.通过测试Bis-Nph的吸收光谱和发射光谱可以看出,室温下Bis-Nph在不同溶剂中的吸收带均位于340 nm附近,在纯水中的紫外吸收红移且变宽,表明发生电子跃迁需要的能量减小,是分子间距变小、共轭程度增加造成的[图2(A)].Bis-Nph的荧光发射随着溶剂极性的增加而明显增强[图2(B)],是典型的分子内电子转移(ICT)效应.由于酰胺基团的吸电子作用,Bis-Nph在THF和CHCl3中的最大发射波长较短(380 nm),随着溶剂极性的增加,最大发射波长发生了红移(395 nm).另外,水相中Bis-Nph分子可能发生了构象转变,导致萘酰亚胺单体发射(~395 nm)转换为激基缔合物发射(~495 nm)[图2(B)][30].肉眼可见Bis-Nph在纯水中发出蓝色荧光,亮度明显强于在其它有机溶剂中的(图S1,见本文支持信息).在石油醚(PE)、四氢呋喃(THF)、氯仿、乙腈、乙醇、水中Bis-Nph的荧光量子产率分别为0.01%,0.02%,0.03%,0.03%,0.03%和0.26%(以硫酸奎宁为标准,Φf=0.55%).
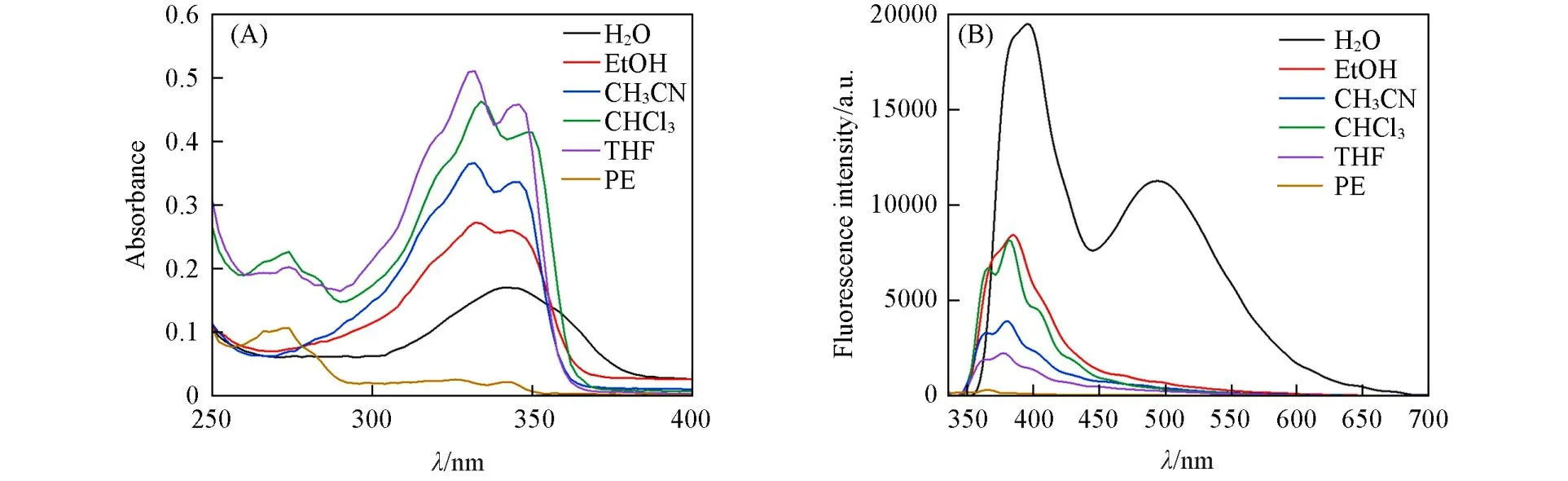
Fig.2 UV(A)and FL(B,λex=330 nm,slit:2.0/0.5 nm)spectra of Bis⁃Nph(20µmol/L)in different solvents
由于Bis-Nph在THF中的荧光较弱,通过向Bis-Nph的THF溶液中加入不同比例的水来评价Bis-Nph的AIEE性质.从图3(A)可以看出,随着水的体积分数(fw)增加,化合物的紫外吸收逐渐降低,表明体系中溶解的Bis-Nph越来越少,同时最大吸收发生了红移且变宽,表明分子间距变小,共轭程度增加,发生了聚集.由图3(B)和图4可以看到,在392 nm处,当fw从0增加到50%时,Bis-Nph的荧光强度显著增加;当fw达到70%时,荧光强度达到最大值,是初始强度的30倍,表明分子的聚集减少了分子内的非辐射跃迁,导致发射增强;当fw从70%提高到100%时,Bis-Nph在392 nm处的荧光强度降低.而490 nm处的荧光强度则是随着fw的不断升高而逐渐增强,表明形成的激基缔合物不断增加,分子内的辐射跃迁增多,从而抵消了部分AIE荧光强度.
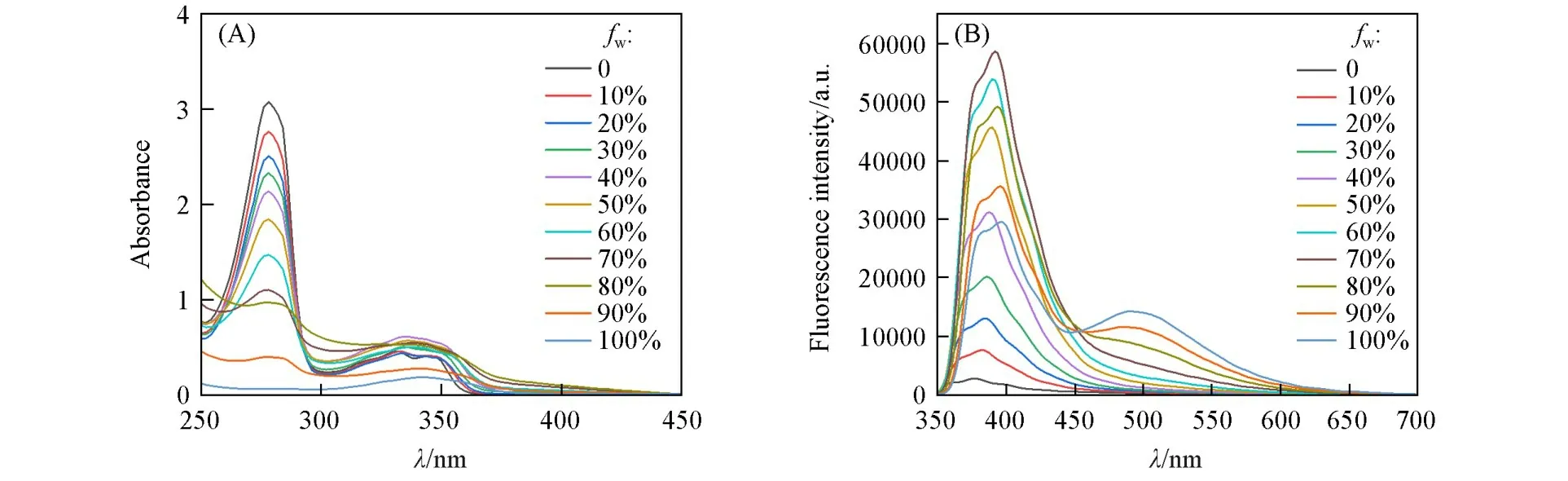
Fig.3 UV(A)and FL(B,λex=335 nm,slit:2.0/0.5 nm)spectra of Bis⁃Nph in THF/water mixtures
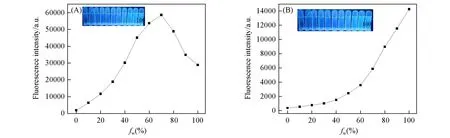
Fig.4 FL intensities of Bis⁃Nph(20µmol/L)at 392 nm(A)and 490 nm(B)versus the water fraction in THF/water mixtures

Fig.5 Tyndall effect of Bis⁃Nph(20µmol/L)in dark(A)and white light(B)in different solvents
由于Bis-Nph可能在水相中发生团聚形成纳米颗粒,其溶液应该具有丁达尔现象.用激光笔透过不同溶剂的Bis-Nph溶液(图5),可以看到在以纯水为溶剂的溶液形成了一条明亮的绿色光带,而在其它溶剂中绿色光带几乎不可见,证明Bis-Nph在水中形成了纳米颗粒.另外,采用激光粒度仪测试纯水中Bis-Nph的平均粒径为467.0 nm(图S2,见本文支持信息).

Fig.6 Photographs of Bis⁃Nph in THF under UV lamp(365 nm)(A),powder under the daylight(B)and UV lamp(365 nm)(C)
具有AIE效应的分子在溶液中的荧光强度会随着其浓度增大而增强,其原因是浓度增大导致分子间距离变小,使分子内旋转受限,受到激发后非辐射跃迁减少,因此荧光更强.用THF配制不同浓度的Bis-Nph溶液,在暗箱式紫外灯下(365 nm)进行肉眼观察[图6(A)],发现当Bis-Nph的浓度在1~100µmol/L时荧光较弱,当浓度为1 mmol/L和10 mmol/L时,肉眼可见亮度明显增强并在浓度为10 mmol/L时达到最亮.当浓度继续增大时,化合物因无法溶解而出现大量黄色固体.另外,Bis-Nph的固体粉末在紫外灯下也发出明亮荧光[图6(C)].经测试其固态荧光量子产率为3.11%(图S3,见本文支持信息),荧光寿命为0.36 ns(图S4,见本文支持信息).
2.3 对TNP的识别
通过向Bis-Nph溶液(V水∶VTHF=7∶3)中加入TNP溶液后记录紫外和荧光光谱考察了Bis-Nph对TNP的响应,结果见图7.向Bis-Nph溶液中加入TNP溶液后,340 nm处的紫外吸收明显增强,且肉眼可见溶液颜色由无色变为淡黄色.溶液的荧光强度在加入TNP后显著降低,加入浓度为200µmol/L的TNP后荧光猝灭效率为92.8%.
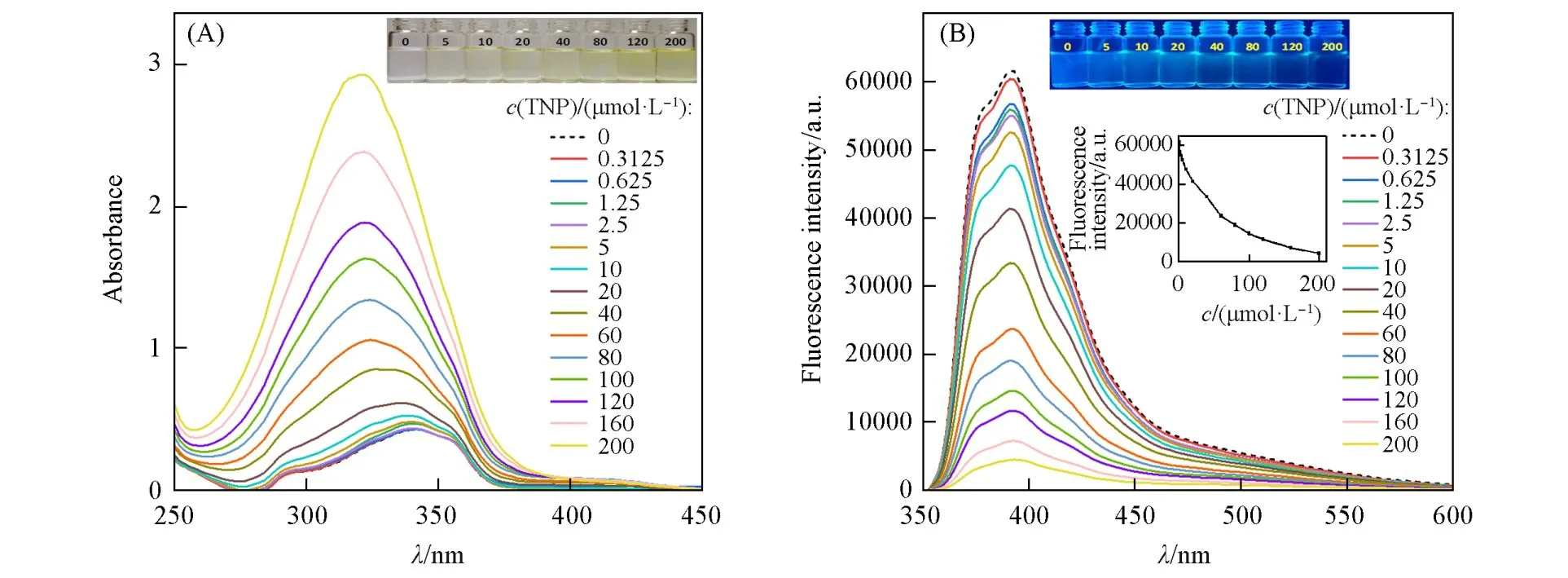
Fig.7 UV(A)and FL(B)spectra and relative photographs(insets)of Bis⁃Nph(20µmol/L)with the change of TNP concentrations(0—200µmol/L)
荧光静态猝灭常数(Ksv)是评价传感器的重要因素,可根据Stern-Volmer方程I0/I=1+Ksv[Q]计算得到.其中I0和I分别为未加和加入检测物时的荧光强度,[Q]为检测物的浓度.根据方程计算得到Ksv为5.34×104L/mol(图S5,见本文支持信息).当TNP浓度在0~80µmol/L范围内时,识别具有较好的线性关系(R2=0.9845),根据检出限(LOD)=3SB/m[其中SB为空白测量值的标准偏差,m为荧光强度与样品浓度关系线的斜率(图8)]计算出LOD为5.8×10−7mol/L,与文献[31~34]报道的值相近,但这些文献中报道的有机小分子探针都是在非水或含少量水的溶液中进行检测的(表S1,见本文支持信息),限制了它们的实际应用.
由于在实际生产过程中不可避免地会接触到TNP,例如爆炸装置的制备和包装,会导致少量TNP残留在人的皮肤和衣物中,因此开发一种简单、快速、低成本的检测方法十分必要.为此,我们制作了一种简便的试纸进行了TNP残留的快速检测.将滤纸浸入到Bis-Nph溶液中,真空干燥,在365 nm紫外灯下可以看到未浸泡的滤纸无荧光[图9(A)],而浸泡过滤纸的有明显的蓝色荧光[图9(B)].将手指沾上微量TNP,并在滤纸上按压数秒,紫外灯下可以清楚地观察到暗斑[图9(C)].另外,用试纸可以检测自来水中的TNP,肉眼可分辨的最低浓度为0.50 mmol/L,优于文献报道结果[10](图S6,见本文支持信息).
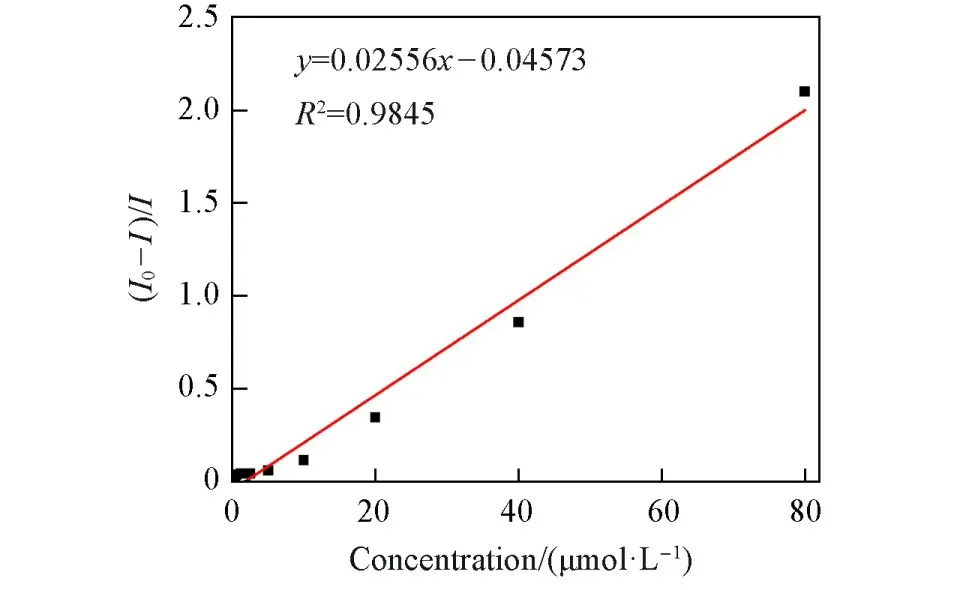
Fig.8 Plot of the linear relation for the recognition of Bis⁃Nph to TNP

Fig.9 Photos of filter paper under UV light at 365 nm
2.4 对TNP的选择性
选择性是评价探针性能的一个重要指标.为了验证探针Bis-Nph识别TNP的选择性,进行了探针对常见的爆炸物如TNT、DNT、硝酸甘油(NG)以及硝基苯(NB)的选择性实验.当向探针溶液(20µmol/L,V水∶VTHF=7∶3)中加入2倍化学计量的各种待检测物后,发现加入TNP后的荧光强度降低了64%,而加入其它待检测物后荧光强度无明显变化(<17%),表明探针Bis-Nph对TNP的识别具有选择性[图10(A)].
为了进一步证明探针Bis-Nph在其它爆炸干扰物存在下仍对TNP有较高的选择性,进行了干扰试验.在过量的干扰物(40µmol/L)存在下,记录了探针Bis-Nph(20µmol/L)识别TNP(40µmol/L)的荧光强度[图10(B)].可见,在干扰物存在的情况下,加入TNP后,溶液的荧光强度仍然明显降低(>54%),表明Bis-Nph对TNP的识别不受其它爆炸干扰物的影响.
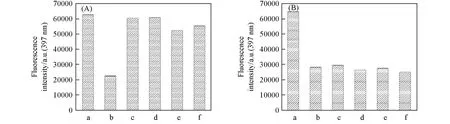
Fig.10 Selectivity(A)and anti⁃interference(B)of compound Bis⁃Nph to TNP
2.5 识别机理研究
利用1H NMR结果可以阐释Bis-Nph与TNP之间的相互作用,但由于市售TNP为溶液,且含量较低(100µg/mL),不足以进行1H NMR实验,因此采用对硝基苯酚替代TNP进行机理研究.向Bis-Nph的CDCl3溶液加入对硝基苯酚后,a和c位置的质子信号向高场位移了0.02,b位置的质子信号(Ar-H)向高场位移了0.03(图11,图S7,见本文支持信息),表明对硝基苯酚可以使Bis-Nph质子化,导致其与对硝基苯酚阴离子之间发生了强的静电相互作用,从而阻碍了Bis-Nph分子的ICT效应,导致其荧光发生猝灭.
2.6 细胞毒性
采用MTT法测试了化合物Bis-Nph对肝癌细胞HepG2和嗜铬细胞瘤PC12的体外毒性,结果(图12)显示,Bis-Nph在浓度为1µmol/L和5µmol/L时对两种细胞的生存活力基本无影响,浓度高于5µmol/L时显示出较弱的抑制作用,浓度为50µmol/L时两种细胞株的生存活力仍接近60%,表明化合物在测试浓度下的细胞毒性较低.由于化合物在高浓度(100µmol/L)下无法完全溶解,会从培养基中析出,因此无法进行高浓度的细胞毒性测试.
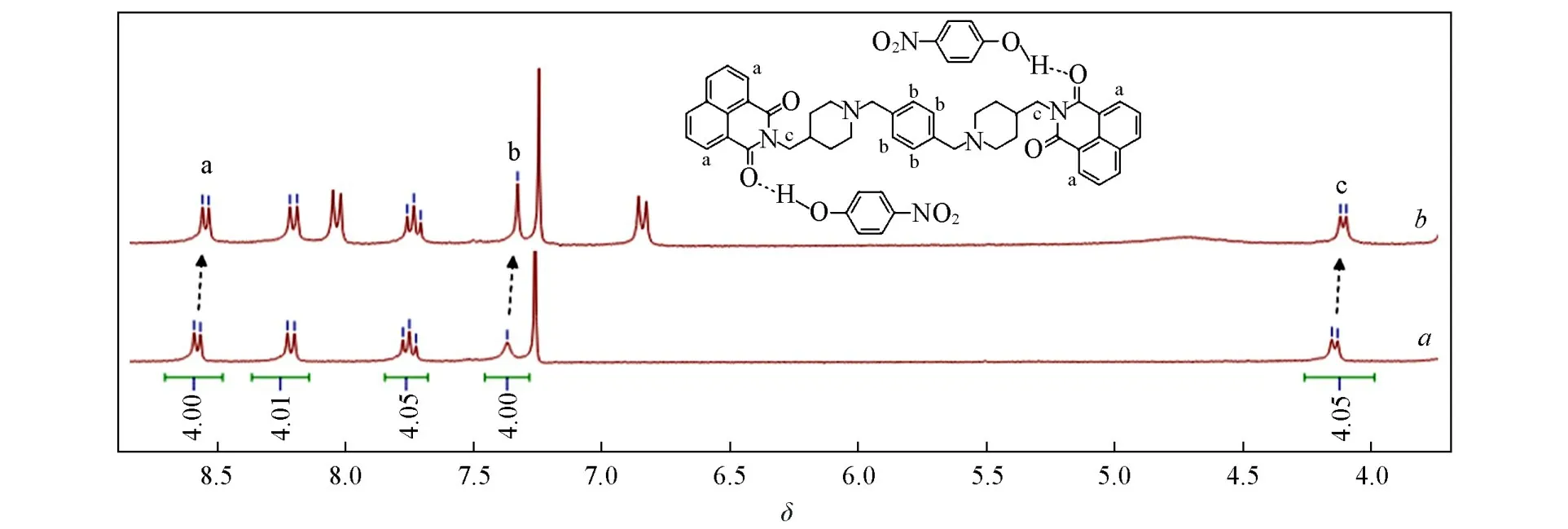
Fig.11 1H NMR spectra of Bis⁃Nph before(a)and after(b)adding p⁃nitrophenol
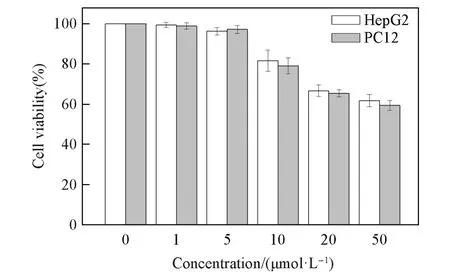
Fig.12 Effect of Bis⁃Nph on HepG2 and PC12 cell viability
3 结 论
设计合成了一个新的双萘酰亚胺衍生物Bis-Nph并进行了结构表征和功能评价.结果表明,Bis-Nph是一种AIEE分子,能够在水溶液中对TNP进行检测,其机制为TNP的酸性使萘酰亚胺上的羰基质子化,阻断了Bis-Nph的ICT发射,导致荧光发生猝灭.该探针检出限为5.8×10−7mol/L,对TNP的识别不受其它爆炸物的干扰,且细胞毒性较低,能够制备成试纸对TNP进行简便快速的定性检测,具有良好的应用前景.
支持信息见http://www.cjcu.jlu.edu.cn/CN/10.7503/cjcu20210765.

