高通量测序技术分析榨菜腌制过程中表面白膜的微生物群落结构
杨吉霞,曾祥平,李凤珠,贺稚非*
(1 西南大学食品科学学院 重庆 400716 2 重庆市计量质量检测研究院第一分院 重庆 402260)
涪陵榨菜是世界三大腌菜之一,采用茎瘤芥(Brassica juncea,俗称青菜头)作为原料,经过独特的“三腌三榨”工艺腌制而成[1]。第1 次腌制采用菜块质量2%~4%的食盐腌制约7 d,第2 次加入4%~8%的食盐腌制20~30 d,第3 次用11%~16%的食盐腌制4~6 个月,每次腌制结束时都将榨菜起池、压榨去水[1-2]。由于腌制过程包含多个阶段,其间有转池、压榨等操作,涉及的微生物种类繁多,容易因环境、器具等因素偶然引入微生物,故影响榨菜的腌制过程以及品质。榨菜表面形成白膜是腌制过程中比较常见的现象,一般认为是由微生物形成的生物膜,然而,目前对白膜的微生物种类构成及其对榨菜品质的影响缺少系统性研究。深入分析白膜所含有的微生物,将有助于识别并防控微生物污染,从而提高榨菜的安全性。
本课题组曾采用培养法鉴定榨菜产膜相关的微生物,主要为芽孢杆菌(Bacillus)属的菌种[3]。培养法有一定的局限性,只能鉴定出在培养条件下生长的微生物种类,而某些微生物是不可培养的,因此该方法不能全面反映微生物的多样性[4]。高通量测序技术不需要培养,直接对样品中所有微生物的16S rRNA 或者ITS 基因测序,能够全面、真实地反映微生物群落中所有的种类和相对丰度,明确微生物的群落结构,目前已广泛运用于各种传统发酵食品的研究[5]。
第三代测序平台PacBio SMRT (单分子实时测序技术,Single molecule real time) 已较多应用于微生物多样性的研究中,它可以实现对细菌16S rRNA 基因(1 400 bp)的全长测序,准确率达到99%[6-8]。目前真菌的分析主要运用Illumina MiSeq 测序技术对ITS 基因进行测序。本研究分别采用PacBio SMRT 和Illumina MiSeq 测序技术对榨菜白膜的细菌16S rRNA 基因和真菌的ITS 基因进行测序,解析细菌和真菌的群落结构。
1 材料与方法
1.1 试验材料
1.1.1 试验原料 用无菌操作从某农户的腌制池中采集有膜的榨菜样品5 个,用无菌采样拭子采集白膜于无菌离心管中,编号为M1~M5。
1.1.2 试验试剂 DNeasy mericon Food Kit 食品DNA 提取试剂盒Qiagen 69514,德国Qiagen 公司;1×TE 缓冲液 (B548106-0500)、50×TAE 缓冲液(B548101)、PBS 缓冲液(pH 7.3~7.5,B640435),生工生物工程(上海)股份有限公司;琼脂糖G-10,西班牙BIOWEST;Premix Taq、RNase-free water、DL2 000 DNA ladder marker,宝生物工程(大连)有限公司。引物:27F(5'-AGAGTTTGATC CTGGCTCAG-3')、1492R(5'-GGYTTACCTTG T TACGACTT-3')[8]、ITS1F (5'-CTTGGTCATT TAGAGGAAGTAA-3')、ITS2R (5'-GCTGCGTTCT TCATCGATGC-3')[9]。委托生工生物工程(上海)股份有限公司合成。

图1 腌制期间表面有白膜的榨菜样品Fig.1 The Zhacai samples with white biofilm on the surface during the pickling process
1.1.3 仪器与设备 PowerPac Basic 基础电源、T100 梯度PCR 仪,美国伯乐Bio-Rad 公司;SWCJ-2F 洁净工作台,苏州安泰空气技术有限公司;G∶BOX EF 型凝胶成像系统,英国Syngene 公司;Milli-Q Biocel 超纯水机,美国密理博公司;P100+超微量分光光度计,美国Pultton 公司。
1.2 试验方法
1.2.1 宏基因组DNA 的提取 用食品DNA 提取试剂盒(DNeasy mericon Food Kit)提取白膜样品的宏基因组DNA,用P100+超微量分光光度计、1%琼脂糖凝胶电泳检测DNA 的质量,贮存于-80℃备用[8-9]。
1.2.2 PCR 扩增 用27F 和1492R 引物扩增细菌的16S rRNA 基因。20 μL PCR 反应体系包括:10 μL 2×Premix Taq 缓冲液,0.5 μL 10 μmol/L 引物,10 ng DNA 模板。扩增程序为:先在95 ℃预变性3 min,然后95 ℃30 s,57 ℃30 s,72 ℃30 s循环30 次,最后72 ℃10 min[3,8]。真菌扩增采用引物ITS1F 和ITS2R,55 ℃褪火,其余条件相同[9-10]。
1.2.3 高通量测序 制备的白膜宏基因组DNA样品1 份送诺禾致源公司运用PacBio SMRT 平台对细菌16S rRNA 基因测序,引物为27F 和1492R,长度为1 400 bp[8],同时另一份送上海美吉生物医药公司,运用Illumina MiSeq PE300 平台和ITS1F、ITS2R 引物对真菌的ITS1 区测序,长度为300 bp[10]。
1.2.4 数据分析 参照本实验室已建立的方法做序列数据分析[11-12]。简述如下:使用Trimmomatic、FLASH 软件做序列的质控、拼接,去除低质量的序列。然后将序列用QIIME 包(定量研究微生物群落,Quantitative insights into microbial ecology,version 1.7)做生物信息分析,获得分类操作单元(Operational taxonomic units,OTUs)和物种信息,计算α 多样性指数,用R 语言绘图。
1.2.5 NCBI 序列号 本研究中的序列已被存入NCBI 的Sequence Read Archive (SRA) 数据库(https://www.ncbi.nlm.nih.gov/sra),细菌16S rRNA序列的注册号为BioProject ID PRJNA756136,真菌ITS1 序列的注册号为PRJNA756159。
2 结果与分析
2.1 高通量测序的基本数据和α 多样性指数
分别用PacBio SMRT 和Illumina MiSeq 对细菌的16S rRNA 基因和真菌的ITS1 基因测序,表1列出了测序的基本数据和α 多样性指数。细菌的16S rRNA 基因测序长度达到1 400 bp,覆盖全长。细菌的Coverage 大于0.99,真菌达到1.000,说明测序深度覆盖到样品中的所有物种。由表1数据可知细菌的α 多样性指数大于真菌,说明其多样性高于真菌。

表1 榨菜表面白膜样品细菌和真菌多样性测序的基本数据和α 多样性指数Table 1 The general data of high throughput sequencing in the analysis of bacterial and fungal diversity in Zhacai surface white biofilm samples and their alpha diversity indices
图2为细菌和真菌的Shannon 曲线图,随着reads 数的增加,OTU 水平的Shannon 指数也增加,说明获得的物种多样性信息增加,当细菌和真菌的reads 数分别达到871 和12 000 之后,Shannon 指数进入了平台期,说明物种多样性信息不再增加,本研究所用的测序深度足够充分。

图2 榨菜表面白膜样品细菌和真菌的Shannon 指数图(OTU 水平)Fig.2 The Shannon's diversity index curves (OTU level) of bacteria and fungi present in Zhacai surface white biofilm samples
2.2 细菌和真菌的多样性统计
表2列出了榨菜表面白膜样品中细菌和真菌在不同分类水平下的种类数量。每个样品中细菌属的数量均大于10,真菌属的数量大于9,说明细菌和真菌群落中都存在比较丰富的种类多样性。
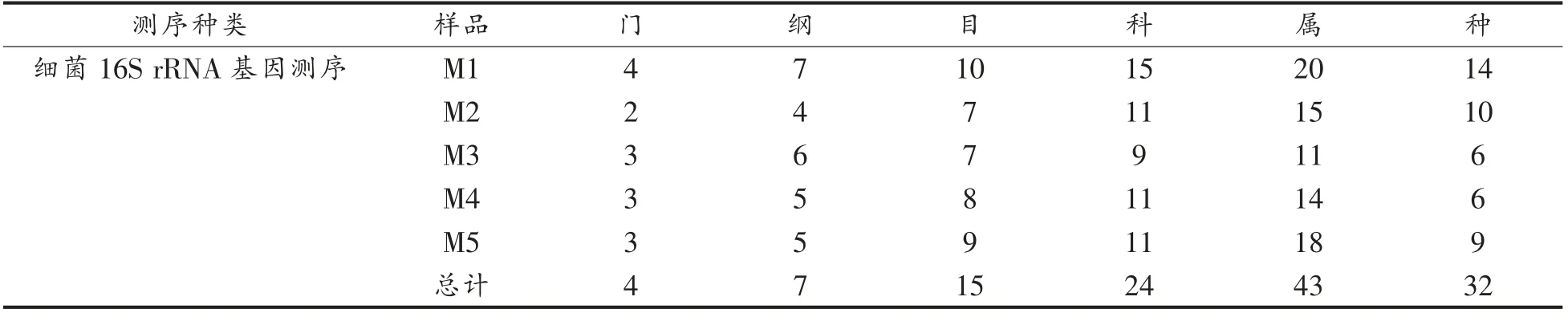
表2 榨菜表面白膜样品的细菌和真菌在不同分类水平下的数量统计Table 2 The statistical table of the distribution of bacteria and fungi at different taxonomic levels in Zhacai surface white biofilm samples

(续表2)
2.3 细菌的多样性和群落结构
榨菜表面白膜样品中的细菌在门、属水平上种类构成如表3所示。
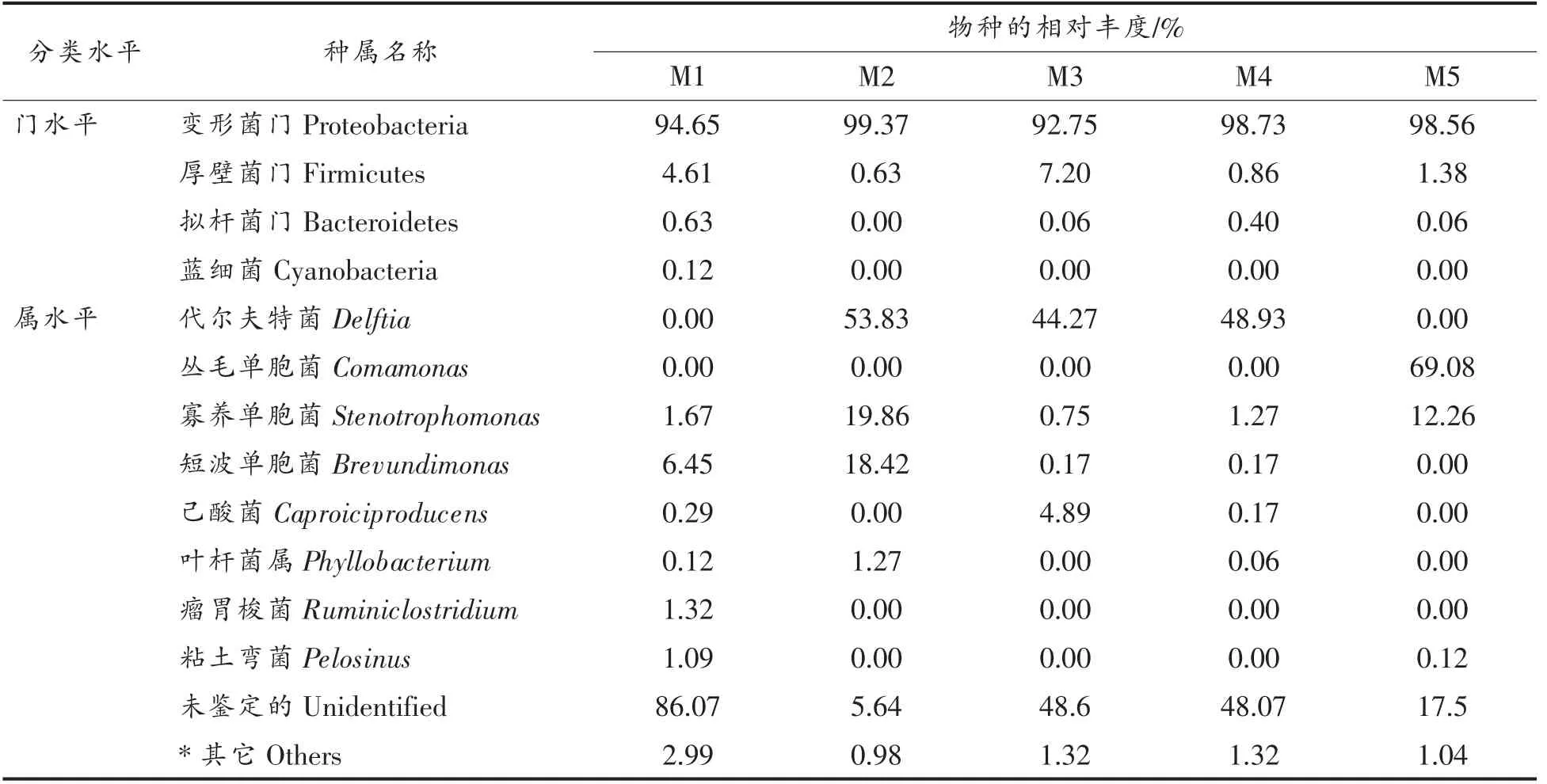
表3 榨菜表面白膜样品中的细菌在门、属水平上的种类构成Table 3 The composition of bacteria at the level of phylum and genus in Zhacai surface white biofilm samples
在5 个榨菜白膜样品的细菌群落中,最优势的门都是变形菌门,相对丰度均大于90%,其次是厚壁菌门。菌膜M1 中鉴定出的优势属(丰度大于1%)包括:短波单胞菌(6.45%)、寡养单胞菌(1.67%)、瘤胃梭菌(1.32%)、粘土弯菌(1.09%)。菌膜M2 中主要的属有:代尔夫特菌(53.83%)、寡养单胞菌(19.86%)、短波单胞菌(18.42%)、叶杆菌属(1.27%)。菌膜M3 中主要的属有:代尔夫特菌(44.27%)、己酸菌(4.89%)。菌膜M4 中主要的属有:代尔夫特菌(48.93%)、寡养单胞菌(1.27%)。菌膜M5 中主要的属有:丛毛单胞菌(69.08%)、寡养单胞菌(12.26%)。
2.4 真菌的多样性和群落结构
榨菜白膜样品中的真菌在门、属水平上种类构成如表4所示。

表4 榨菜表面白膜样品中的真菌在门、属水平上的种类构成Table 4 The composition of fungi at the level of phylum and genus in Zhacai surface white biofilm samples
5 个白膜样品的真菌群落中,最优势的门都是子囊菌门,其相对丰度均大于80%,其次是担子菌门。菌膜M1 中最优势的属为曲霉(相对丰度为40.00%),其次包括枝孢菌、德巴利酵母、青霉、威克汉姆酵母、链格孢霉、毛壳菌属、埃德菌,其丰度均为6.67%。菌膜M2 中最优势属为曲霉(38.89%),其次为枝孢菌、德巴利酵母、青霉、威克汉姆酵母、哈萨克斯坦酵母、嗜盐梗孢酵母、Leptospora、嗜热真菌属、木霉属、毛孢子菌属,丰度均为5.56%。菌膜M3 中优势属为曲霉(45.00%)和枝孢菌(10.00%),德巴利酵母、青霉、威克汉姆酵母、哈萨克斯坦酵母、嗜盐梗孢酵母、白色侧齿霉、隐球菌属、接合酵母属、鬼伞属的丰度均为5.00%。菌膜M4 中主要的属包括:曲霉(35.71%)、枝孢菌(14.29%),以及丰度均为7.14%的德巴利酵母、青霉、威克汉姆酵母、嗜盐梗孢酵母、链格孢霉、白色侧齿霉。菌膜M5 中最优势属为曲霉(35.29%),其次为枝孢菌、德巴利酵母、青霉、威克汉姆酵母、哈萨克斯坦酵母、隐球菌属、念珠菌、塞伯林德纳氏酵母、镰刀菌属、Mastigobasidium,丰度均为5.88%。
3 讨论
细菌生物膜的形成过程可分为5 个阶段[13-14]:(1)可逆黏附阶段。浮游状态的细菌细胞黏附于食品或者其它固体表面,细菌的鞭毛、菌毛、胞外聚合物有利于黏附,其作用力包括范德华力、疏水相互作用、静电力等,这种黏附是可逆的。(2)不可逆黏附阶段。细菌细胞增殖达到一定的密度,产生胞外聚合物(Extracellular polymeric substance,EPS),例如:多糖、蛋白质、核酸、脂质,将菌细胞黏附聚集形成菌落基质,启动群体感应系统,产生更多的胞外聚合物,使菌细胞黏结固定在固体表面,此黏附是不可逆的。(3)形成早期生物膜。菌细胞生长,进一步分泌产生胞外聚合物,向周转扩散,形成早期生物膜。(4)生物膜成熟阶段。菌落聚集形成成熟的生物膜。(5)生物膜脱落分散。菌细胞从生物膜上脱落,成为浮游细胞,扩散后在其它位置形成生物膜。本研究鉴定出主要的细菌属包括代尔夫特菌、丛毛单胞菌属、寡养单胞菌、短波单胞菌,都有形成菌膜的报道[15-18]。
在真菌群落中,曲霉形成菌膜的特性已被广泛研究和报道。真菌形成菌膜的过程与细菌略有差别[19]:曲霉能够产生分生孢子,分生孢子通过一些黏附作用(例如:疏水相互作用、静电相互作用、粗糙的表面)附着于食品或者其它固体表面,一类称为疏水蛋白的两亲性蛋白质也可以介导丝状真菌的黏附,分生孢子黏附于固体表面之后,萌发产生菌丝(Filamentous),菌丝体生长形成最初的单层菌落,真菌也能产生与细菌相似的胞外聚合物使菌落黏附在一起,形成结构复杂的成熟生物膜。
生物膜的形成可能与一些条件相关,例如:环境因素(pH 值、温度、营养成分)、菌细胞密度、细菌种群特征等[13]。微生物形成菌膜后能够增强对杀菌处理或者恶劣环境的抵抗能力,例如,野生型的鼠伤寒沙门氏菌 (Salmonella typhimurium) 能够形成菌膜,与其它不能成膜的突变体相比较对次氯酸钠的耐受性增强了1 000 倍[20],有机小麦粉中的肠炎沙门菌(Salmonella enteritidis),形成生物膜的菌株杀菌工艺值D80℃,0.45aw显著高于不能成膜的菌株[21]。目前对于形成榨菜白膜的微生物认识不多,它们在哪些条件下容易形成生物膜,形成生物膜之后对杀菌处理的耐受性等,有待进一步研究。
4 结论
本研究分别用PacBio SMRT 和Illumina MiSeq 对榨菜表面白膜样品的细菌16S rRNA 基因和真菌ITS1 基因测序,分析阐述了细菌和真菌群落结构。白膜样品中存在较多细菌和真菌种类,鉴定出细菌主要的属包括:代尔夫特菌、丛毛单胞菌属、寡养单胞菌、短波单胞菌,真菌主要的属包括:曲霉、枝孢菌、德巴利酵母属、青霉、威克汉姆酵母、哈萨克斯坦酵母。

