小麦麸皮硒化多糖的肝保护活性研究
吕青青,陈寒青
(合肥工业大学 食品与生物工程学院,安徽 合肥 230601)
肝脏是一个重要的器官,在代谢系统中起着重要的作用。然而,肝脏也相对脆弱,易受到病毒、药物、有毒化学物质和酒精等多种外源性因素的破坏,如果损伤没有得到缓解或消除,那么就会影响肝脏的代谢功能[1-2]。虽然已经有药物可以治疗肝损伤,但它们都有许多副作用,如腹泻、呕吐、恶心和过敏等,从而限制了它们的应用[3]。因此寻找能治疗肝损伤而不会引起副作用的天然物质被广泛关注。
多糖是一种天然的大分子聚合物,具有多种生物活性[4-5],但是部分天然多糖的生物活性较弱,因此需要对天然多糖进行改性处理。硒是生物体必需的微量元素,适量摄入对机体健康有益。硒在某些抗氧化酶的合成中起着不可缺少的作用,同时硒还具有防止氧化应激及保护生物膜的功能特性[6]。此外,有研究证实,硒的摄入可以提高抗氧化酶的活性,从而防止机体自由基的聚集[7]。但是无机硒具有一定的毒性,且不易被人体吸收,因此研究人员经常通过化学改性或生物改性将无机硒转化为有机硒。近年来,已证明硒多糖比原多糖具有更好的肝保护活性[8-9]。
小麦麸皮是小麦加工业的副产品,主要用作动物饲料,利用效率低,一定程度上造成了资源的浪费。小麦麸皮多糖是小麦麸皮的主要活性物质,具有抗氧化、抗癌和免疫增强等活性[10-12]。对于小麦麸皮多糖的研究目前主要集中在天然多糖和硫酸酯化多糖的生理活性,但对小麦麸皮硒化改性多糖的生理活性研究很少。
因此,本文采用超声波辅助热水提取和DEAE纤维素-52阴离子交换色谱成功获得小麦麸皮多糖W2,利用化学改性方法制备硒化多糖SeW2-3,并研究这2种多糖对CCl4诱导的小鼠急性肝损伤的保护作用。
1 材料与方法
1.1 材料与试剂
材料为小麦麸皮,由安徽凤宝粮油食品有限公司提供;氢氧化钠、盐酸、硫酸、三氯甲烷、正丁醇、无水碳酸钠、亚硒酸钠、抗坏血酸均为分析纯。
普通生化试剂盒源自南京建成生物工程研究所;ELISA试剂盒源自北京索莱宝生物科技有限公司。
1.2 小麦麸皮多糖的制备
将小麦麸皮用蒸馏水清洗6次,然后于45 ℃烘箱中干燥。将干燥后的小麦麸皮用中药粉碎机进行粉碎,过40目筛后放置干燥处备用。称取适量的小麦麸皮粉末于烧杯中,按照0.1 g/mL的比例添加体积分数95%的乙醇溶液,在室温下搅拌2 h,用蒸馏水清洗至中性,以除去小分子的杂质。将滤渣放置45 ℃烘箱中干燥后转移至烧杯中,加入25倍体积的蒸馏水,然后室温下用280 W超声波处理1 h,随后在60 ℃水浴中提取3 h,提取2次。将2次提取所得上清液合并,用旋转蒸发仪将其浓缩至原来体积的1/4。向浓缩液中添加无水乙醇直至最终的乙醇体积分数为65%,然后置于4 ℃冰箱中过夜。将醇沉体系离心10 min后(3 500g),收集沉淀物复溶于蒸馏水中,采用Sevag法进行脱蛋白处理。重复此操作5、6次,直至无蛋白析出,将上清液用流水透析48 h (截留分子量为3 500 Da),冷冻干燥后得到小麦麸皮粗多糖。
称取约100 mg粗多糖组分溶解在少量蒸馏水中,4 800g离心10 min后,取上清液注入DEAE 纤维素-52离子交换色谱柱(2.6 cm×40 cm)中,依次用蒸馏水、0.1、0.2、0.3 mol/L的NaCl溶液进行洗脱,洗脱液的流速为5 mL/min,采用自动部分收集器收集洗脱液,每5 mL收集1管,采用苯酚硫酸法测定溶液在480 nm处的吸光度值,并绘制洗脱曲线。将0.1 mol/L NaCl溶液洗脱得到的主要组分收集,并用流水透析48 h,冷冻干燥后得到纯化多糖,命名为W2。
1.3 硒化多糖的制备
根据已有研究,采用化学方法对W2进行硒化修饰[13]。准确称取100 mg多糖溶于100 mLHNO3溶液(0.5%)中,向溶液中添加100 mg的亚硒酸钠固体粉末,在70 ℃水浴条件下反应6 h。反应结束后,将反应液冷却并用无水碳酸钠调节pH值至5~6之间,离心后取上清液进行透析(截留分子量为3 500 Da),用抗坏血酸法每隔6 h检测游离亚硒酸钠,直到不再呈现红色时结束透析,然后将透析液浓缩、冷冻干燥后得到硒化多糖SeW2-3。
1.4 体内保肝活性
1.4.1 实验动物
选择清洁级ICR昆明雄性小鼠,72只,体质量约20 g。所有动物饲养7 d以适应环境,饲喂正常饲料,保持12 h昼夜循环和自由摄食饮水,室内保持通风良好,室温控制在23 ℃左右,相对湿度为45%~65%。
1.4.2 实验动物分组及处理
将72只正常小鼠随机每8只小鼠分为1组,共9组。Ⅰ~Ⅱ组:正常对照组(NC)和模型对照组(MC),在正常饮食的基础上每天灌胃一定体积生理盐水;Ⅲ组:阳性对照组(PC),在正常饮食的基础上每天灌胃200 mg/kg水飞蓟素(溶于生理盐水);Ⅳ~Ⅵ组:W2组,在正常饮食的基础上每天分别灌胃50、100、200 mg/kg的W2(溶于生理盐水);Ⅶ~Ⅸ组:Se-W2-3组,在正常饮食的基础上每天分别灌胃50、100、200 mg/kg的Se-W2-3(溶于生理盐水)。
第14天给药后2 h,除正常组外,其余组均腹腔注射1%的CCl4大豆油复合物(5 mL/kg),正常组注射等量的大豆油,禁食不禁水。24 h后CO2窒息处死小鼠,立即将小鼠肝脏取出并称其质量,将一部分肝脏保存在10%福尔马林溶液中,另一部分肝脏于-80 ℃贮存备用。
1.4.3 测定指标及方法
血清中生化指标测定。CO2窒息处死小鼠后,立即吸取小鼠心脏血,置于离心管中,在4 ℃条件下离心10 min(2 500g),取血清备用。根据试剂盒说明书测定血清中天冬氨酸转氨酶(AST)和丙氨酸转氨酶(ALT)活性。
严格按照酶联免疫分析试剂盒(ELISA)中的说明书测定小鼠血清中肿瘤坏死因子-α(TNF-α)和白介素-1β(IL-1β)水平。首先,向包被细胞因子抗体的酶标板中加入待测样品或标准品,温育洗涤后加入酶标试剂,再次温育洗涤后依次加入显色剂A和显色剂B,避光反应后加入终止液,最后测定样品的吸光度。
肝脏组织中抗氧化酶活性测定。取部分解冻的肝脏组织置于组织匀浆器中,按照每克肝脏加入9 mL冰生理盐水反复研磨成匀浆,并在4 ℃条件下离心10 min(2 500g),取上清液备用。根据试剂盒说明书测定超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)和过氧化氢酶(CAT)活性。
肝脏组织中脂质过氧化物水平测定根据试剂盒说明书测定丙二醛(MDA)的量。
半胱天冬酶(Caspases)活性测定。取20 mg解冻的肝脏组织置于小型组织匀浆器中,并加入100 μL裂解液,反复研磨成匀浆备用。严格按照Caspase-3和Caspase-8试剂盒的说明进行操作,测定其相对活性。
肝脏组织切片分析。取福尔马林固定液中肝脏组织,采用不同体积分数的乙醇和二甲苯进行脱水处理和透明处理,用石蜡包埋后切成厚度为4~5 μm的肝脏组织切片。将切片用H&E染色,采用光学显微镜在200倍下观察并拍照。
1.5 数据分析
所有数据均采用IBM SPSS Statistics 19软件中单因素方差分析(ANOVA)的Tukey法进行显著性分析,n均为6(与正常组相比,*P<0.05、**P<0.01;与模型组相比,#P<0.05、##P<0.01)。
2 结果与讨论
2.1 血清中AST和ALT活性分析
血清中酶活性是衡量动物急性肝损伤的生化指标,如AST和ALT[14]。这些酶主要存在于各种细胞中,尤其在肝细胞中,因此在血液中的含量很小。但是,如果肝细胞因外部因素受到损伤,那么这些酶就会从肝组织渗入血液,从而导致血清中酶活性显著升高[14]。近年来,一些报道也证实了大量的酶进入血流,会造成生物体组织进一步的损伤,如肝脏细胞浸润等[15-16]。小鼠血清中AST和ALT活性如图1所示。

图1 小鼠血清中AST和ALT活性
从图1可以看出,与NC组相比,MC组小鼠血清中的AST和ALT活性均显著增加(P<0.01),表明CCl4诱导小鼠肝脏损伤;预先灌胃SeW2-3会显著降低小鼠血清中AST(100、200 mg/kg)和ALT(50、200 mg/kg)活性,但预先灌胃W2并没有显著影响小鼠血清中AST和ALT活性。结果表明,预先灌胃SeW2-3比W2更能有效地降低小鼠血清中酶的活性,原因可能是硒在一定程度上具有抗氧化性,能有效地预防肝脏损伤,从而减缓AST和ALT从细胞释放到血液中[8]。这一现象表明,SeW2-3比W2具有更强的保肝活性。
2.2 肝脏组织中抗氧化酶活性分析
在CYP450酶系的作用下,CCl4作为外源性肝毒素,会转化为CCl3·和CCl3OO·2种自由基,从而产生过量的活性氧(reactive oxygen species,ROS)[17]。研究表明,ROS可引起生物体氧化应激进而造成机体损伤[18]。生物体内的抗氧化酶是应对机体氧化应激的第1道屏障,包括SOD、CAT和GSH-Px[19]。超氧阴离子在SOD作用下可以转化为过氧化氢(H2O2)[17],H2O2在GSH-Px或CAT的作用下可以分别转化为无毒的羟基化合物或氧分子和水,从而降低机体的氧化损伤[20]。小鼠肝脏中SOD、CAT 和GSH-Px活性如图2所示。

图2 小鼠肝脏中SOD、CAT 和GSH-Px活性
从图2可以看出,MC组小鼠肝脏中3种抗氧化酶的活性均显著降低(P<0.01),这表明MC组小鼠肝脏发生氧化应激;但预先灌胃小鼠一定剂量的W2和SeW2-3都可以增强小鼠肝脏抗氧化酶活性,且呈现剂量依赖性。在相同剂量下,SeW2-3组小鼠肝脏中抗氧化酶的活性高于W2组,表明硒化改性增强了多糖的体内抗氧化活性,进而减轻了CCl4对小鼠肝脏造成的损伤。
2.3 丙二醛的量分析
MDA作为脂质过氧化的终端产物,其含量能够反映机体氧化应激和脂质过氧化的程度,从而判断机体是否受到损伤[21]。小鼠肝脏中MDA的量如图3所示,由图3可知,与NC组相比,MC组小鼠肝脏中MDA的量显著升高 (P<0.01),说明肝脏发生了脂质过氧化,进一步证实了CCl4能成功诱导肝损伤;与MC组相比,预先灌胃W2不能显著降低小鼠肝脏中MDA的量,但预先灌胃SeW2-3(200 mg/kg)能显著降低小鼠肝脏中MDA的量(P<0.05)。以上结果表明,高剂量的SeW2-3能有效抑制小鼠肝脏中脂质过氧化反应。

组别图3 小鼠肝脏中MDA的量
2.4 血清中细胞因子水平分析
当机体受伤时,机体会产生炎症细胞因子(如TNF-α和IL-1β)并释放到血液中,用来抵御有害物质的侵入[22]。研究表明,腹腔注射CCl4可刺激机体的免疫细胞或非免疫细胞释放炎性细胞因子,而细胞因子的过度产生会加重炎症反应,进而加重肝脏的损伤程度[9]。小鼠血清中细胞因子TNF-α和IL-1β水平如图4所示。

图4 小鼠血清中细胞因子TNF-α和IL-1β水平
由图4可知,MC组小鼠血清中TNF-α和IL-1β质量浓度显著升高(P<0.01),表明MC组小鼠发生了炎症反应;W2组小鼠血清中细胞因子的水平变化不显著,但SeW2-3预处理会显著降低TNF-α和IL-1β水平,且呈剂量依赖性,表明硒化改性可以提高多糖对细胞因子释放的抑制能力。
2.5 半胱天冬酶活性分析
Caspases是凋亡通路中的重要调控因子,包括Caspase-3、Caspase-8和Caspase-9。Caspase-3和Caspase-8分别被认为是死亡受体介导的细胞凋亡的调节因子和启动子,而Caspase-9被认为是线粒体介导的凋亡通路的启动子[23-24]。当机体受到刺激时,Caspase-9会被转化为裂解的Caspase-9,后者可将Caspase-3转化为裂解的Caspase-3[18],因此Caspase-3能从侧面反映Caspase-9。小鼠肝脏中Caspase-3和Caspase-8相对活性如图5所示。由图5可知,MC组Caspase-3和Caspase-8活性较NC组显著升高(P<0.01),表明Caspase参与了CCl4诱导的肝细胞的凋亡;经W2和SeW2-3预处理后,均能降低肝脏中Caspase-3和Caspase-8的活性,且呈剂量依赖性;但是,在相同的剂量下,SeW2-3组Caspase-3和Caspase-8的相对活性比W2组低。

图5 小鼠肝脏中Caspase-3和Caspase-8相对活性
表明硒化改性能提高多糖对Caspase-3和Caspase-8活性的抑制程度,从而缓解肝脏细胞凋亡,进而减轻小鼠的肝脏损伤。
2.6 肝脏组织病理切片分析
小鼠肝脏组织病理学切片如图6所示,从图6可以看出,NC组小鼠肝脏细胞结构完整,细胞排列相对有序,且细胞间界限清晰;与NC组相反,腹腔注射CCl4能致小鼠肝损伤,主要表现为细胞严重变性、肝细胞坏死、炎性浸润,而水飞蓟素预处理能有效保护肝脏免受CCl4的损伤;W2和SeW2-3预处理在一定程度上可以预防肝损伤,其特征是肝细胞坏死面积的减少。此外,从图6还可以看出,经SeW2-3预处理小鼠的肝细胞坏死面积比经W2预处理小鼠的肝细胞坏死面积减少得更多,与血清生化指标、肝酶活性和半胱天冬酶活性的结果一致。从而进一步证实W2和SeW2-3都具有一定的肝保护活性,但是SeW2-3具有比W2更强的肝保护活性。
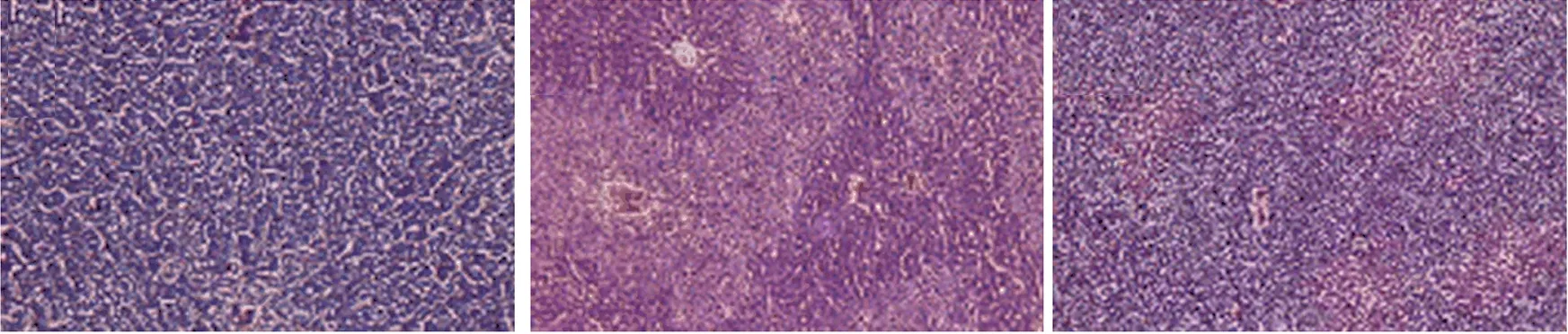
(a) Ⅰ组 (b) Ⅱ组 (c) Ⅲ组
3 结 论
体内实验结果表明,与W2相比,SeW2-3具有更好的肝保护活性,可以降低小鼠血清中AST、ALT及小鼠肝脏中Caspase-3、Caspase-8的活性,降低肝脏中MDA的量,增强肝脏组织中抗氧化酶活性及减少TNF-α和IL-1β的分泌水平。结果表明,硒化改性能显著提高小麦麸皮多糖对小鼠急性肝损伤的保护活性,然而其更精确的分子机制还有待于深入研究。

