巴山木竹开花前后植物内源激素变化研究
杜喜春,何祥博,赵银萍,张九东,郭成圆
(1.西安文理学院 生物与环境工程学院,陕西 西安 710065;2.陕西省佛坪国家级自然保护区管理局,陕西 佛坪 723400)
陕西佛坪国家级自然保护区是秦岭野生大熊猫分布的中心地区之一,种群密度居全国之首[1].秦岭地区分布的竹类植物有7 属22 种,是大熊猫的主要食物来源[2].已有研究人员对陕西秦岭和四川等地的大熊猫主食竹从分类[3-7]、分布规律[8-9]、种子萌发和植物生长[10-12],以及种群动态与森林演替[9,13-15]等方面进行了深入研究.秦岭大熊猫夏季常在高海拔的秦岭箭竹(Fargesia qinlingensis)林下活动;一年中其余约75 %的时间,包括春、秋和冬季,多是在低海拔区域的巴山木竹(Bashania fargesii)林下活动[16-17].冬季自然环境条件更为严酷,巴山木竹林作为大熊猫的主要栖息地和食物来源,对于其野外生存具有重要意义,加强对巴山木竹的研究可以为保护大熊猫提供理论支撑.
研究人员已经从生长特性[8,16]、营养特征[8,17-21]、遗传多样性[22]、种群生态学[18,23]、生物量[1,23-25]、分布规律[5,8]、竹林结构[19-20]等方面对巴山木竹进行了研究,为大熊猫的保护工作提供了重要依据.秦岭大熊猫的主食竹种,包括巴山木竹,均属于种群内同期一次性开花的生殖类型,先有竹子零星开花,继而同地域内的竹秆全部开花枯死[26-27],这可能会对大熊猫的生存环境和食物来源造成影响.然而,对巴山木竹的生殖生物学,包括开花的分子机制和植物内源激素变化等方面问题的研究并不多见.
竹类植物开花周期长,长达数十年甚至上百年,因此竹类植物的自然开花现象不太常见,但是竹子开花过程中和开花后普遍具有营养生长衰退,甚至大规模死亡的现象.竹子开花状态不同,内源激素含量会发生一定的变化[26-29].虽然自然界的竹类植物开花难以遇到,但通过对竹类开花进程的人为调控,可促使一些竹种的试管苗开花,目前已经成功实现20 多个竹种的离体繁殖,同时通过调控培养基配方中植物激素和生长调节物质的组成和配比,多种竹类植物在试管中完成开花[30],表明植物激素在竹类植物开花过程中的作用不可忽视.研究人员对秦岭大熊猫的主食竹种,包括秦岭箭竹[26-27,31-33]、巴山木竹和龙头竹[26-27]的开花现象进行了初步研究,但是巴山木竹开花过程中的植物内源激素的变化规律还不清楚.在这方面开展研究不仅可以完善竹类植物开花理论,而且对于大熊猫的保护工作也具有重要的意义.
1 材料和方法
本研究选取处在3 个不同生长发育阶段(营养生长阶段、开花前期阶段、开花阶段)的巴山木竹种群作为研究对象,运用酶联免疫分析试剂盒测定巴山木竹不同发育时期叶片中的植物内源激素含量,运用TYS-B 型叶绿素测定仪测定叶绿素相对含量和氮相对含量(SPAD 值).
研究地点为陕西秦岭南坡中段的佛坪国家级自然保护区.根据巴山木竹生长发育状况将其分为3 个阶段,分别位于3 个不同的小流域,分别设为A、B 和C 3 个组.A 组为第1 组,是营养生长阶段,长势旺盛短期内没有开花迹象,作为对照组,该组位于保护区核心区的大古坪保护站管辖区内.B组是第2 组,为开花前期阶段,也就是开花预警组,位于保护区核心区的岳坝保护站管辖区内,该组竹子即将开花,2015 年9 月至今每年都在该区域的巴山木竹种群中发现零星开花的竹杆,该处竹林带位于河岸两侧,总长度大约2 km,除了极少量开花的竹子以外,其他竹子长势良好,暂时看不到开花的迹象.C 组是第3 组,为开花阶段,位于保护区的外围区域,该区域不属于保护区的管辖范围,与保护区相毗邻.分别在上述3 种不同生长发育阶段的3 个小流域内选取生境相似的10 个典型竹丛进行调查取样.
在每个样方内随机选取10 个1 年生竹杆,运用叶绿素测定仪测量叶片的SPAD 值,同时采集上面无病虫害的完整健康嫩叶,编号后立即放入液氮罐中进行保鲜,带回实验室后,用100%甲醇固定,置于−20 ℃以下低温冰箱中保存备用.
生长素(IAA)、细胞分裂素(CTK)、脱落酸(ABA)和赤霉素(GA)的提取和纯化的方法参考文献[34].取5 g 竹叶,剪碎,加入60 mL 预冷(小于0 ℃)的80%甲醇溶液,匀浆5 min,匀浆液在4 ℃下震荡24 h,过滤,残渣再用20 mL 80%甲醇溶液震荡1 h.反复2 次,将混合滤液在旋转蒸发器上干燥减压至原体积一半,再加入10 mL 石油醚,提取部分色素,将下层甲醇液取出,继续减压去除甲醇,获得含有IAA、ABA、GA 和CTK 的水溶液,经过进一步萃取和纯化,最后分别采用IAA、CTK、GA 和ABA 的酶联免疫吸附(ELISA)检测试剂盒进行测定.
数据处理与分析:采用 Excel 2007 与SPSS 17.0 软件对试验数据进行整理分析,用SPSS 17.0软件进行单因素方差分析和差异显著性检验 (LSD法),运用 Excel 2007 制作相关表格.
2 结果与分析
2.1 不同开花阶段巴山木竹叶中植物内源激素质量比的变化表1 显示,3 组IAA 数据之间的差异具有统计学意义,显著性P<0.05.其中A 组中的IAA 平均质量比为4.69 ng/g,B 组中的IAA 平均质量比5.61 ng/g,C 组叶中的IAA 平均质量比7.39 ng/g.IAA 随着发育时期的推进逐步升高,其中B 组比A 组高19.62%;C 组比A 组高48.13%,比B 组高31.73%.

表1 不同开花阶段巴山木竹叶中植物内源激素质量比的比较Tab.1 Comparison of plant endogenous hormone contents in the leaves of Bashania fargesii at different flowering stages
3 组GA 数据之间的差异具有统计学意义,显著性P<0.05.其中A 组GA 平均质量比7.84 ng/g,B 组叶中的GA 平均质量比4.81 ng/g,C 组叶中的GA 平均质量比10.29 ng/g.GA 在整个阶段先降低,最后又升高.C 组最高,B 组质量比最低.其中B 组比A 组低38.65%;C 比A 组高50.94%,比B 组高113.93%.
3 组CTK 数据之间的差异具有统计学意义,显著性P<0.05.其中A 组中的CTK 平均质量比291.23 ng/g,B 组CTK 平均质量比213.51 ng/g,C组叶内CTK 平均质量比348.03 ng/g.CTK 在整个阶段先降低,后又升高,开花阶段最高.其中B 组比A 组低26.69%;C 组比A 组高26.60%,比B 组高63.00%.
A 组叶中ABA 平均质量比375.40 ng/g,B 组平均质量比382.33 ng/g,C 组平均质量比563.24 ng/g.A 组和B 组之间的差异不具有统计学意义,其余各组之间的差异均具有统计学意义.ABA 在开花前变化不大,开花以后质量比才显著升高,C 组比A组高49.13%,比B 组高47.32%.
2.2 不同开花阶段巴山木竹叶中植物叶绿素和氮含量的变化3 组叶绿素和氮含量的差异均具有统计学意义(表2).B 组叶绿素的SPAD 值为30.631,A 组为33.148,C 组为31.593,表明从营养阶段到开花前期,叶绿素相对含量会降低大约10%左右,进入开花期后,叶绿素相对含量又会升高.氮含量SPAD 值的变化趋势与叶绿素相对含量的变化趋势大致相同,B 组的SPAD 值为2.7,A 组为2.864,C 组为2.773,表明从营养阶段到开花前期先降低,进入开花期后又有小幅升高.
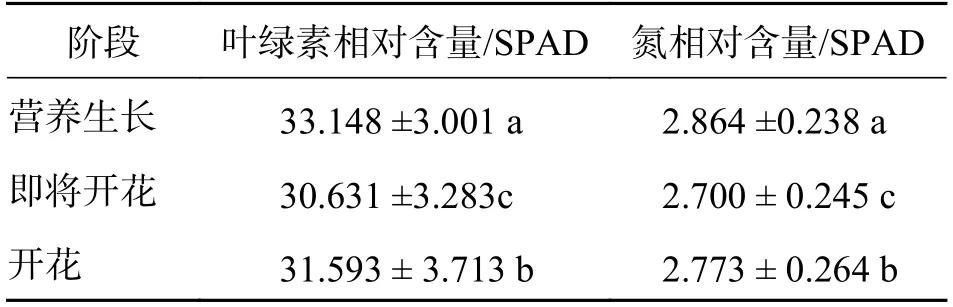
表2 不同开花阶段巴山木竹叶中植物叶绿素和氮相对含量的SPAD 值比较Tab.2 Comparison of SPAD values of chlorophyll and nitrogen contents in the leaves of Bashania fargesii at different flowering stages
3 讨论
开花是植物从营养生长向生殖生长转换的标志性生理发育过程,这个过程与植物的内源激素的调节是分不开的.赤霉素(GA)途径是许多植物开花的重要途径,GA 与这些种类植物的开花调节密切相关[35].近年来,研究者对IAA、CTK 和 ABA 等植物激素在植物开花过程中的作用和分子机理也进行了大量报道[36].
GA 不仅参与调控植物开花时间,而且也参与多种生长发育过程,可以促进茎的伸长.GA 途径是许多植物开花调控的重要途径.它可以替代长日性植物的光照条件及要求低温的2 年生植物的低温作用[35],并通过调控开花时间整合基因(SOC1)[37]以及花分生组织的特征基因LEAFY (LFY)[38-39]的表达来实现其生理效应.不同发育阶段的巴山木竹竹丛在佛坪自然保护区内分布的区域大致相同,所面对的四季更替、日照长短和温度等环境因素也相同,因此大致可以排除光周期途径、春化途径和温度途径等重要的植物开花途径.巴山木竹的花期在3 月下旬至4 到5 月,面临的是长日照环境,且开花前GA 质量比先降低,可以推断GA 途径与巴山木竹的开花无关,但其开花前GA 质量比显著降低可作为巴山木竹开花的预警指标.早竹Phyllostachys praecox衰老是由GA3、ABA、IAA 的比值决定的,且以GA3/ABA 为主,比值高抑制衰老,反之促进衰老[40].巴山木竹开花前GA 质量比显著降低,ABA质量比升高,GA3/ABA 降低,与旱竹的表现一致.胡桃楸等阔叶植物的GA 有抑制成花的作用,在结实之后GA 质量比又大幅上升[41-42].巴山木竹与胡桃楸的表现也一致,开花前GA 质量比降低,在果实发育阶段GA 质量比也大幅升高.
IAA 主要在叶片内部形成,调控多种植物的发育与生理进程,包括胚胎发育、侧根形成、维管发育、顶端优势等[43],可诱导拟南芥的响应因子MONOPTEROS(MP)的表达,MP 直接激活花分生组织特性基因LEAFY(LFY)的表达,从而促进营养生长向生殖生长转换[44].高浓度IAA 促进胡桃楸等长日植物的花芽分化[42],巴山木竹开花前面临长日照环境,且在开花前IAA 质量比大幅升高,与胡桃楸的表现同样一致,也可作为巴山木竹开花的预警指标.
ABA 最主要的生理作用是促进植物器官的脱落和衰老以及对植物生长起着抑制作用.巴山木竹植株叶片中ABA 先保持不变,开花时才升高,开花植株其质量比显著高于未开花植株,竹叶逐渐枯黄掉落,整株竹子衰败死亡,因此推断竹子开花过程中叶片中的ABA 浓度大幅度升高,是加速竹林衰老死亡的原因之一.
CTK 参与植物生长发育的多个方面,能够促进植物细胞分裂和增大,诱导和调控芽的分化,在调控分裂周期和维持分生组织动态平衡方面起着重要作用.高含量的CTK 和较大的CTK/GA 值有利于花芽分化;外源 CTK 处理可以上调拟南芥SOC1基因的表达,促进其在SD 条件下开花[45].CTK 还有防止叶片衰老的作用[46-47],这主要是由于细胞分裂素能够延缓叶绿素和蛋白质的降解速度.巴山木竹的CTK 质量比在开花前有所降低,有可能和其叶绿素和氮含量降低,叶均质量大幅减少有关,并导致光合效率和同化能力降低.
通过对模式植物拟南芥(Arabidopsis thaliana)的研究,揭示了多条植物开花的调控途径[48],其中年龄途径是许多植物的关键开花途径.miR156 与miR172 是年龄途径过程中的关键物质[49],miR156的积累与幼叶性状相关,miR172 与成体叶片性状相关,这两个miRNA 共同起调节作用,导致植物从幼体到成体阶段的转变[50],这种现象在拟南芥、水稻、芥菜等植物材料中普遍存在.CTK 可下调miR172的表达水平[51],在巴山木竹的开花前期,CTK 质量比显著降低,miR172 浓度就有可能增加,从而进一步激活年龄途径而引起开花,因此可以推断巴山木竹的开花过程有可能与年龄途径有关.竹类植物属禾本科,生殖特性类似小麦 (Triticum aestivum),表现为同期一次性开花,生殖完成后群体同时死亡,而且需要经历长达数十年甚至百余年之久的营养生长期,这种开花特性的表现也指向年龄途径.主食竹类大面积开花死亡后,会影响到大熊猫的食物来源和栖息地质量,因此研究竹类植物开花对于大熊猫的保护工作具有重要意义.

