凡纳滨对虾急性肝胰腺坏死病致病菌的分离鉴定、药敏特性及其组织病理学观察
高晓华,张海强,安 伟
(上海市水产研究所,上海 200433)
凡纳滨对虾()又名南美白对虾,因其营养丰富、肉味鲜美、生长速度快、适盐度范围广等优点,已成为我国重要的水产养殖品种。2020年我国凡纳滨对虾养殖总产量186.3万t,占对虾养殖总产量的86.54%,但由于近年来高密度集约化养殖方式,细菌性疾病已对凡纳滨对虾的养殖生产造成严重危害,大规模凡纳滨对虾患病死亡,严重制约对虾养殖产业健康发展。
急性肝胰腺坏死病(Acute hepatopancreatic necrosis disease,AHPND)是目前凡纳滨对虾养殖中的主要细菌性疾病,该病主要感染投放10~40 d左右虾苗,又称早期死亡综合征(Early mortality syndrome,EMS),患病凡纳滨对虾主要病症为虾体变软,肝胰腺萎缩、颜色发白,空胃空肠,摄食减少,死亡率高达90%以上,已对中国、菲律宾、墨西哥等多国对虾养殖业带来巨大的经济损失。研究表明,对虾急性肝胰腺坏死病是由携带了能编码毒力蛋白和质粒的部分弧菌引起的,其毒力蛋白可引起对虾肝胰腺上皮细胞脱落、坏死、肝胰腺功能障碍,进而导致对虾急性死亡。已有报道显示,可引起对虾急性肝胰腺坏死病的病原菌包括副溶血弧菌()、欧文斯氏弧菌()、哈维氏弧菌()、坎氏弧菌()等。上海市奉贤区某对虾养殖场凡纳滨对虾出现大规模的急性死亡,其临床表现为肝胰腺发白、空肠空胃、虾壳变软等症状,与已报道的急性肝胰腺坏死病临床症状相似。本研究对疑似患急性肝胰腺坏死病的凡纳滨对虾进行病原菌分离鉴定、致病性分析及药物敏感性试验,并进一步观察其肝胰腺组织病理变化,以期为凡纳滨对虾急性肝胰腺坏死病的流行病学研究和药物防控提供基础依据。
1 材料与方法
1.1 试验材料
自然患病凡纳滨对虾样品采自上海市奉贤区某对虾养殖场,体长约3.0~5.0 cm。健康凡纳滨对虾购自上海市某对虾养殖场,大小均匀,无病无伤,体长约为5.0~7.0 cm,在水族缸内暂养7 d,水温控制在(28±1)℃,24 h充氧,并适量投喂饲料,每天按时吸污、换水,养殖稳定后进行人工感染。
1.2 主要试剂
胰蛋白胨大豆琼脂培养基(TSA)、胰蛋白胨大豆肉汤培养基(TSB)、硫代硫酸盐柠檬酸盐胆盐蔗糖琼脂培养基(TCBS)均购自北京陆桥技术有限责任公司;PCR Premix Taq、DNA Marker DL2000、TaKaRa MiniBEST 细菌基因组DNA提取试剂盒均购自宝生物工程(大连)有限公司;药敏纸片、琼脂(MHA)培养基购自英国Oxoid公司,所有药敏纸片均于4 ℃冰箱保存备用。
1.3 病原菌分离
无菌接种环蘸取患病凡纳滨对虾的肝胰腺组织,划线接种于弧菌选择性培养基TCBS上,置于30 ℃恒温培养箱,培养24 h,挑取TCBS培养基上形态一致的优势菌落,接种至TSA固体培养基上进一步纯化,纯化后的菌株加入50%甘油溶液,混匀后冷冻保存于-80 ℃冰箱,菌株编号为:FHBX-1。
1.4 人工回归感染试验及组织病理观察
1.4.1 菌悬液的制备
挑取TSA培养基上分离株的单菌落接种至TSB液体培养基中,置于30 ℃恒温摇床(200 r/min)过夜培养,获得菌悬液。高速离心菌悬液收集菌体,用无菌生理盐水重悬,分光光度法测定菌液在OD下的吸光度值,确定菌液浓度。
1.4.2 人工感染试验
人工感染试验参照Tran浸泡感染法,将健康凡纳滨对虾随机分成感染组、对照组,每组10尾,每组设置3个平行。感染组凡纳滨对虾浸泡于菌液终浓度为1.0×10CFU/mL的人工海水中(盐度约15‰),对照组凡纳滨对虾浸泡于无菌人工海水中,浸泡15 min,将浸泡后感染组凡纳滨对虾捞出转入菌液终浓度为1.0×10CFU/mL的10 L人工海水桶中,持续感染。对照组转入10 L无菌人工海水桶中。试验周期为7 d,水温控制在(28±1)℃,24 h充氧,每天正常投喂、吸污、换水,观察凡纳滨对虾症状及统计7 d内累计死亡率,并对患病凡纳滨对虾再次进行病原菌分离鉴定。
1.4.3 组织病理观察
取感染组患病濒死凡纳滨对虾肝胰腺组织进行病理切片观察,以健康凡纳滨对虾肝胰腺组织作为对照组。用10%中性缓冲福尔马林固定液固定48 h,再转移到75%乙醇室温保存,常规制备石蜡组织切片,HE染色,光学显微镜观察肝胰腺组织病理变化。
1.5 病原菌鉴定
1.5.1 形态学及生理生化特征鉴定
将分离株接种于TSA固体培养基上,置于30 ℃恒温培养18 h,对平板上的菌落进行形态学观察以及革兰氏染色,同时按照VITEK2 Compact全自动细菌鉴定仪操作步骤,对分离株进行生理生化鉴定。
1.5.2 分子生物学鉴定
取适量菌悬液,根据TaKaRa细菌基因组DNA提取试剂盒说明书步骤,提取分离株基因组DNA。以基因组DNA为模板,对分离株进行16S rRNA、弧菌鉴定特异HSP60基因PCR检测,检测方法和引物序列参照相应来源文献,引物序列见表1。PCR反应体系为25.0 μL,其中PCR Premix 12.5 μL,上、下游引物各1.0 μL,菌株基因组DNA模板2.0 μL,无菌双蒸水8.5 μL,并设无菌双蒸水为阴性对照模板。PCR扩增产物送至生工生物工程(上海)股份有限公司测序,测序结果在GenBank中进行BLAST比对分析,并采用MEGAX 软件中Neighbor-Joining法,基于HSP60基因比对结果构建系统发育进化树,1 000次 Bootstrap重复检验,对分离株进行分子鉴定。
1.6 病原菌毒力基因的PCR检测
以基因组DNA为模板,进行菌株急性肝胰腺坏死病相关、以及副溶血弧菌的耐热直接溶血毒素基因和相对耐热直接溶血毒素基因的PCR检测,检测方法和引物序列参照相应来源文献,引物序列见表1。PCR反应体系同1.5.2PCR反应体系进行,PCR扩增产物经1.0%琼脂糖凝胶电泳(130 V,30 min),凝胶成像系统下拍照记录结果后,送至生工生物工程(上海)股份有限公司测序,测序结果在GenBank中进行BLAST比对分析。

表1 引物序列
1.7 病原菌药敏特性分析
采用(K-B)纸片扩散法,测定分离株对18种抗菌药物敏感性,参照美国临床和实验室标准协会(CLSL)抗生素敏感试验标准,分离菌株药敏结果用S(敏感)、I(中介)、R(耐药)进行记录。
2 结果与分析
2.1 病原菌分离结果
从患病凡纳滨对虾肝胰腺中分离获得一株优势菌,命名为 FHBX-1。该菌株在 TCBS培养基上菌落呈绿色,圆形,中央略微隆起,直径约2~3 mm;革兰氏染色呈阴性,菌体呈稍微弯曲的杆状(图1)。
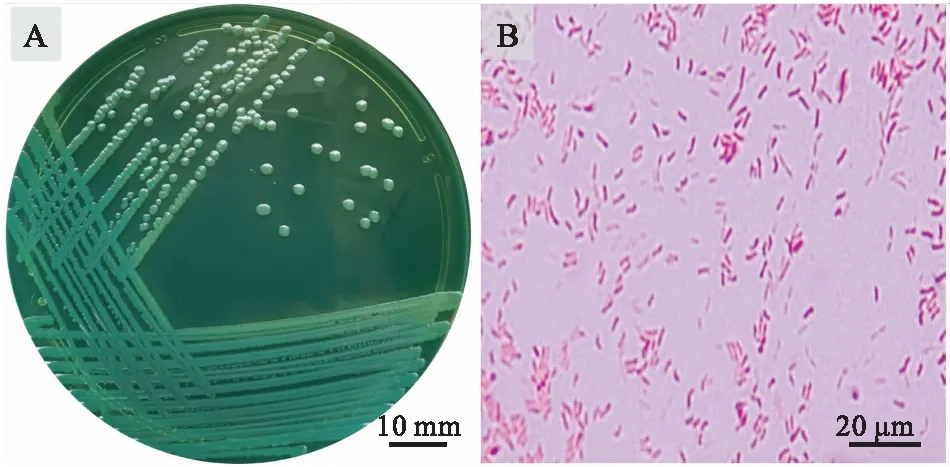
图1 FHBX-1菌株的形态特征
2.2 病原菌的鉴定结果
由表2可知,菌株FHBX-1生理生化鉴定结果与副溶血弧菌对照菌株FJLV01生理生化特征基本一致,且VITEK2 Compact全自动细菌鉴定仪鉴定菌株FHBX-1为副溶血弧菌,可信度高达99%。基于16S rRNA基因序列在GenBank上进行同源性比对分析结果显示,该菌株与弧菌属的副溶血弧菌、哈维氏弧菌、溶藻弧菌相似度超过98%,但菌种无法确定。进一步基于弧菌鉴定特异60基因进行序列比对构建系统进化发育树显示,菌株FHBX-1与副溶血弧菌聚为一支,与副溶血弧菌NB1013株(GenBank登录号:DQ279072.1)进化关系最近(图2)。综合上述结果以及菌株形态学特征,可判定菌株FHBX-1为副溶血弧菌。
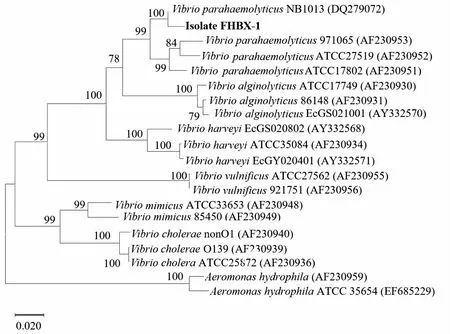
图2 基于HSP60基因序列构建的菌株FHBX-1与相近菌株的系统发育树
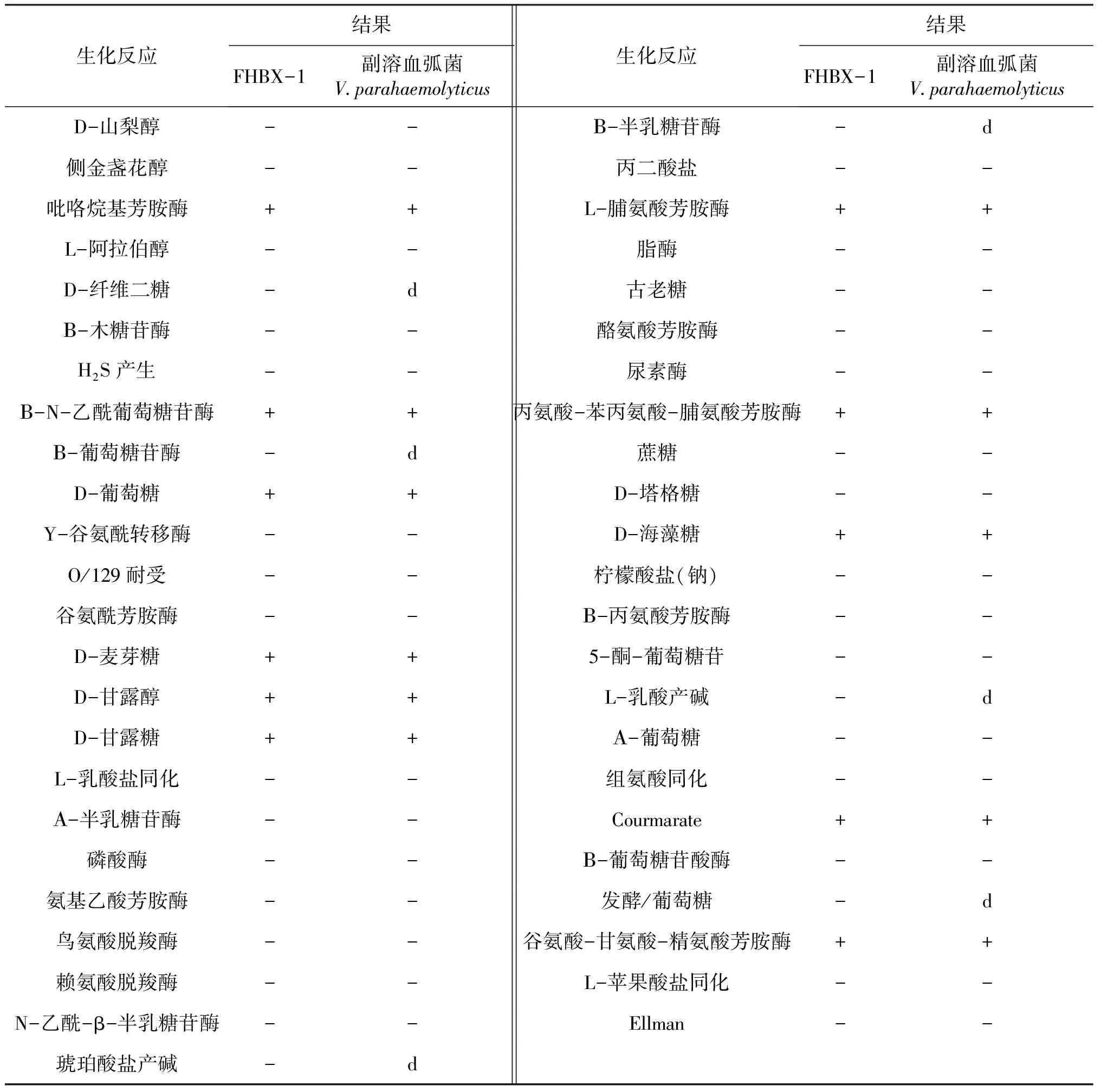
表2 菌株FHBX-1的生理生化结果
2.3 人工回归感染试验及组织病理观察
人工回归感染试验,感染组凡纳滨对虾在攻毒感染后出现肝胰腺萎缩、颜色变浅,空肠空胃,虾体发白、变软,摄食减少,活力萎靡等病症与自然患病凡纳滨对虾病症基本一致。感染组凡纳滨对虾在感染后第1 d已出现死亡情况,7 d内累计死亡率为80%;对照组凡纳滨对虾摄食、活力均正常,未发生死亡情况。从感染组濒死凡纳滨对虾肝胰腺组织再次分离的优势细菌与菌株FHBX-1生理生化、分子生物学特征相同,由此判断菌株FHBX-1是引起凡纳滨对虾发病死亡的病原菌。取感染组濒死凡纳滨对虾肝胰腺组织进行病理切片观察,结果显示:健康组凡纳滨对虾肝胰腺组织肝小管结构清晰,肝胰腺上皮细胞排列整齐,可以分辨出分泌细胞(B)、吸收细胞(R)及纤维细胞(F)(图3A)。感染组凡纳滨对虾肝胰腺组织发生严重的病理变化,肝胰腺上皮细胞排列紊乱,肝小管管腔变大(图3B),肝胰腺上皮细胞脱落至管腔内(图3C),细胞之间界限不清,无法辨认出B、R、F细胞,肝小管结构消失,仅见无结构的组织团(图3D),呈典型急性肝胰腺坏死病的病理特征。
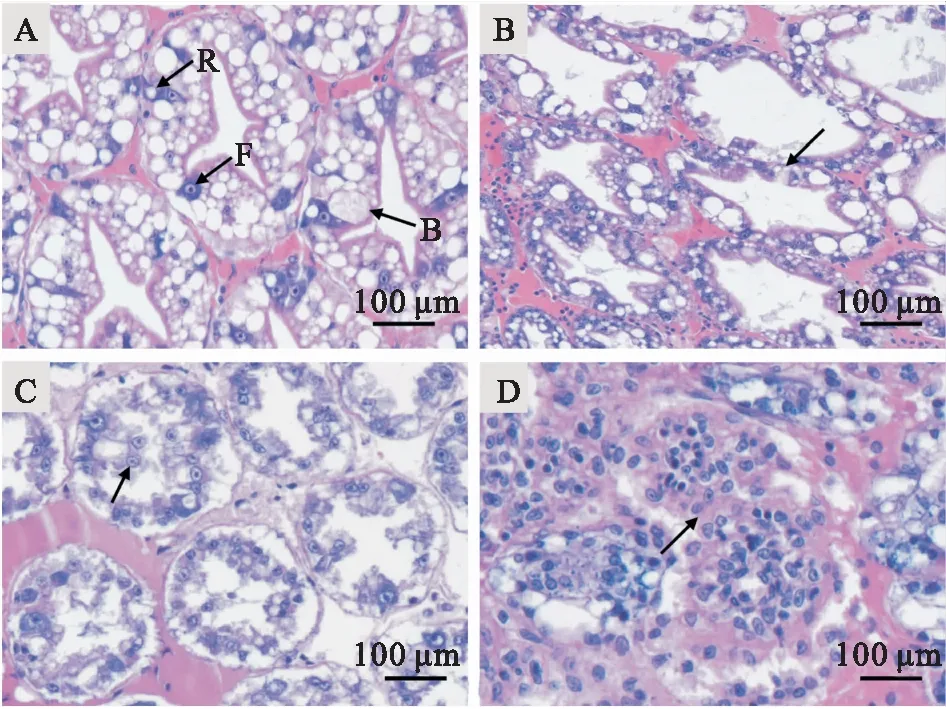
图3 健康凡纳滨对虾与患病凡纳滨对虾的肝胰腺组织病理特征
2.4 病原菌的毒力基因分析
参照HAN等、TEY等文献方法以及水产行业标准SC/T 7233-2020(急性肝胰腺坏死病诊断规程)的套式PCR方法,分离株FHBX-1毒力基因检测结果如图4所示,、以及&基因PCR扩增结果为均为阳性,条带大小分别为284 bp、392 bp(图4A)和230 bp(图4B),扩增产物送生工测序,测序结果经BLAST序列同源性比对分析结果显示,分别与副溶血弧菌BpShHep18(GenBank登录号:MH388411.1)的基因序列相似为98.41%、副溶血弧菌R13(GenBank登录号:MK368635.1)的基因序列相似为96.18%、副溶血弧菌YH3(GenBank登录号:MH718270.1)的&基因序列相似度为100%。但该分离株耐热直接溶血毒素基因、相对耐热直接溶血毒素基因PCR扩增结果均为阴性。
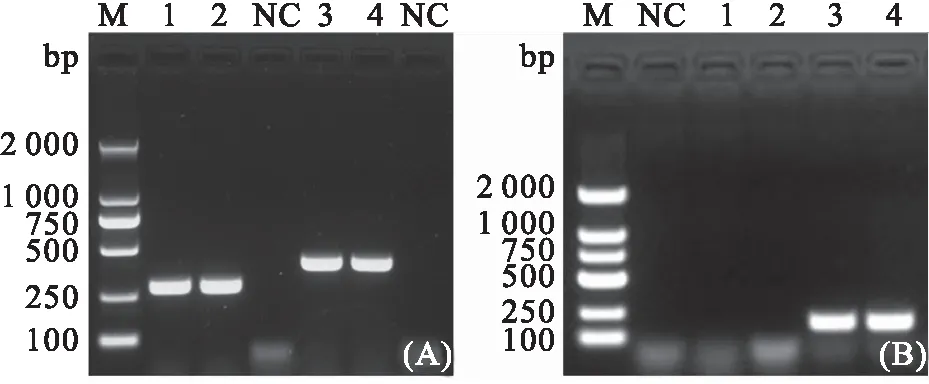
图4 菌株FHBX-1毒力基因PCR扩增结果
A:健康凡纳滨对虾的肝胰腺[肝细胞排列整齐,B-分泌细胞,F-纤维细胞,R-吸收细胞(箭头)];B:患病凡纳滨对虾的肝胰腺[箭头示肝细胞排列紊乱,肝小管管腔变大];C:患病凡纳滨对虾的肝胰腺[箭头示肝胰腺上皮细胞脱落至管腔];D:患病凡纳滨对虾的肝胰腺[箭头示肝小管结构消失,仅见无结构的组织团]。
2.5 病原菌的药敏特征
菌株FHBX-1对18种抗菌药物敏感性试验结果如表3所示,菌株FHBX-1对氟苯尼考、多西环素、恩诺沙星、头孢他啶、复方新诺明等11种抗菌药物敏感,对新霉素、红霉素2种抗生素中介,而对链霉素、庆大霉素、氨苄西林、磺胺甲噁唑等5种抗菌药物耐药。
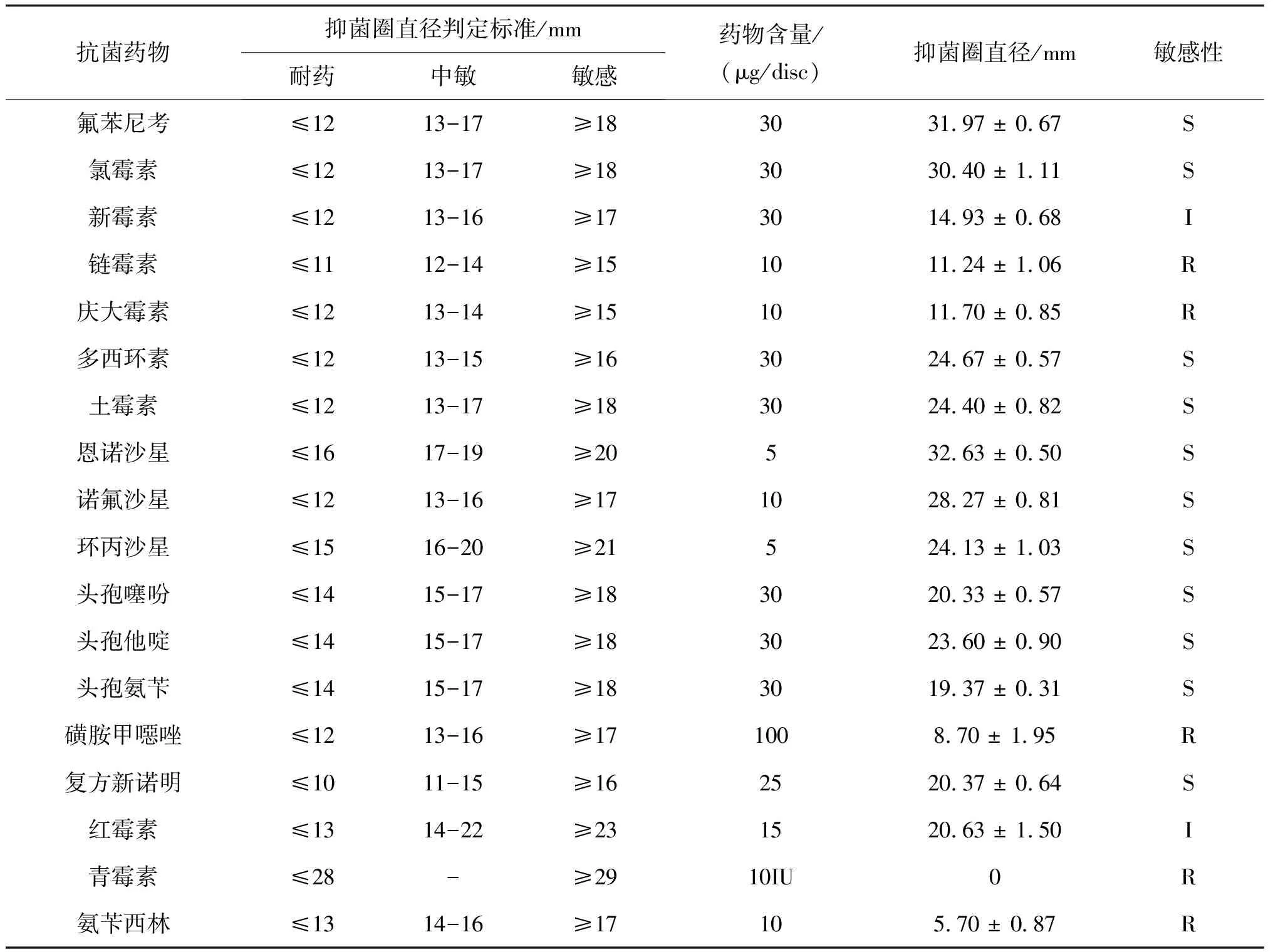
表3 菌株FHBX-1药敏试验结果
3 讨论
对虾急性肝胰腺坏死病于2009年首次在中国发现,随后在越南、马来西亚、墨西哥等对虾主要养殖国家也陆续暴发,每年造成全球对虾养殖经济损失高达十亿美元以上,该病已成为阻碍对虾养殖业健康发展的主要细菌性疾病。相关研究显示,急性肝胰腺坏死病的致病菌包括副溶血弧菌、哈维氏弧菌、欧文斯氏弧菌等。本研究从上海市奉贤区疑似患急性肝胰腺坏死病的凡纳滨对虾肝胰腺组织分离出一株优势菌株,经菌株形态学、生理生化以及分子生物学鉴定确定了该菌株为副溶血弧菌。基于16S rRNA、60基因序列的分析鉴定,表明60基因在弧菌属细菌具相对的保守性、又有一定种间变异性的特点,较16S rRNA更适合区分鉴定高相似度弧菌种间的聚类分析。
副溶血弧菌已是我国首要的食源性致病菌,能引起人类急性腹泻、呕吐、败血症等食物中毒病症,其、基因常作为人源致病性副溶血弧菌毒力的检测靶标基因。本研究分离株FHBX-1的、基因PCR检测结果均为阴性,与余达勇等在浙江台州分离获得的急性肝胰腺坏死病致病性副溶血弧菌株HY3检测结果一致。目前国内鲜见水产虾源副溶血弧菌、基因阳性样品,但国外学者SUJEEWA等、RAHIMI等已陆续发现虾源副溶血弧菌、基因阳性的菌株。因此,水产虾源副溶血弧菌、基因携带情况仍需持续关注,以便准确评估人与虾共患病的潜在风险。
本研究分离株FHBX-1急性肝胰腺坏死病相关的毒力基因、的 PCR扩增结果均为阳性,在菌液浓度为1.0×10CFU/mL人工浸泡感染试验中,感染组凡纳滨对虾7 d内累计死亡率为80%,这与林楠在福州分离获得的对虾急性肝胰腺坏死病致病性副溶血弧菌株FJLV01的试验结果类似,而与贾丹等从山东潍坊分离获得的副溶血弧菌株20160303005-1相比毒力较弱。感染组濒死凡纳滨对虾出现明显的甲壳变软,空肠空胃,肝胰腺萎缩等症状,且组织病理观察发现肝胰腺上皮细胞严重脱落,肝小管崩塌,与侯巧利等在舟山观察患急性肝胰腺坏死病凡纳滨对虾的肝胰腺组织的病理变化相似,呈典型的急性肝胰腺坏死病的病理学特征。上述试验结果表明,本研究分离到的副溶血弧菌FHBX-1对凡纳滨对虾有较强的致病力,是引起上海奉贤某对虾养殖场凡纳滨对虾大量死亡的致病菌。
本研究分离株FHBX-1对氟苯尼考、多西环素、恩诺沙星、头孢他啶、复方新诺明等11种抗菌药物敏感,而对链霉素、庆大霉素、氨苄西林、磺胺甲噁唑等5种抗菌药物耐药,这与贾丹等分离获得的凡纳滨对虾源副溶血弧菌株20160303005-1对庆大霉素、阿米卡星、妥布霉素等抗菌药物敏感,但对阿莫西林、复方新诺明等抗菌药物耐药试验结果存在明显差异;与DONG等分离获得的对虾源副溶血弧菌株Vp2S01对环丙沙星、头孢曲松、诺氟沙星、呋喃妥因等17种抗菌药物耐药或中介,仅对氟苯尼考敏感也有不同,说明凡纳滨对虾源副溶血弧菌不同菌株之间药敏特性存在差异。因此,养殖中对凡纳滨对虾急性肝胰腺坏死病进行药物防治时需先进行药物敏性筛选试验,选择最敏感的药物治疗,以提高疾病的防治效果,避免药物的过量滥用情况。此外,由于急性肝胰腺坏死病在国内对虾养殖场频频暴发且有持续流行和扩大趋势,建议养殖户购苗时做好该病筛查,尽量选购无特定病原体的SPF虾苗,为养殖后期的稳产稳收提供基础保障。

