Metafer 5玻片自动扫描系统在循环肿瘤细胞检测中辅助诊断的应用
蒋婷婷,王 丹,李和沛,李燕雏*
(四川大学华西医院 a. 头颈肿瘤科;b. 肿瘤放疗科,成都 610041)
2021年,美国癌症学会(American Cancer Society Association,ASCO)发布了最新版癌症统计数据,全球约有1930万例新发癌症病例,其中1000万例癌症患者死亡[1]。癌症的复发和转移是导致患者死亡的主要原因。既往数据显示[2],癌症的复发和转移在发病早期就已出现,但常规影像学和血液指标检查难以发现早期癌症,且不能实时动态监测病情的发展,可能导致患者错过最佳的治疗时机。新一代肿瘤标志物循环肿瘤细胞(circulating tumor cells,CTCs)检测不仅能辅助肿瘤早期诊断、实时监测病情的发展、评估疗效,还能进一步通过CTCs开展耐药机制研究[2],为病人制定精准化的治疗方案。
目前,CTCs富集和检测的方法包括CellsearchTM、CellcollectorTM等,他们各具优势,并已被应用于科研及临床,但在临床使用推广中还存在诸多问题,如特异性差、灵敏度低和结果重现性差等[3-4]。美国赛特公司研发的差相富集-荧光原位杂交(subtraction enrichment-immunostainning fluorescencein situhybridization,SE-iFISH)技术是一种CTCs反向富集系统,能有效分离富集的CTCs,具有较高的敏感性和特异性[5-6]。经过分离富集的CTCs因采用荧光免疫抗体和荧光探针染色,需进一步在荧光显微镜下分析荧光信号的表达情况,以对其进行判别。在目前的人工镜检状态下,人工视力疲劳、技师阅片经验差别、人眼生理视觉范围限制、人工耗时长等均成为人工镜检判读CTCs的限制性缺陷,导致阅片效率和准确度均降低。目前,高通量玻片自动扫描系统(Metafer 5)是一种具有多种用途的玻片数字化扫描及分析系统,在生命科学领域显微图像分析上实现了智能化自动分析,能开展自动扫描系统智能、快速、全自动阅片,精准定位并存储所有细胞图像的数字坐标,明显缩短了阅片时间,提高了阅片效率和准确率。本研究采用肿瘤患者外周血液样本验证及评价Metafer 5自动扫描平台检测CTCs的准确性和灵敏度,建立完善的试验标准操作流程,为临床使用提供参考。
1 材料与方法
1.1 研究对象
研究对象为四川大学华西医院2015年12月至2016年6月收治的34例肿瘤患者。其中,女性18例,男性16例,年龄28~65岁,中位年龄为46.5岁,平均年龄为(48.51±0.61)岁;肝癌6例,胰腺癌2例,神经胶质瘤4例,胃癌5例,肾癌2例,鼻咽癌15例。本研究已获四川大学华西医院伦理委员会批准,伦理编号为2015年审(141)号,且所有受试者均自愿签订了知情同意书。
1.2 试剂与仪器
SE-iFISH检测试剂盒购于赛特生物有限公司(Cytelligen,美国),包括外周血循环肿瘤细胞富集试剂盒和肿瘤细胞瘤标-iFISH检测试剂盒。
Metafer 5玻片自动扫描系统由Zeiss Imager Z2正置荧光显微镜(Zeiss,德国)、电动载物台、CCD相机、计算机和Metafer 5 CTCs扫描软件模块、CTCs图像采集软件模块、CTCs细胞计数信号模块、CTCs图像处理模块和CTCs数据储存模块(MetaSystems,德国)组成。人工镜检使用尼康正置荧光生物显微镜Ni-U(Nikon,日本)。
1.3 CTCs检测操作流程
经患者肘静脉采血6 mL于BD抗凝黄头采血管中(Becton,Dickinson and Company),置于4℃避光保存,样本离体24 h内检测。应用密度梯度离心法去除血液中的红细胞,用CD45磁珠抗体去除血液中的白细胞,应用免疫荧光技术对肿瘤细胞进行染色,再利用荧光原位杂交技术标记8号染色体着丝粒位点(centromere enumeration probe,CEP8)。Anti-EpCAM-FITC标记肿瘤特异性抗原EpCAM(镜下显示绿色),Anti-CD45-TexRed标记白细胞膜蛋白特异性抗原CD45(镜下显示红色),4',6-二脒基-2-苯基吲哚(4',6-diamino-2-phenyl indole,DAPI)Mounting media标记细胞核区域的DNA(镜下显示蓝色),CEP8 DNA Probe-Rhodamie标记CEP8的DNA片段(镜下显示橙色)。经过荧光染色后的细胞悬液加入缓冲液清洗后再加入细胞固定液,涂于专用的格式化载玻片框内,然后用盖玻片封片。上述操作完成后,在荧光显微镜下分别采用人工镜检和Metafer 5玻片自动扫描系统两种方法阅片。
人工镜检阅片中,每张载玻片分别由2名经验丰富的技师阅片。在长寿命金属卤化物荧光X-Cite 200DC System(X-Cite,美国)光源下,先将正置荧光显微镜Axio Imager.Z2(ZEISS,德国)的物镜调至10×(或者20×),按照“从上往下、从左至右”的读片规则依次读片,在Filter set for DAPI(激发波长范围为352~402 nm,发射波长范围为417~477 nm)、Filter set for FITC/Sp GreenTM(激发波长范围为435~475 nm,发射波长范围为530~543 nm)、Filter set for Sp GoldTM/Sp OrangeTM(激发波长范围为500~590 nm,发射波长范围为526~546 nm)和Filter set for TexasRed® and Sp Red(激发波长范围为542~528 nm,发射波长范围为606~644 nm)四种不同荧光滤片下观察荧光表达情况。首先利用Filter set for TexasRed® and Sp Red在蓝光激发下找出CD45阴性细胞,并利用Filter set for Sp GoldTM/Sp OrangeTM在绿光激发下观察及确定8号染色体的数目(橙色荧光),再进一步自动调换至Filter set for DAPI滤片,在紫光激发下观察DAPI标记细胞核区域的DNA(蓝色荧光),最后自动调换滤片至Filter set for FITC/Sp GreenTM,在蓝光激发下观察荧光染料Anti-EpCAM-FITC标记的肿瘤细胞蛋白抗体EpCAM(绿色荧光)。
Metafer 5玻片自动扫描系统阅片中可设置8张载玻片的扫描参数。具体步骤主要如下:1)命名分类器类型;2)筛选出最佳10×PA物镜后,扫描平台对整张载玻片分区并自动对焦,根据扫描DAPI细胞核染色区域,计算机自动推算出核周红色、绿色平均荧光强度和细胞周围的背景强度;3)根据优化后的各个荧光通道的曝光时间和曝光方式,Metafer 5自动化扫描平台设置相应的扫描程序参数,CCD相机进一步对载玻片的各个分区进行多层图像拍摄,计算机根据多层图像拍摄后算出的荧光数据自动对扫描图像进行筛选分类计数,同时对筛选出的高质量图像进行数据储存,生成图像库文件夹(*.MSD)和全分辨率视场文件夹(*.MSX);4)利用计算机自动筛选图片库分类和直方图等统计功能选择特定满足要求的CTCs图像。
1.4 CTCs的判读参考标准
CTCs的判读标准为肿瘤标志物EpCAM阳性或阴性,白细胞抗原CD45阴性,细胞核DAPI阳性,CEP8阳性。即当EpCAM+/CD45-/DAPI+同时8号染色体的个数≥2个,或EpCAM-/CD45-/DAPI+同时8号染色体的个数>2个时,判定该细胞为CTCs[7-9]。
1.5 统计学方法
采用IBM SPSS 26.0版本对收集的数据进行分析,正态分布计量资料用平均值±标准差(±s)表示,非正态分布计量资料用中位数(最小值,最大值)表示,等级资料采用斯皮尔曼相关系数分析,定量资料之间的比较采用两独立样本t检验,计数资料之间的相关分析采用卡方检验。0.1<P<0.05 表示显著性差异,P>0.05表示无显著性差异。
2 结果与分析
2.1 格式化载玻片的区域化自动对焦荧光优化结果
整张载玻片上存在多个凹凸不平的平面,将载玻片平均分为81等份后进行区域化对焦。用SEiFISH技术对分离富集的CTCs图像进行处理时,难以清晰判断细胞质区域的染色,非荧光背景严重干扰格式化载玻片的区域化自动对焦,因此需为自动对焦选择适配的对焦染料。通过对DAPI、Rhodamie、FITC、TexRed四种荧光染色剂筛选(表1),结果发现,DAPI的荧光强度高,且受非特异性染色影响小,是最适用于Metafer 5区域化自动对焦的荧光染料。
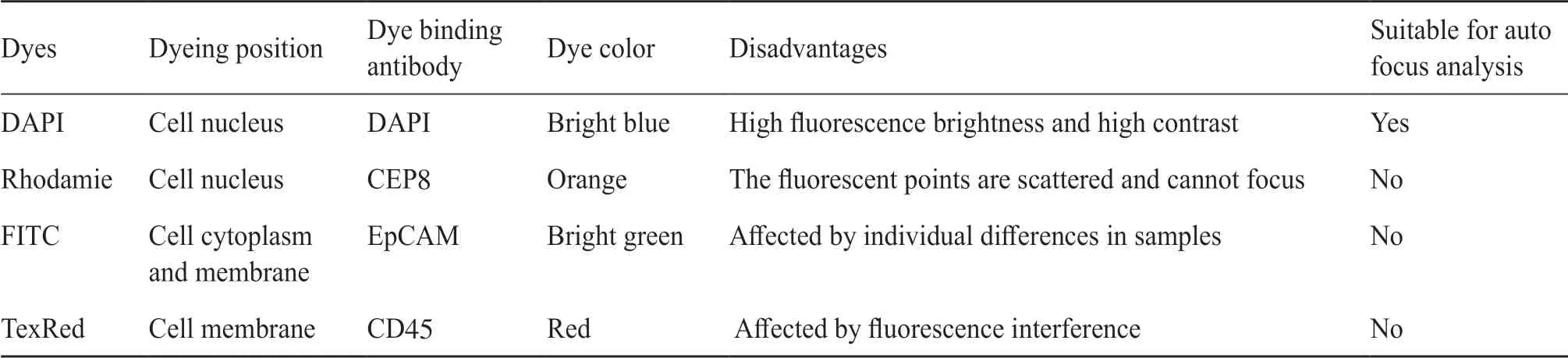
表1 四种荧光染料自动对焦结果统计表Tab. 1 Statistical table of autofocusing results of four kinds of fluorescent dyes
2.2 Metafer 5玻片自动扫描系统的物镜镜头优化结果
为了比较10×PA(Objective “Plan-Apochromat” 10×/0.45 M27,平场复消色差物镜)和10×PN(Objective “EC Plan-Neofluar”10×/0.30 M27,增强反差型平场荧光物镜)两种物镜镜头的效果,用上述两种镜头分别扫描CTCs样本。对10例富集染色后的格式化载玻片进行阅片,其统计结果如下(表2):10例样本载玻片中,10×PA物镜人工镜检和Metafer 5玻片自动扫描系统判读CTCs的计数分别为(10.10±4.56)、(10.20±4.71)个,相对于人工镜检,Metafer 5玻片自动扫描系统扫描的CTCs数量无差异(P>0.05)。10×PN物镜人工镜检和Metafer 5玻片自动扫描系统判读CTCs的计数分别为(8.70±4.27)和(6.90±3.41)个,相对于人工镜检,Metafer 5玻片自动扫描系统扫描CTCs的个数多1.8个(P>0.05)。用10×PA物镜经自动扫描系统判读CTCs,7例(7/10,70.0%)载玻片的CTCs计数与人工镜检判读结果一致,2例(2/10,20.0%)用10×PA物镜经自动扫描系统CTCs数量比人工镜检多,1例(1/10,10.0%)用10×PA物镜经自动扫描系统CTCs数量比人工镜检少。

表2 10×PA和10×PN两种物镜镜头的扫描结果统计表Tab. 2 Statistical analysis of scanning results of 10×PA and 10×PN objective lenses
在这10例血样载玻片中,10×PA物镜人工镜检和Metafer 5玻片自动扫描系统判读CTCs的平均时间分别为(114.70±22.08)、(41.30±4.62)min,相对于人工法,自动扫描系统阅片减少了73.40 min(P<0.05);10×PN物镜人工镜检和Metafer 5玻片自动扫描系统阅读的平均时间分别为(116.50±47.38)和(49.80±6.58)min,相对于人工镜检,自动扫描系统阅片减少了66.70 min(P<0.05)。10×PA物镜比10×PN物镜扫描的时间更短,更节省时间,降低了时间成本(表2)。
10×PA的物镜镜头判读CTCs所耗的时间更短、计数更精准,扫描处理后的图像更清晰,CTCs图像质量更佳。
2.3 Metafer 5玻片自动扫描系统的扫描效率优化结果
基于表3中Sample 11至Sample 20的样本数据,通过10×PA物镜在人工镜检和Metafer 5玻片自动扫描系统判读10张样本CTCs的平均时间分别为(121.00±12.77)和(149.00±19.27)min,通过20×PA物镜在人工镜检和Metafer 5玻片自动扫描系统判读10张样本CTCs的平均时间分别为(36.70±9.36)和(88.80±7.15)min。相对于人工镜检,10×PA物镜和20×PA物镜自动扫描系统阅片分别减少了84.30 min(P<0.05)、60.20 min(P<0.05),10×PA物镜比20×PA物镜扫描时间更短,扫描效率更高。在10例样片中,10×PA物镜和20×PA物镜在Metafer 5玻片自动扫描系统判读CTCs的平均计数分别为(10.70±5.27)、(10.00±5.70)个,10×PA物镜比20×PA镜扫描CTCs个数多0.7个(P>0.05)。10×PA的物镜扫描CTCs的个数较多,所耗费的时间更短(表3)。

表3 10×PA和20×PA两种物镜镜头的扫描结果统计表Tab. 3 Statistical analysis of scanning results of 10×PA and 20×PA objective lenses
2.4 Metafer 5玻片自动扫描系统的荧光曝光时间优化结果
采用10×PA物镜在Metafer 5玻片自动扫描系统上分别调试DAPI、FITC、TexRed、Rhodamie四种荧光通道的曝光时间和曝光方式(图1)。DAPI(亮蓝色)曝光时间试运行设置为0.001、0.003、0.004 s,经测试,DAPI筛选CTCs的最佳曝光时间为0.003 s;FITC(亮绿色)曝光时间试运行设置为0.700、0.800、0.900 s,经测试,FITC最佳曝光时间为0.800 s;TexRed(红色)曝光时间试运行设置为0.030、0.040、0.050 s,经测试,TexRed筛选CTCs的最佳曝光时间为0.040 s;Rhodamie(橙色)曝光时间试运行设置为0.066、0.068、0.070 s,经测试,Rhodamie筛选CTCs的最佳曝光时间为0.068 s。
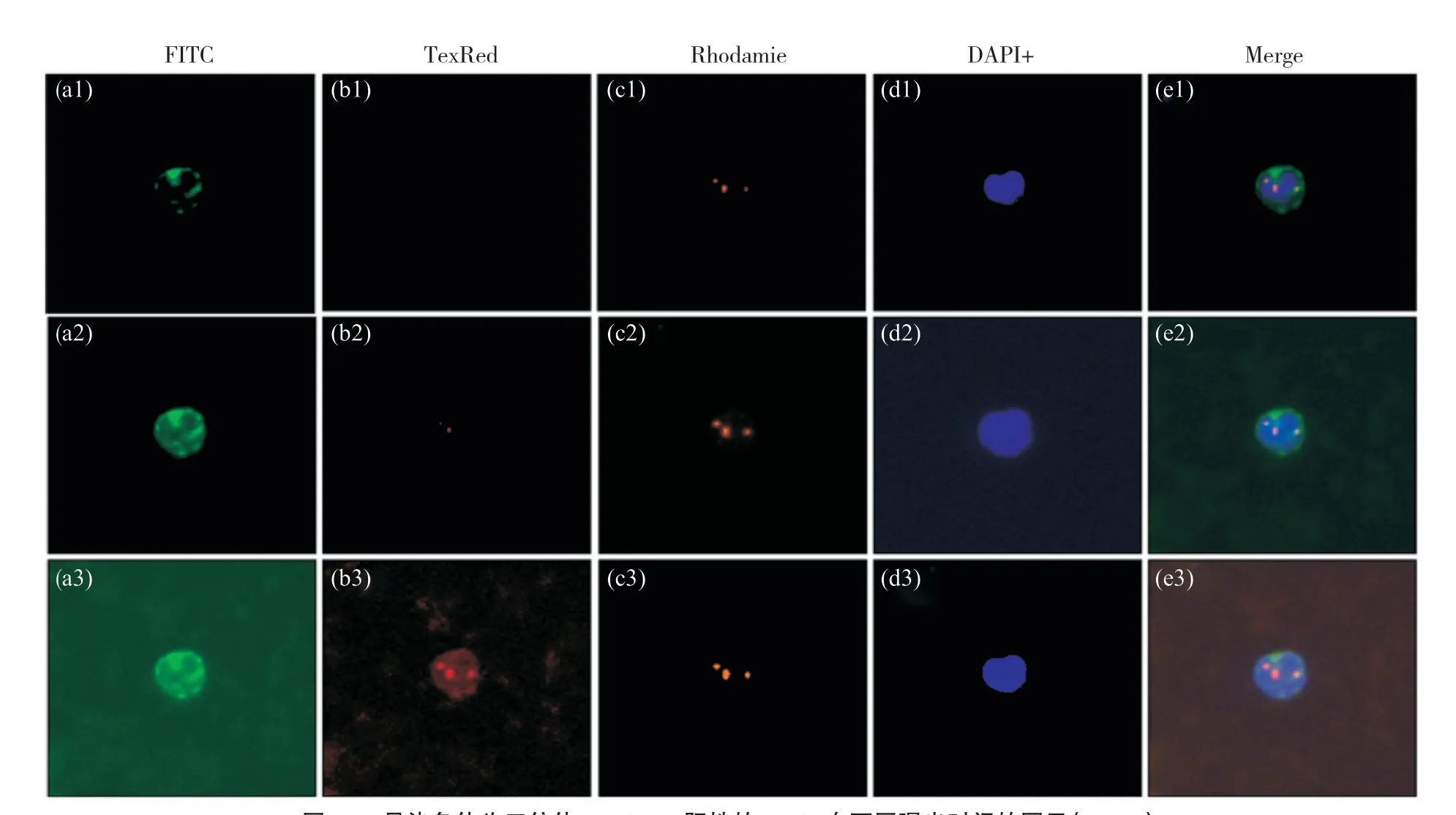
图1 8号染色体为三倍体,EpCAM阳性的CTCs在不同曝光时间的图示(100×)Fig. 1 Illustration of four fluorescence of CTCs at different exposure times (100×)图a1、a2和a3为FITC曝光时间分别为0.700、0.800、0.900 s;图b1、b2和b3为TexRed曝光时间分别为0.030、0.040、0.050 s;图c1、c2和c3为Rhodamie曝光时间分别为0.066、0.068、0.070 s;图d1、d2和d3为DAPI曝光时间分别为0.001、0.003、0.004 s;图e1、e2和e3为四种荧光的合成图。DAPI+:亮蓝色/DNA;Rhodamie+:橙色/CEP8;TexRed+:红色/CD45;FITC+:亮绿色/EpCAM。Figures a1, a2 and a3 shown FITC exposure time of 0.700, 0.800 and 0.900 s, respectively; Figures b1, b2 and b3 shown TexRed exposure time of 0.030, 0.040 and 0.050 s, respectively; Figures c1, c2 and c3 shown Rhodamie exposure time of 0.066, 0.068 and 0.070 s, respectively; Figures d1, d2 and d3 shown DAPI exposure time of 0.001, 0.003 and 0.004 s, respectively; Figures e1, e2 and e3 were the merge figures. DAPI+: Blue/DNA; Rhodamie+: Orange/CEP8; TexRed+: Red/CD45; FITC+: Green/EpCAM.
2.5 Metafer 5玻片自动扫描系统和人工镜检的 检出率比较结果
本研究的34例样本来源于肝癌、胰腺癌、神经胶质瘤、胃癌、肾癌、鼻咽癌等临床常见肿瘤患者的新鲜血液,应用Metafer 5玻片自动扫描系统总共检测出CTCs的有34例,CTCs的阳性检出率为100.00%(34/34);采用人工镜检总共检测出CTCs的有31例,CTCs的阳性检出率为91.17%(31/34)。与人工镜检相比较,Metafer 5玻片自动扫描系统比人工镜检CTCs阳性检出率高了8.83%。
3 讨论
Metafer系列软件是具有多种功能的玻片扫描平台,已广泛应用于法医学、毒理学、病理学、细胞遗传诊断等领域。Metafer系列软件版本有Metafer 4和Metafer 5,Metafer 4被应用于临床产前诊断染色体核型分析[10]和辐射生物学的微核检测[11],而Metafer 5被用于临床CTCs检测的适用性能研究还暂未报道。
SE-iFISH循环肿瘤细胞富集技术不依赖CTCs的形态、大小以及细胞表面标志物(EpCAM、CK18/19、PD-L1等)的表达。使用SE-iFISH法不仅能分离计数CTCs,还能对CTCs进行分型。该方法具有高度的敏感性和特异性[12]。Li等[13]的研究显示,纳入的进展期胃癌患者其SE-iFISH技术CTCs总检测率为90.50% ,而CellSearchTM系统检测率仅为54.80%。随着二代测序技术的发展,CTCs的简单计数将不再能满足临床及试验研究的需要,临床需要更深入的基因分子数据用于肿瘤耐药性分析及前瞻性药物敏感性分析,以指导临床用药及患者预后判断。研究显示,肿瘤细胞内核型异倍体数目高低与肿瘤的恶性程度成正相关[14-15],同时,肿瘤细胞内的癌基因KRAS及抑癌基因TP53的突变频率较正常细胞高[16-18]。本研究在采用SE-iFISH法富集待检测的循环肿瘤细胞基础上,整合使用Metafer 5玻片自动扫描系统,建立全自动扫描平台,通过自动对焦、实时图像处理、自动寻找等获得高质量的荧光图像和位置数据,然后扫描整张载玻片,最后进行自动化判别CTCs,为进一步的肿瘤单细胞基因组分析奠定了基础;同时,全自动扫片不仅降低了人力和时间成本,还避免了人为经验缺失引起的错误检测结果。
既往研究证实,荧光背景、曝光强度、观察物镜性能及观察物镜倍数是影响CTCs自动判定的重要影响因素[19]。一方面,在载玻片和盖玻片上有荧光杂质、纤维等较多非特异性荧光背景影响情况下,Metafer 5玻片自动扫描系统不能通过Rhodamie、FITC、TexRed、DAPI 四种荧光准确对焦,从而导致扫描范围面积变小。同时,本研究结合DAPI、Rhodamie、FITC、TexRed 四种荧光染色剂的发光特点,通过比对后最终选定亮蓝色的DAPI为区域性对焦的染料,一定程度上解决了本系统对于区域性自动扫描的对焦问题。不仅如此,本研究通过改进制备CTCs的标准操作流程,进一步调整了DAPI的使用顺序,使DAPI更容易穿透细胞膜和细胞质,与细胞核的DNA结合更牢固,荧光显微镜下DAPI在蓝色荧光通道下更明亮,实现了更精准的区域化对焦。另一方面,Metafer 5玻片自动扫描系统在使用过程中可出现因临床样本多样化导致漏筛CTCs的风险。既往研究发现,对于CD45强表达的细胞,载玻片荧光背景非特异性染色较强,小细胞核CEP8探针较多,可能是因为探针较弱的橙色荧光被红色荧光掩盖,导致软件识别时被漏掉[20]。为了避免强红色荧光背景和非特异性染色导致曝光不够,引起系统错判CTCs细胞或丢失视野中其他细胞的情况,软件设置了一个最低曝光时间,但同时也可能因曝光时间低,导致一些弱表达EpCAM抗体的肿瘤细胞因背景红色荧光曝光时间过低而丢失。因此,在保证CTCs计数准确的前提下,本研究设置了合理的红色荧光曝光时间为0.040 s。为在临床使用中保障检测的准确性,可经人工核查分析整张样片的荧光表达情况。基于本研究结果,我们认为,弱表达EpCAM抗体的肿瘤细胞检测丢失可能与患者血液样本中的蛋白含量、样片保存时间、规范采血、中央运输样本等各个环节有关。为获得精确的检测结果,必须建立标准化的制备CTCs流程和质量控制体系,如采血标本要正确保存、运输,制作样片的试剂质量要有保证,操作环境需要保持洁净等。同时,通过10×PA物镜以及20×PA物镜分别在人工镜检和Metafer 5玻片自动扫描系统中各判读10张样本,结果发现,采用10×PA镜头扫描的图片更为清晰、扫描效率更高,提示该镜头更能有效辅助识别CTCs。
综上所述,Metafer 5玻片自动扫描系统具有高特异性、高敏感性、重复性好和完全自动化的特点,规范了CTCs的判别标准,有效缓解了工作人员长期在暗室中的视力损伤问题,将工作人员从繁冗的阅片工作中解脱出来,适用于临床应用。但Metafer 5玻片自动扫描系统须根据各实验室实际检测条件精准优化设备参数,以保障检测的灵敏度及准确性。不仅如此,Metafer 5玻片自动扫描系统仍需大量的新鲜临床标本进一步验证其适用性,根据临床实际扫片过程中发现的问题来更新软件参数,优化软件程序,提高软件的通用性和正确率。

