血液透析对肾衰大鼠心功能的影响及机制研究*
张 培,朱新旺,孙亚南,穆中一
(1.中国医科大学附属第一医院肾内科,沈阳 110000;2.辽宁省肿瘤医院泌尿外科,沈阳 110000)
肾衰患者病死率高,45%~60%的死亡患者死因为心血管疾病,包括心脏结构改变、心力衰竭等[1-2]。研究表明,炎症为肾衰患者发生心血管疾病的机制之一。血液透析为肾衰常用肾脏替代治疗方式之一,可经对流、弥散等方式进行物质交换,对体内代谢废物进行清除,纠正酸碱、电解质失衡,提升心血管稳定性[3-4]。此外,血液透析在缓解肾衰患者炎性反应、氧化应激中有一定价值,有利于保护心功能,增强右心室游离壁纵向收缩功能,但其作用机制尚不明确[5]。本研究通过建立肾衰大鼠模型,重点分析血液透析对肾衰大鼠心功能的影响,并探讨其作用机制。
1 材料与方法
1.1 材料
1.1.1实验动物
40只清洁级健康雄性SD大鼠,购自北京生物制品研究所有限责任公司,许可证号:SYXK(京)2016-0051。
1.1.2仪器与试剂
Toll样受体4(TLR4)/核因子-κB(NF-κB)通路激动剂脂多糖(LPS,美国Sigma公司);磷酸肌酸激酶(CK)、肌酸激酶同工酶(CK-MB)试剂盒(北京利德曼生物技术有限公司);白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)ELISA试剂盒(武汉博士德生物工程有限公司);兔抗大鼠TLR4、p-NF-κB p65、NF-κB p65、caspase-3一抗(美国CST公司);AK-200血液透析器(瑞典Gambro医疗器械公司)。
1.2 方法
1.2.1模型制备及分组
40只大鼠中取10只作为假手术组,其余30只制备肾衰大鼠模型[6]。大鼠麻醉后,于左侧肋弓下0.5 cm、脊柱左旁1 cm处,作垂直于脊柱的切口,暴露左肾,结扎、缝合左肾动脉2/3分支,1周后将右肾摘除。建模4周后取尾静脉血检测肌酐、尿素氮水平高于假手术组(P<0.05),表示建模成功。30只大鼠建模成功24只,成功率80%。将24只大鼠随机分为模型组、激动剂组、血液透析组,每组各8只,假手术组大鼠不结扎左肾动脉,其余步骤同上。
1.2.2动物干预
建模成功24 h后,血液透析组大鼠右股静脉留置8 F双腔静脉导管,通过小儿专用动静脉透析管路,连接血液透析器,透析面积0.7 m2。肝素抗凝,初始剂量50 U/kg,维持剂量25 U/(kg·h)。血液透析速度随大鼠血压变化而调整,维持55~90 mL/min,透析时间1 h,1周3次,持续3周。激动剂组血液透析方法同血液透析组,每次透析后,尾静脉注射10 μg/mL LPS。假手术组和模型组以1.5 mL 0.9%氯化钠溶液灌胃,每天1次,持续3周。
1.2.3心脏超声检查
治疗结束后72 h,超声检测左心室舒张期末压(LVEDP)、左心室收缩压(LVSP)、左心室内压最大上升速率(+dp/dtmax)、左心室内压最大下降速率(-dp/dtmax)。
1.2.4肾功能指标检测
处死大鼠,取下腔静脉血,离心取上清液,采用全自动生化分析仪检测肌酐和尿素氮水平。
1.2.5酶联免疫法
取下腔静脉血,离心,分离血清,采用全自动生化分析仪检测CK、CK-MB水平。
1.2.6HE染色法
切取心肌组织置于4%多聚甲醛,浸蜡、包埋、切片,行HE染色,中性树胶封片,光学显微镜下观察、拍照。
1.2.7ELISA法
取部分心肌组织,匀浆,离心取上清液,严格按照ELISA试剂盒说明书操作。
1.2.8qRT-PCR法
取部分心肌组织,提取总RNA,逆转录为cDNA,进行RT-PCR反应,以β-actin为内参,2-ΔΔCT计算mRNA相对表达强度,引物序列见表1。

表1 RT-PCR引物序列
1.2.9Western blot法
取心肌组织,裂解,离心,取上清液,BCA法测定蛋白水平,上样、电泳、湿转、封闭后,各蛋白抗体(1∶500)4 ℃孵育过夜,二抗(1∶5 000)室温孵育2 h,ECL显影,Image J分析条带灰度值,目的蛋白条带灰度值/β-actin条带灰度值计算目的蛋白表达水平。
1.3 统计学处理
2 结 果
2.1 心功能指标
与模型组比较,激动剂组和血液透析组LVEDP升高,LVSP、+dp/dtmax、-dp/dtmax降低(P<0.05);与激动剂组比较,血液透析组LVEDP升高,LVSP、+dp/dtmax、-dp/dtmax降低(P<0.05),见表2。
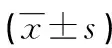
表2 各组LVEDP、LVSP、+dp/dtmax、-dp/dtmax比较
2.2 血清肌酐、尿素氮水平
与模型组比较,激动剂组和血液透析组肌酐、尿素氮水平降低(P<0.05);与激动剂组比较,血液透析组肌酐、尿素氮水平降低(P<0.05),见表3。
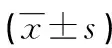
表3 各组肌酐、尿素氮水平比较
2.3 血清CK、CK-MB水平
与模型组比较,激动剂组和血液透析组CK、CK-MB水平降低(P<0.05);与激动剂组比较,血液透析组CK、CK-MB水平降低(P<0.05),见表4。

表4 各组CK、CK-MB水平比较
2.4 HE染色结果
模型组大鼠心肌细胞肥大,细胞核溶解、碎裂,心肌纤维排列紊乱,大量炎症细胞浸润;激动剂组和血液透析组大鼠肌纤维、肌外膜完整性及心肌细胞肥大、炎症细胞浸润均有所改善,见图1。

图1 各组大鼠心肌细胞形态变化比较(HE×400)
2.5 ELISA检测结果
与模型组比较,激动剂组和血液透析组IL-6、TNF-α、IL-1β水平降低(P<0.05);与激动剂组比较,血液透析组IL-6、TNF-α、IL-1β水平降低(P<0.05),见表5。
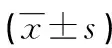
表5 各组IL-6、TNF-α、IL-1β水平比较
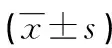
续表5 各组IL-6、TNF-α、IL-1β水平比较
2.6 PCR检测结果
与模型组比较,激动剂组和血液透析组TLR4、caspase-3 mRNA相对表达量降低(P<0.05);与激动剂组比较,血液透析组TLR4、caspase-3 mRNA相对表达量降低(P<0.05)。各组NF-κB p65 mRNA相对表达量组间比较,差异无统计学意义(P>0.05),见表6。
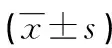
表6 各组TLR4、NF-κB p65、caspase-3 mRNA相对
2.7 Western blot法检测结果
与模型组比较,激动剂组和血液透析组TLR4、p-NF-κB p65、caspase-3 蛋白相对表达量及p-NF-κB p65/NF-κB p6降低(P<0.05);与激动剂组比较,血液透析组TLR4、p-NF-κB p65、caspase-3 蛋白相对表达量及p-NF-κB p65/NF-κB p6降低(P<0.05)。各组NF-κB p65 蛋白相对表达量组间比较,差异无统计学意义(P>0.05),见图2、表7。

图2 心肌组织TLR4、p-NF-κB p65、NF-κB p65、caspase-3 蛋白灰度值比较
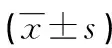
表7 各组TLR4、p-NF-κB p65、NF-κB p65、caspase-3蛋白相对表达量及p-NF-κB p65/NF-κB p65比较
3 讨 论
目前,肾衰患者心功能损伤具体机制尚不明确,其中,炎症为肾衰患者发生心血管疾病的独立危险因素[7]。血液透析属于血液净化技术的一种,可减轻炎性反应、氧化应激反应[8]。目前,国内尚无肾衰大鼠血液透析的相关报道。
章颖虹[9]研究认为血液透析与心功能指标、炎症状态有一定相关性。此外,血液透析还被证实能通过对心血管相关蛋白结合毒素进行清除,发挥保护心血管作用[10]。本研究结果显示,血液透析可促使大鼠LVEDP升高,LVSP、+dp/dtmax、-dp/dtmax、血肌酐、尿素氮、CK、CK-MB及心肌组织IL-6、TNF-α、IL-1β水平下降;病理学分析发现,血液透析可改善大鼠心肌纤维、肌外膜完整性,减轻心肌细胞肥大、炎性细胞浸润,这说明血液透析可保护肾衰大鼠心功能,减轻炎性反应,减少心肌损伤。
TLR4是一种信号转导受体蛋白,与免疫炎性反应密切相关,在巨噬细胞、内皮细胞、心肌细胞内广泛表达,可启动氧化应激、炎性反应[11]。TLR4激活后可通过髓样分子依赖途径,对下游NF-κB进行激活,介导下游炎症级联反应,导致IL-6、TNF-α、IL-1β等大量炎症因子分泌、释放,促进心肌细胞凋亡[12]。而心肌细胞凋亡在心功能损伤中也发挥重要作用,且由相关基因调控,其中caspase家族较常见[13]。本研究结果显示,血液透析可抑制TLR4、p-NF-κB p65、caspase-3 蛋白相对表达量并降低p-NF-κB p65/NF-κB p65,且经应用TLR4/NF-κB通路激动剂进一步验证,这提示血液透析可抑制TLR4/NF-κB信号通路,这可能是血液透析发挥大鼠心功能保护作用的机制之一。
综上所述,血液透析可减轻肾衰大鼠肾损伤及炎性反应,保护心功能,并可能通过抑制TLR4/NF-κB信号通路发挥作用。由于本研究涉及的样本量较少,今后仍需进一步扩大样本量,进行后续实验分析。

