线粒体ATP敏感性钾离子通道开放剂对大鼠冠状动脉硬化斑块及血脂代谢的影响*
彭颖静,刘丽敏,姚 健,张金盈
(沈阳医学院附属第二医院心血管内科 110016)
冠状动脉粥样硬化性心脏病是由于冠状动脉发生粥样硬化引起血管狭窄或闭塞,导致心肌缺血、缺氧、坏死的一种心脏病[1]。随着我国人口老龄化加剧及饮食结构的改变,冠状动脉粥样硬化性心脏病发病率逐年升高,已成为临床最为常见的心血管疾病之一[2]。
临床研究显示,冠状动脉粥样硬化性心脏病患者多伴有严重的血脂异常,故目前临床除采用血管扩张药物控制病情外,调节血脂也成为治疗重点[3]。线粒体ATP敏感性钾离子通道(mitochondrial ATP sensitive potassium channels,mitoKATP)主要分布于心肌和血管平滑肌细胞线粒体内膜上,mitoKATP开放是细胞内产生ATP的重要步骤[4]。二氮嗪属于mitoKATP开放剂,目前已被证实对缺血缺氧性心肌损伤及冠状动脉粥样硬化性心脏病有显著改善作用[5],但二氮嗪对冠状动脉粥样硬化性心脏病血脂代谢的影响及机制报道较少。本研究旨在探讨二氮嗪对冠状动脉粥样硬化性心脏病脂质代谢的影响及机制,为治疗提供参考。
1 材料与方法
1.1 实验动物
50只健康雄性SPF级SD大鼠,6周龄,体质量(200±20)g,购自北京维通利华实验动物技术有限公司[许可证号SCXK(京)2017-0011],动物实验符合3R原则,所有操作遵循国家实验动物管理条例及国家实验动物管理实施细则。
1.2 仪器与试剂
过氧化物酶体增殖物激活受体γ(peroxisome proliferator activated receptor γ,PPARγ)抑制剂GW9662(上海碧云天生物技术有限公司),维生素D3(VitD3,哈尔滨三马兽药业有限公司),高脂饲料、普通饲料(南通特洛菲饲料科技有限公司),肿瘤坏死因子-α(tumor necrosis factor - α,TNF-α)、白细胞介素-1β(interleukin-1 β,IL-1β)、基质金属蛋白酶9(matrix metalloproteinase 9,MMP9)ELISA试剂盒(南京福麦斯生物技术有限公司),逆转录试剂盒(日本TaKaRa公司),BCA蛋白定量分析试剂盒(美国Thermo公司),兔抗大鼠PPARγ、核因子-κB p65(nuclear factor-κB,NF-κB p65)及NF-κB p-p65单抗(一抗,美国Abcam公司),辣根过氧化物酶标记的山羊抗兔IgG单抗(二抗,北京中杉金桥生物技术有限公司)。7500实时荧光定量PCR仪(美国ABI公司),CheniDoc XRS化学发光成像分析系统(美国Bio-Rad公司),JEM-1010透射电子显微镜(日本电子株式会社)。
1.3 方法
1.3.1实验分组及干预
50只大鼠分为对照组、模型组、二氮嗪组、GW9662组、二氮嗪+GW9662组,各10只,除对照组外,其余各组采用高脂饲料喂养、腹腔注射VitD3法建立冠状动脉粥样硬化性心脏病大鼠模型,对照组采用普通饲料喂养、腹腔注射生理盐水。二氮嗪组以3 mg/kg二氮嗪灌胃,GW9662组以1 mg/kg GW9662灌胃,二氮嗪+GW9662组同时以3 mg/kg二氮嗪和1 mg/kg GW9662灌胃,对照组和模型组以生理盐水灌胃,每天1次,连续14 d。
1.3.2动物模型建立
参照文献[6]建立冠状动脉粥样硬化性心脏病大鼠模型:高脂饲料喂养12周,在喂养开始时腹腔注射VitD32 mL/kg,分3次连续3 d注射完毕。对照组仅喂养普通饲料,在喂养开始时腹腔注射生理盐水2 mL/kg,分3次连续3 d注射完毕。所有实验完毕后处死大鼠,病理检查显示有斑块形成证实建模成功,建模未成功的大鼠数据全部剔除。模型组、二氮嗪组、GW9662组、二氮嗪+GW9662组分别有10、9、8、9只大鼠建模成功。
1.3.3标本采集
给药结束后2 h,用眼球摘除法取血样5 mL,室温静置分层后,3 000 r/min离心15 min(离心半径10 cm),取上清液备用;采血结束后处死各组大鼠,打开胸腔,剪取3 cm胸主动脉标本,一部分(4只大鼠)置于10%中性甲醛中常温固定48 h用于染色用,一部分(4只大鼠)置于2.5%戊二醛中4 ℃固定2 h用于线粒体超微结构观察,每组另4只标本置于-80 ℃保存用于mRNA和蛋白表达的检测。
1.3.4血脂指标及血清炎症因子水平检测
取血清样本,于全自动生化分析仪检测总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)水平;参照ELISA试剂盒说明书,检测炎症因子IL-1β、TNF-α、MMP9水平。
1.3.5主动脉弓血管壁脂质沉淀检测
取固定于中性甲醛中的4只大鼠主动脉组织标本,乙醇梯度脱水,石蜡包埋,制作厚度为4 μm连续切片。每个标本取4张切片,60%异丙醇浸洗,加入油红O染色液,室温染色10 min,置于显微镜下用60%异丙醇调色,蒸馏水冲洗3次,Mayer苏木精染液复染30 s,自来水冲洗3 min,蒸馏水浸洗,晾干后用甘油明胶封片,于光学显微镜下观察拍照。
1.3.6主动脉弓血管内皮细胞线粒体超微结构观察
取4只大鼠以2.5%戊二醛固定的主动脉组织标本,PBS冲洗干净后,用1%锇酸室温固定2 h,再次冲洗,用2%醋酸铀染色2 h,然后进行丙酮逐级脱水,包埋剂包埋后于超薄切片机上切片,醋酸铀和枸橼酸钠染色,于透射电子显微镜下观察。
1.3.7PPARγ、NF-κB mRNA表达量检测
取4只大鼠在-80 ℃保存的主动脉组织,用组织剪剪碎后,以Trizol法提取总RNA,逆转录试剂盒获得互补链cDNA,调整cDNA浓度,以之为模板进行实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RT-qPCR),参照试剂盒设置20 μL反应体系20,反应参数为95 ℃预变性5 min;94 ℃变性20 s,58 ℃退火40 s,40个循环,72 ℃再延伸60 s。以β-actin为内参对照,以2-ΔΔCT计算目的基因相对表达量。PPARγ引物序列F:5′-TGCTAGCCAATGTGCTAGC-3′,R:5′-CCAGTACGTAGCTGATGCA-3′;NF-κB引物序列F:5′-TACGACTGCGATGCTGCT-3′,R:5′-AATGCTGATGCTGATCAT-3′;β-actin引物序列F:5′-ACTGATGCTGAACGTGAC-3′,R:5′-CCTGATGCTGATGCTGAG-3′。
1.3.8PPARγ、NF-κB p65、NF-κB p-p65蛋白表达量检测
取4只大鼠在-80 ℃保存的主动脉组织,液氮研磨后加入细胞裂解液,于冰上孵育20 min,离心收集上清液,检测上清液中总蛋白含量,然后进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳,经电转、封闭后,加入稀释一抗(1∶500),4 ℃摇床孵育过夜,TBST缓冲液洗涤3次×10 min,加入稀释二抗(1∶2 000),常温孵育2 h,加入电化学发光液,暗室中曝光、显影,凝胶成像系统扫描拍照,用Image J图像分析软件进行灰度值分析,蛋白相对表达量以PPARγ、NF-κB p65、NF-κB p-p65与内参β-actin灰度值比值表示。
1.4 统计学处理

2 结 果
2.1 各组血脂指标检测结果
与对照组比较,模型组、GW9662组、二氮嗪组、二氮嗪+GW9662组TC、TG、LDL-C水平均较高,其中GW9662组>模型组>二氮嗪+GW9662组>二氮嗪组,差异均有统计学意义(P<0.05),见表1。
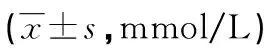
表1 各组血脂指标比较
2.2 各组血清炎症因子水平检测结果
与对照组比较,模型组、GW9662组、二氮嗪组、二氮嗪+GW9662组血清IL-1β、TNF-α、MMP9水平均较高,其中GW9662组>模型组>二氮嗪+GW9662组>二氮嗪组,差异均有统计学意义(P<0.05),见表2。
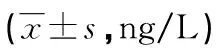
表2 各组血清炎症因子水平比较
2.3 主动脉弓血管壁脂质沉淀检测结果
主动脉弓油红O染色显示,对照组无脂质沉淀,模型组大量成片脂滴沉淀,GW9662组较模型组脂滴沉淀更多,二氮嗪组较模型组脂滴沉淀减少,而二氮嗪+GW9662组较二氮嗪组脂滴沉淀增多,见图1。
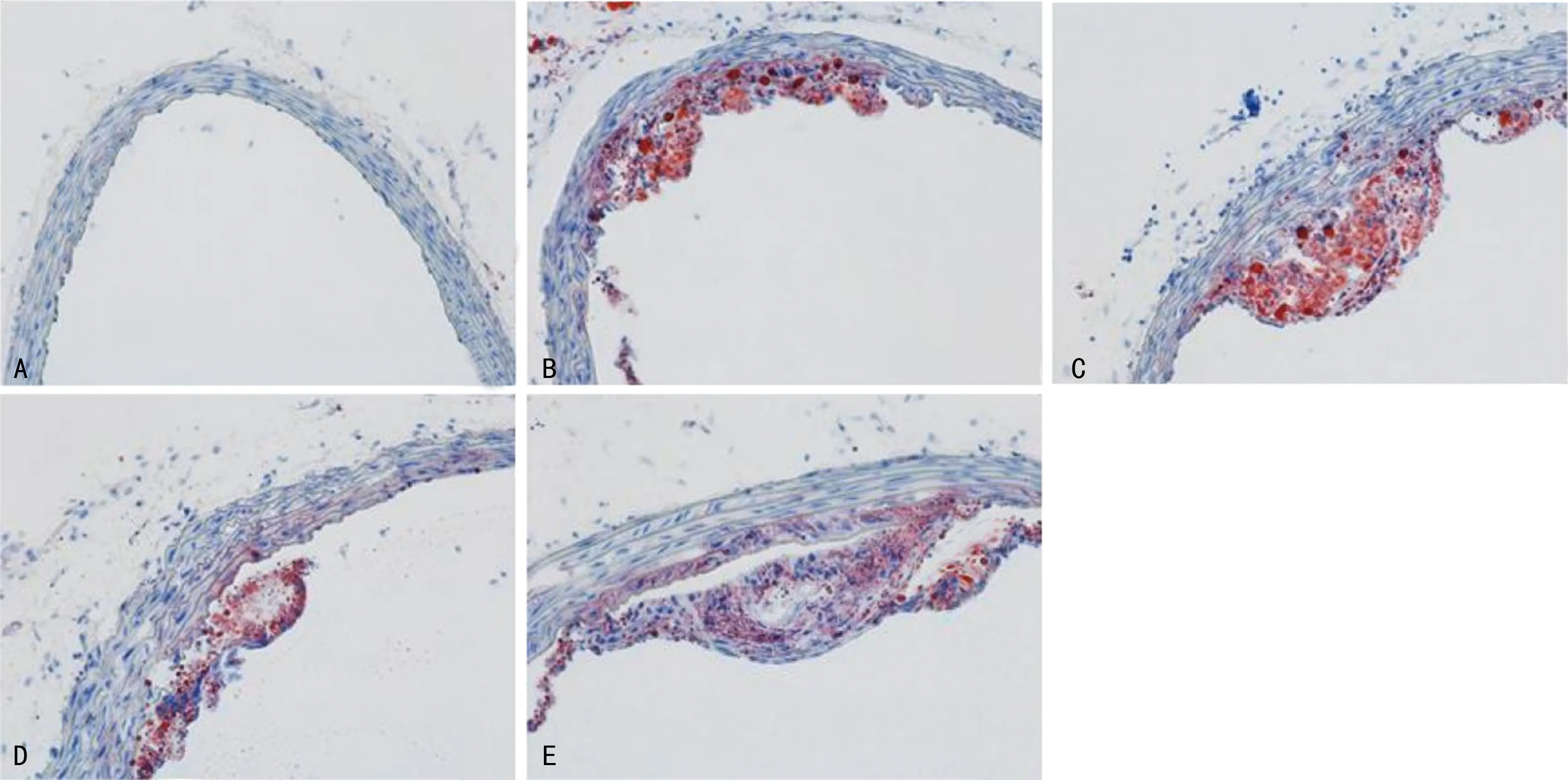
A:对照组;B:模型组;C:GW9662组;D:二氮嗪组;E:二氮嗪+GW9662组。
2.4 各组主动脉弓线粒体超微结构改变
主动脉弓透射电子显微镜观察显示,对照组主动脉弓内皮细胞线粒体双层膜结构清晰、完整;模型组线粒体双层膜结构不连续,线粒体嵴断裂或模糊,呈现肿胀和空泡化现象;GW9662组较模型组线粒体嵴断裂明显,部分仅留残端,肿胀和空泡化严重;二氮嗪组较模型组双层膜结构相对完整,线粒体嵴清晰,肿胀和空泡化减轻;而二氮嗪+GW9662组较二氮嗪组嵴稍模糊,肿胀和空泡化稍加重,见图2。
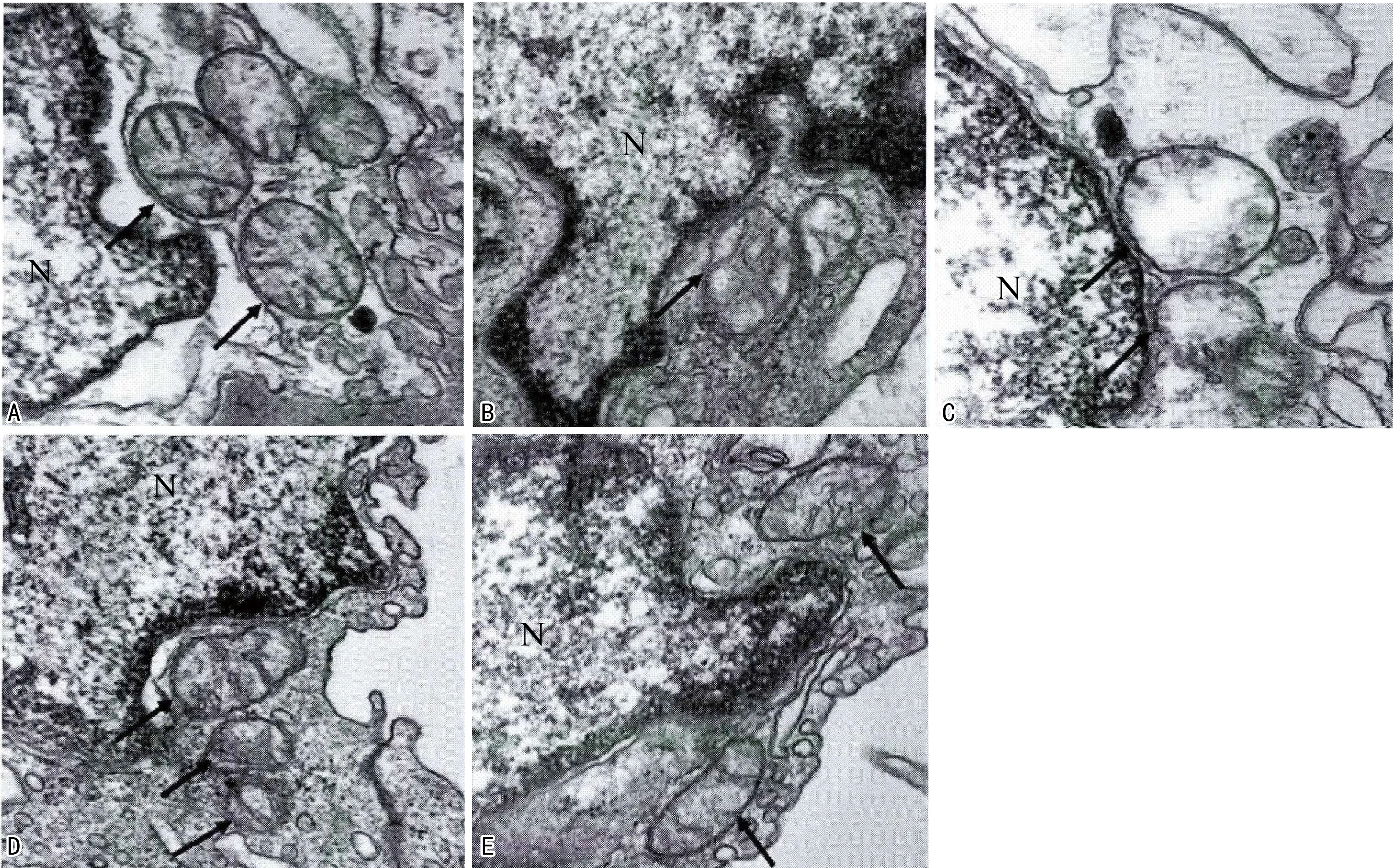
A:对照组;B:模型组;C:GW9662组;D:二氮嗪组;E:二氮嗪+GW9662组;N:细胞核;箭头:线粒体。
2.5 各组主动脉PPARγ、NF-κB mRNA相对表达量检测结果
NF-κB p65 mRNA相对表达量组间比较,差异无统计学意义(P>0.05)。与对照组比较,模型组、GW9662组、二氮嗪组、二氮嗪+GW9662组PPARγ mRNA相对表达量降低,其中GW9662组<模型组<二氮嗪+GW9662组<二氮嗪组,差异均有统计学意义(P<0.05),见表3。
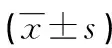
表3 各组主动脉PPARγ、NF-κB mRNA相对表达量比较
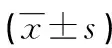
续表3 各组主动脉PPARγ、NF-κB mRNA相对表达量比较
2.6 各组主动脉PPARγ、NF-κB p65、NF-κB p-p65蛋白相对表达量检测结果
NF-κB p65蛋白相对表达量组间比较,差异无统计学意义(P>0.05)。与对照组比较,模型组、GW9662组、二氮嗪组、二氮嗪+GW9662组PPARγ蛋白相对表达量降低,其中GW9662组<模型组<二氮嗪+GW9662组<二氮嗪组,差异均有统计学意义(P<0.05);与对照组比较,模型组、GW9662组、二氮嗪组、二氮嗪+GW9662组NF-κB p-p65蛋白相对表达量升高,其中GW9662组>模型组>二氮嗪+GW9662组>二氮嗪组,差异均有统计学意义(P<0.05),见图3。
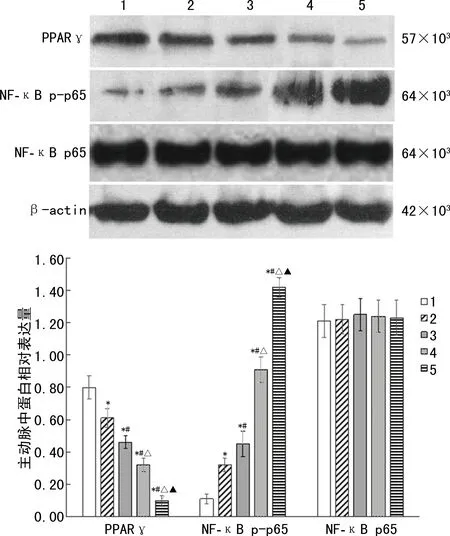
1:对照组;2:二氮嗪组;3:二氮嗪+GW9662组;4:模型组;5:GW9662组;*:P<0.05,与对照组比较;#:P<0.05,与模型组比较;△:P<0.05,与GW9662组比较;▲:P<0.05,与二氮嗪组比较。
3 讨 论
冠状动脉粥样硬化性心脏病是临床最常见的心血管疾病之一,严重危害人类的生命健康。冠状动脉粥样硬化性心脏病的病理基础为动脉粥样硬化,其发病危险因素较多,如高龄、吸烟、血脂代谢异常、炎症、遗传等[7-8]。研究表明,血脂代谢异常是诱发冠状动脉粥样硬化性心脏病的危险因素,血脂代谢长期异常可破坏冠状动脉血管完整性,引起血小板和血脂长期聚集于血管破损处,形成动脉粥样硬化斑块,最终导致血管狭窄甚至闭塞,心血管事件发生风险增加[9-10]。mitoKATP存在于心肌和血管平滑肌细胞线粒体内膜,是线粒体损伤、细胞死亡的关键,开放mitoKATP可激活内源性心肌保护机制[11],但其对血脂代谢的影响的研究较少。
临床研究显示,高甘油三酯血症是冠状动脉粥样硬化性心脏病发病的独立危险因素,TC、TG、LDL-C长期处于高水平可促进粥样硬化斑块形成,加之炎症因子作用可加速易损性斑块形成,从而导致心血管事件发生风险增加[12-13]。炎性反应参与冠状动脉粥样硬化性心脏病的发生、发展的各个环节,IL-1β、TNF-α可加速血栓及动脉斑块形成等病理改变,胆固醇结晶可激活炎症小体,促进IL-1β的合成和分泌;TNF-α促进黏附分子释放诱发斑块形成;MMP9选择性地结合细胞外基质,加速易损性斑块形成[14-15]。本研究发现,模型组血脂指标TC、TG、LDL-C水平及血清炎症因子IL-1β、TNF-α、MMP9水平较对照组升高,主动脉弓大量成片脂滴沉淀、主动脉内皮细胞线粒体损伤严重,应用二氮嗪干预后,血脂指标及血清炎症因子水平较模型组均降低,脂滴沉淀减少,内皮细胞线粒体损伤减轻,提示二氮嗪可有效减轻大鼠冠状动脉硬化斑块病变程度,改善血脂代谢,抑制炎性反应。
PPARγ主要参与脂肪细胞分化、葡萄糖代谢及炎性反应等,PPARγ信号通路在脂质代谢中发挥重要调控作用,已成为肥胖及糖尿病等糖脂代谢紊乱疾病治疗的重要靶分子之一[16]。PPARγ、NF-κB p65均属于核受体,适量脂质可激活PPARγ稳定脂质代谢,过多的脂质则抑制PPARγ,从而使NF-κB p65磷酸化激活,促进炎性反应[17]。本研究发现,模型组PPARγ mRNA和蛋白表达量较对照组降低,NF-κB p65 mRNA和磷酸化蛋白表达量升高;应用二氮嗪干预后,主动脉PPARγ mRNA和蛋白表达量升高,NF-κB p65 mRNA和磷酸化蛋白表达量降低,提示二氮嗪可上调冠状动脉粥样硬化性心脏病大鼠主动脉中PPARγ表达,抑制NF-κB p65磷酸化水平,从而抑制血管内皮损伤和动脉粥样硬化斑块形成。本研究在二氮嗪基础上进一步应用PPARγ抑制剂GW9662干预后,PPARγ mRNA和蛋白表达量较二氮嗪组降低,NF-κB p65 mRNA和磷酸化蛋白表达量升高,且血脂指标、线粒体损伤程度及血清炎症因子水平均有所改善,从而证实二氮嗪是通过上调PPARγ、抑制NF-κB p65磷酸化调控冠状动脉粥样硬化性心脏病大鼠血脂代谢。除PPARγ外,PPAR还包括PPARα和PPARβ/δ亚型,二氮嗪除通过PPARγ抑制动脉粥样硬化斑块及改善血脂代谢外,能否通过其他亚型发挥代偿作用,仍需进一步研究。
综上所述,线粒体ATP敏感性钾离子通道开放剂二氮嗪可有效减轻大鼠冠状动脉硬化斑块病变程度,改善血脂代谢,其机制为通过调控PPARγ通路发挥作用,为临床冠状动脉粥样硬化性心脏病的防治提供理论参考,但具体机制仍需进一步探讨。

