快速消除过氧化氢对COD测定影响的方法
龚东平,刘含雷,倪志伟,于 佳,李善振
(1.博瑞德环境集团股份有限公司,江苏 南京 210048;2.伊恩艺科(山东)环境科技有限公司,山东 济宁 272000)
Fenton法是在酸性条件下,利用过氧化氢与亚铁离子反应生成羟自由基并氧化大部分有机物的原理,该方法被广泛应用于各种难降解化工废水的处理中[1]。Fenton反应通常调节废水的pH值为9~10,使亚铁离子转化为氢氧化铁沉淀,并终止反应。但是残留的过氧化氢相对于K2Cr2O7、KMnO4等强化剂时,表现出还原性,影响废水化学需氧量(COD)的测定。过氧化氢在强酸性溶液中会被K2Cr2O7氧化,反应方程式如下:
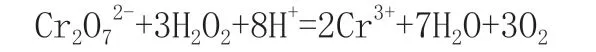
因此,在用重铬酸盐法测定含有过氧化氢的废水COD时,需排除H2O2的干扰,避免测定的COD值偏高,影响对废水有机物实际含量的判断。
1 H2O2对测定COD的影响
1.1 H2O2含量的测定
参照GB/T-1616-2014,用KMnO4测定了商标浓度为30%的双氧水,有效浓度为27%。
1.2 不同浓度H2O2测定的COD值
取质量分数为2 7%的双氧水,用去离子水配制成0~2 000 mg/L的H2O2梯度溶液,按照HJ828-2017标准(重铬酸盐法)测定COD的方法,测定不同浓度H2O2溶液对应的COD值,结果见表1。
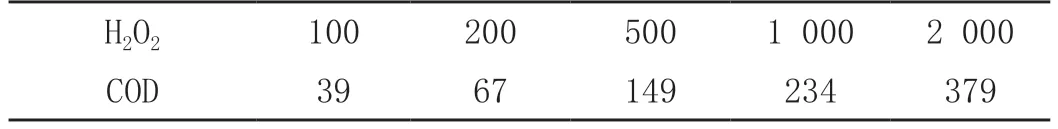
表1 不同浓度H2O2溶液COD值 单位:mg/L
将H2O2浓度与对应测定的COD进行线性拟合,结果如图1所示。线性回归方程:Y=0.176X+39.69,R=0.98,说明COD值与H2O2的浓度是线性正相关。
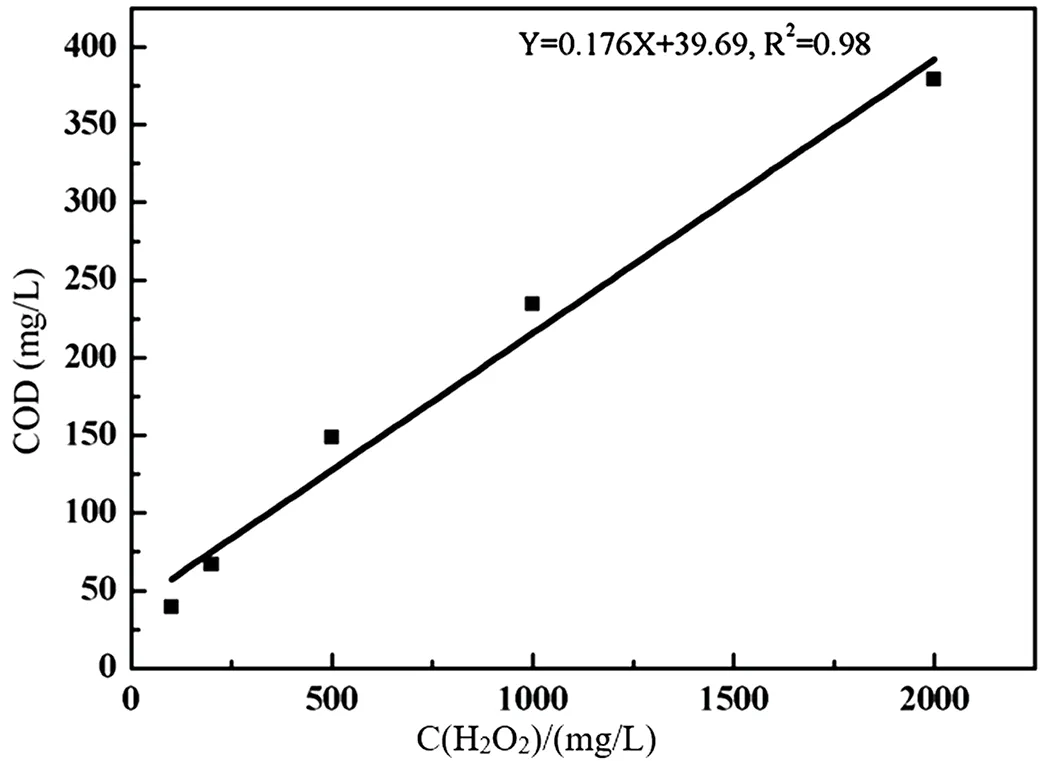
图1 不同H2O2浓度与对应COD的线性关系
1.3 H2O2对邻苯二甲酸氢钾溶液COD测定的影响
采用标准物质邻苯二甲酸氢钾和双氧水,配制理论COD=100 mg/L的溶液,其中混有不同含量的H2O2。按照测定COD的方法,测定H2O2对邻苯二甲酸氢钾COD的影响,结果见表2。

表2 不同浓度的H2O2对测定邻苯二甲酸氢钾COD的影响 单位:mg/L
将不同浓度的H2O2与对应测定的邻苯二甲酸氢钾COD进行线性拟合,结果如图2所示。

图2 不同浓度的H2O2与对应的邻苯二甲酸氢钾COD的线性关系
线性回归方程为:Y=0.266X+115.2,R=0.98。线性较好,说明H2O2含量对测定邻苯二甲酸氢钾溶液COD的影响是线性相关的。H2O2含量越高,其对溶液COD测定的干扰越大。结合表1和表2可知,邻苯二甲酸氢钾和H2O2混合溶液的COD值比两者COD值的和略微偏大,可见H2O2并不能氧化分解邻苯二甲酸氢钾,也说明了混有H2O2的废水,其COD值不能依靠上述线性方程,而是通过计算扣除H2O2的COD贡献值获得。
2 消除H2O2干扰COD测定的方法
据相关文献报道[2],通过测定废水中H2O2的含量,再根据H2O2浓度与其COD的线性方程,扣除H2O2的COD贡献值,可测定废水的COD。此方法除了前文提到的局限性外,还因为水体中可能存在有其他还原性物质,在基于KMnO4氧化滴定法测定复杂水样中H2O2的含量时,结果可能会偏高。
另据相关文献报道[3-4],可利用Na2S2O3、Na2SO3等还原性物质与H2O2发生氧化还原反应,消除H2O2对COD测定的影响。此方法的局限性在于:(1)KM nO4氧化滴定法测定复杂废水的H2O2含量存在干扰误差;(2)投加的Na2S2O3、Na2SO3过量或者反应不完全,导致最终采用重铬酸钾法测定的COD值仍然偏高。
综上所述,根据H2O2浓度采用理论计算或者药剂屏蔽的方法均有局限性。本文尝试根据H2O2呈弱酸性和高温分解的特性,采用非氧化还原法去除H2O2对COD测定的干扰。
2.1 加碱对低浓度H2O2分解的影响
采用NaOH调节低浓度H2O2溶液的pH值,观察H2O2的分解情况,结果如表3所示。

表3 不同pH值以及加热对H2O2分解的影响
取H2O2浓度为1 986 mg/L的水溶液,pH=4.70,采用NaOH调节pH=8.53时,室温下H2O2浓度没有发生变化。当pH值升至10.82后,才出现轻微的中和分解(约10%),说明H2O2酸性极弱,该浓度下几乎不与NaOH发生中和分解。
2.2 加碱和加热对低浓度H2O2分解的影响
采用NaOH调节低浓度H2O2溶液的pH值后,水浴(80 ℃)加热1 h,观察H2O2的分解情况,结果如表4所示。

表4 不同pH值及加热对H2O2分解的影响
从表4可知,低浓度的H2O2水溶液只依靠加热(80 ℃),其分解速度偏慢。调至碱性条件下,辅以水浴(80 ℃)加热1 h,发现在pH=4.70~8.53,分解不明显。当pH值升至10.82以后,H2O2分解达90%以上,说明其分解需要相对较高的pH值。由此看出,在不引入氧化还原剂的前提下,分解低浓度H2O2的有效方法是:水样用碱液调至pH大于12,并辅以水浴(80 ℃)加热。
2.3 采用标准溶液验证加碱和加热消除H2O2干扰的效果
采用标准物质邻苯二甲酸氢钾和双氧水,配制理论值COD=100 mg/L,并混有H2O2的梯度混合溶液。采用固体NaOH调节pH>12后,于80 ℃加热1 h(带冷凝管)。冷却后,测定混合溶液的COD,结果如表5所示。

表5 加碱和加热消除COD标准溶液中H2O2干扰的效果
从表5可以看出,加碱&加热都可以有效地去除水样中低浓度的H2O2,随后测定的邻苯二甲酸氢钾-H2O2体系中COD的相对偏差为0~5%,与标液的COD真实值及测定值十分接近,故采用加碱&加热的方法消除H2O2干扰测定水样COD具有可行性。
2.4 以废水验证加碱&加热消除H2O2干扰的效果
采用三股不同类型的化工废水,测定COD后,稀释至COD=100 mg/L,其中添加H2O2浓度至500 mg/L。采用固体NaOH调节pH>12后,于80 ℃加热1 h(带冷凝管)。冷凝后,测定混合溶液的COD,结果如表6所示。
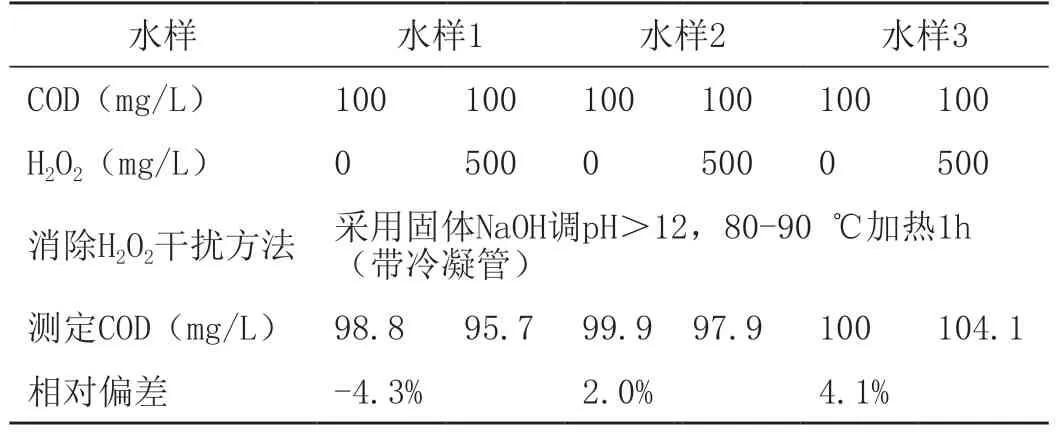
表6 加碱和加热消除化工废水中H2O2干扰的效果
前文测定500 mg/L的H2O2对应的COD值为269.65 mg/L,从表6中可以看出,加碱&加热可以有效去除化工废水中的H2O2,并消灭其对废水COD测定值的影响。测定三股废水-H2O2体系中COD值的相对偏差为-4.3~4.1%,误差在可接收范围内。在试验中,将废水COD稀释至较低浓度,并配制冷凝管,消除了加热过程中低沸点有机物的挥发性损失。
3 结论
综上所述,在测定COD过程中,水样中H2O2会消耗K2Cr2O7,导致所测COD偏高。单一H2O2溶液中,其COD值与H2O2浓度呈线性相关,在H2O2浓度为0~2 000 mg/L内满足线性方程:Y=0.176X+39.69,R2=0.98。H2O2呈弱酸性,低浓度下几乎不与强碱反应,且热分解缓慢(80 ℃)。采用固体NaOH调至pH>12后,辅以80 ℃水浴加热,可以将2 000 mg/L的H2O2分解99%。采用此法,并配置冷凝管,验证测得邻苯二甲酸氢钾-H2O2体系中COD的相对偏差为0~5%,测得3股化工废水-H2O2体系中COD值的相对偏差为-4.3~4.1%,故此法在消除H2O2影响、测定低浓度废水COD具有可行性。

