基于牡蛎壳的复合材料制备及其离子吸附特性研究
赵强,刘俊财,杜雨桐,江晓,孙建安*,毛相朝
(1.中国海洋大学食品科学与工程学院,山东 青岛 266003;2.青岛滨海学院医学院,山东 青岛 266555)
据统计2019年中国牡蛎(Ostreagigasthunberg)产量达453.93万t[1],牡蛎壳(Oyster shell,OS)是牡蛎加工及食用过程的主要副产物,其占个体总重量60%以上[2],碳酸钙含量超过90%[3]。目前牡蛎壳利用主要集中于作为农业肥料[4-5]、钙补充剂[6-7]或作为吸附剂使用[8]。
水产品中离子含量超标会严重影响其食用安全性,参照GB/T 14848—2017《地下水质量标准》,具体离子包括镉、铬、砷、汞、氟及亚硝酸根等。如何降低这些离子的含量是亟待解决的问题之一,而水产品生长环境的水质是影响其离子含量的重要因素。水中的离子污染物可通过水产品等食物富集于人体,给人类健康带来隐患。目前已报道的水处理方法有化学沉淀法[9]、离子交换法[10]、膜分离法[11-12]、电渗析法[13]及吸附法[14]等,相比其他水处理方法,吸附法具有操作简便,价格低廉及环境友好等优势,是水处理方法的重要研究方向。
利用生产废料制备吸附剂已有大量报道[15],包括稻壳[16]、香蕉皮[17]以及板栗壳[18]等。目前国内外已有直接或间接利用OS处理水资源的报道,如利用OS吸附Pb2+[19]、F-[20],利用焙烧牡蛎壳吸附水中Cd2+[21]以及各种染料[22-24],也有将OS与淀粉[25]、硅藻土[26]混合煅烧复合物来净化水质,但普遍存在吸附容量小、吸附效果有待提升等问题。制备羟基磷灰石(Hydroxyapatite,HAP)并应用于水处理是牡蛎壳高值化利用的重要途径,HAP对水中阴阳离子污染物都有一定吸附性能[27-28]。材料的复合相比单一材料可以提高材料对目标离子的吸附容量,有报道将HAP[29]、MgO[30]、Ti[31]与壳聚糖(Chitosan,CS)复合脱除F-,发现复合后材料比单一材料对F-吸附容量更高,一部分是因为CS溶于酸性溶液形成带正电的阳离子基团,其在溶液中为带正电荷的多聚电解质,具有很强的吸附性,同时其支链上大量的羟基对阴离子也有一定的吸附能力。羧甲基壳聚糖(Carboxymethyl chitosan,CMCS)是将CS的基团进行羧甲基化修饰所得到的衍生物,分子中含有羟基、氨基、羧基等活性基团,可通过氢键、离子交换、范德华力对金属离子产生吸附以及配位作用[32],已有研究利用CMCS微球吸附Mn2+[33]、Co2+[34],或将CMCS与明胶[35]以及蒙脱土[36]复合处理水资源,但尚未见使用CMCS与牡蛎壳来源的HAP制备复合吸附材料的报道。
针对OS、HAP、CS及CMCS复合材料研究较多,但具体针对吸附离子带电性合成特定材料并进行系统比较与评价的研究报道较少。利用OS制备HAP及相关复合材料并应用于水处理净化不仅可以提高牡蛎资源整体高值化利用率,对于提升食品安全与推动环境保护也具有重要意义。本研究选取镉离子(Cd2+)与氟离子(F-)作为水中的正负离子污染物代表,以OS为原料制备HAP并分别与CS、CMCS进行复合,系统比较各材料对相应离子的吸附能力,同时对各材料进行表征以及吸附规律探究,以期为污染治理及海洋生物资源再利用两方面提供探索依据。
1 材料与方法
1.1 材料与仪器
近江牡蛎壳,青岛市市南区团岛海鲜市场购买;壳聚糖(300 kDa,脱乙酰度>95%),上海麦克林生化科技有限公司;羧甲基壳聚糖(取代度>90%,等电点3~4),上海麦克林生化科技有限公司;罗丹明B,上海麦克林生化科技有限公司;聚乙烯醇,上海麦克林生化科技有限公司;硫脲,上海麦克林生化科技有限公司;维生素C,国药集团化学试剂有限公司;实验用水为去离子水,除说明外其他试剂均为国产分析纯。
磁力搅拌器(CJB),河南爱博特科技发展有限公司;可见光分光光度计(UV-5200),上海元析仪器有限公司;氟离子电极(PF-2-01),上海仪电科学仪器股份有限公司;pH计 (PHS-3C),上海精科仪器有限公司;傅里叶变换红外光谱仪(Nicolet iS5),赛默飞世尔科技公司;X射线衍射仪(D8 Advance),德国布鲁克公司;场发射扫描电子显微镜(HFsafe1200LC-A2),利康生物医疗科技有限公司。
1.2 实验方法
1.2.1 材料制备方法
1.2.1.1 牡蛎壳来源的羟基磷灰石(HAP)的制备
取1.1 g牡蛎壳用20 mL 浓度为1 mol/L硝酸溶液酸解得到硝酸钙溶液并与一定量NH4H2PO4溶液混合搅拌1 h,利用NaOH溶液调节pH至10~11,陈化24 h后过滤,70 ℃烘干即可得到HAP材料。
1.2.1.2 壳聚糖-羟基磷灰石复合材料(CHAP)的制备
采用共沉淀法[37-38]制备CHAP材料,称取1.1 g OS用20 mL浓度1 mol/L硝酸溶解过滤为Ca(NO3)2溶液,同时将CS溶解于冰醋酸中得到质量分数为2% CS溶液,称取1.1 g NH4H2PO4溶于10 mL 去离子水中,将CS溶液与NH4H2PO4溶液混合搅拌1 h后加入Ca(NO3)2溶液继续搅拌1 h,用NaOH溶液调节pH至10~11,继续搅拌1 h,陈化24 h 后离心烘干并研磨为粉末即为CHAP材料。
1.2.1.3 羧甲基壳聚糖-羟基磷灰石复合材料(CMCS-HAP)的制备
采用交联法制备CMCS-HAP材料,取1.1 g牡蛎壳酸解得到的硝酸钙溶液与NH4H2PO4反应,利用NaOH溶液调节pH至10~11得到HAP;取1 g制备好的 HAP置于50 mL去离子水中搅拌分散,加入12 mL 质量分数为5%的CMCS溶液继续搅拌至胶体状,边搅拌边加入质量分数为0.5%戊二醛(GA)溶液进行交联,同时加入0.7 g NaCl以调节渗透压提高交联效率,搅拌1 h并放置24 h后再离心冻干并研磨即得CMCS-HAP材料。
1.2.2 单因素实验
1.2.2.1 CHAP脱氟单因素优化实验
选择材料制备过程中钙磷比(1∶1.30、1∶1.50、1∶1.67、1∶1.90及1∶2.10)、壳聚糖占比(10%、20%、30%、40%及50%)和陈化时间(0 h、12 h、24 h、36 h及48 h)以及吸附过程中吸附时间(1 h、2 h、3 h、4 h及5 h)进行优化,测定吸附前后的氟离子含量,以材料吸附容量为优化指标,每组设3个平行。
1.2.2.2 CMCS-HAP脱镉优化实验
选择制备过程中的钙磷比(1∶1.30、1∶1.50、1∶1.67、1∶1.90及1∶2.10)、羧甲基壳聚糖占比(10%、20%、30%、40%及50%)、陈化时间(0 h、12 h、24 h、36 h及48 h)和戊二醛添加量(600∶1、500∶1、400∶1、300∶1、200∶1以及100∶1)以及吸附过程中的吸附时间(1 h、2 h、3 h、4 h及5 h)5个因素进行优化,测定吸附前后样品中的镉离子含量,以材料对镉离子吸附容量作为优化指标,每组设3个平行。
1.2.3 材料的表征
通过 Nicolet iS5傅里叶变换红外光谱仪表征各材料分子结构,扫描范围 4 000~500 cm-1;通过D8 Advance X射线衍射仪进行结晶结构测试,扫描速度2°/min,扫描范围10~70°,电压40 kV,电流40 mA;通过JEM-1200EX扫描电子显微镜观察材料表面微观形貌。
1.2.4 吸附动力学研究
为了探究复合材料对离子的吸附动力学机理,采用准一级和准二级动力学模型,对所获得的实验数据进行分析拟合,准一级和准二级动力学方程如式(1)、(2)所示[39];
式(1)
式(2)
式中,Qt为t时间内的吸附量,mg/g;Qe为平衡时的吸附量,mg/g;t为吸附所用时间,min;k1为一级动力学速率常数;k2为二级动力学速率常数。
1.2.5 等温吸附曲线
采用Langmuir和Freundlich两种等温吸附模型来探究材料对离子的等温吸附,更进一步的解释材料对离子的吸附机理,线性表达方程式分别如式(3)、(4)所示[40];
式(3)
式(4)
式中,Qe和Qmax(mg/g)分别代表吸附平衡和最大吸附容量;KL(L/mg)和KF(mg/g)分别是Langmuir和Freundlich等温吸附模型的经验常数,Ce(mg/L)是吸附平衡的离子浓度,n是Freundlich等温吸附模型的经验常数。
1.2.6 氟离子及镉离子含量测定
1.2.6.1 氟离子含量测定
参照GB/T 7484—1987并稍加修改,分别配置浓度为0.02 mg/L、0.06 mg/L、1.00 mg/L、2.00 mg/L及4.00 mg/L的氟离子溶液,利用氟离子电极及参比电极测定各浓度对应电位值,用氟离子浓度对数与电位值做标准曲线得y=-57.089x+238.597 5(R2=0.999 7);样品氟离子浓度即样品电位值代入标准曲线后计算所得。
1.2.6.2 镉离子含量测定
参考鲁秀国等[41]方法,取5 mL样品溶液于25 mL比色皿中,加入2 mL 1 mol/L硫酸溶液以及2 mL掩蔽剂溶液、3 mL碘化钾-抗坏血酸溶液,旋涡振荡并静置1 min。继续加入5 mL聚乙烯醇溶液,混匀后加入1.5 mL罗丹明B染液旋涡振荡并静置10 min;以试剂空白作为参比,于588 nm下测定吸光值,根据标准曲线计算对应离子浓度。
1.2.7 吸附容量的计算
量取50 mL不同浓度的离子溶液,加入0.05 g·吸附材料,置于磁力搅拌器上以400 rpm/min转速搅拌吸附相应时间后进行过滤;需要测定指标为吸附前后离子浓度,吸附容量按照公式(5)计算。
式(5)
式中,Q为吸附容量,mg/g;C0和Ct分别为吸附前后离子浓度,mg/L;V为溶液体积,L;m为添加吸附材料的质量,g。
1.3 数据处理
采用Excel 2019处理数据,采用Origin 2018作图。采用SPSS 18.0软件进行单因素试验设计和统计学显著性分析(ANOVA)。
2 结果与分析
2.1 单因素实验
2.1.1 CHAP材料对F-吸附容量单因素实验
不同结构、组成及形貌的HAP适用于不同的领域,这些差异主要来源于HAP的制备工艺,当利用HAP与CS组成复合材料后,其结晶度会发生变化,这与表征实验结果相符。图1为CHAP材料对F-的吸附性能单因素优化,合适的钙磷比有利于引入碳酸根及提高比表面积,当钙磷比为1∶1.67时,CHAP材料的F-吸附容量显著高于其他水平(P<0.05),为47.64 mg/g;壳聚糖的活性吸附中心是表面自由氨基,可以吸附阴离子甚至两性化合物,同时支链上有大量的羟基,羟基对F-有一定的吸附作用[31, 42],CS的添加量影响材料的比表面积,陈化时间影响HAP的晶形生长,当CS占比为40%时,材料吸附容量达到最大;陈化时间超过24 h时,各水平之间无显著性差异(P>0.05),F-吸附容量可达52.86 mg/g;吸附时间也会影响吸附效果,从图中可以看出吸附时间2 h 时材料吸附量接近饱和,5 h时材料吸附容量有所降低,原因在于离子与材料结合不稳定,在搅拌的过程中会摆脱两者之间的相互作用,因此吸附容量大小会有相应变化。单因素结果表明,CHAP吸附F-最佳条件为:钙磷比1∶1.67,CS占比40%,陈化时间24 h 以及吸附时间2 h,此条件下得到的CHAP材料对F-的吸附容量可以达到53.67 mg/g。

图1 CHAP吸附F-单因素优化实验Fig.1 Single factor optimization experiment of F-adsorption by CHAP
2.1.2 CMCS-HAP材料对Cd2+的吸附容量单因素实验
CMCS在CS高分子链上引入亲水基团-CH2COOH,比CS的水溶性有极大提高,同时具有优良的螯合金属离子作用[34]。图2为CMCS-HAP材料对Cd2+的吸附性能单因素优化,从图中可以看出钙磷比达到1∶1.9时CMCS-HAP材料的Cd2+吸附容量显著高于1∶1.67水平(P<0.05),CMCS分子链上的羧基与氨基能与金属阳离子进行配位结合, CMCS占比为40%时,材料吸附容量显著高于其他水平(P<0.05);在陈化时间为0~24 h时,材料吸附容量随着时间的增加而增加,超过24 h后吸附容量无显著差异(P>0.05), Cd2+吸附容量可以达到18.58 mg/g;GA作为交联剂在制备材料过程起到关键作用,GA的醛基与CMCS的氨基进行结合最终形成Schiff碱从而将CMCS分子交联起来形成稳定的结构[43],适度交联利于材料的形成以及基团与Cd2+的结合,优化得到CMCS与GA质量比为500∶1;最后优化得到吸附3 h时材料对Cd2+的吸附容量达到最大。单因素优化得到CMCS-HAP对Cd2+吸附量最大的条件为钙磷比为1∶1.9,CS占比为40%,陈化时间为24 h,mCMCS∶mGA=500∶1以及吸附时间3 h,此时Cd2+的吸附容量可达18.41 mg/g。
为进一步衡量不同材料的吸附性能,对各材料进行了吸附容量测定。OS具有天然多孔结构,孔穴表面裸露的氧原子能够提供电子对,与金属的空电子轨道形成相互作用,具备一定的吸附、交换能力,但比较有限[21]。表1中显示OS对F-及Cd2+的吸附容量最小,但以OS为原料制备的HAP材料对F-及Cd2+的吸附容量都有所提高,单一CS及CMCS材料对离子吸附能力有限,但修饰HAP后的复合材料对离子吸附容量与同组单一材料相比有显著提升(P<0.05),复合材料表面具有较高粗糙程度,有利于目标离子的吸附。

图2 CMCS-HAP吸附Cd2+单因素优化实验Fig.2 Single factor optimization experiment of Cd2+ adsorption by CMCS-HAP
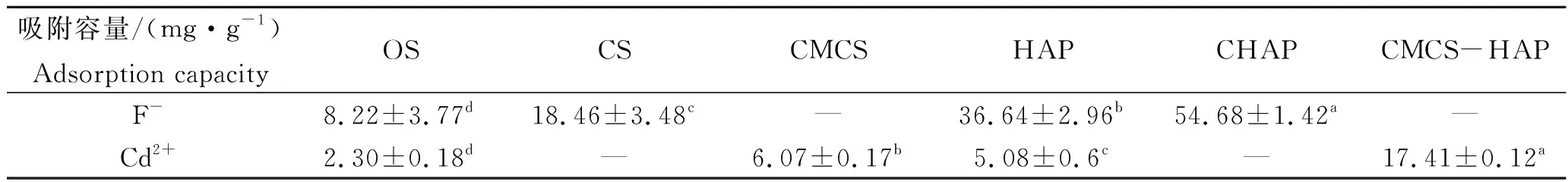
表1 不同材料对F-及Cd2+吸附容量比较Tab.1 Comparison for F- and Cd2+ adsorption capacities of different materials
2.2 材料的表征
2.2.1 傅里叶红外光谱表征
图3为单一材料与复合材料吸附离子前后的FT-IR图,从图3(a)中可以看到材料CHAP在3 564 cm-1处是属于HAP的O-H的伸缩振动峰,1 104 cm-1、1 034 cm-1、601 cm-1及563 cm-1处观察的吸收带分别对应于HAP的P-O的伸缩与振动峰;而2 872 cm-1、1 649 cm-1以及1 569 cm-1处的吸收带分别对应于CS的亚甲基(=CH2)、酰胺I(C=O)以及酰胺II(-NH)[44],材料吸附F-后的FT-IR图相比较吸附前的特征峰强度都有所减弱,在669 cm-1处吸收峰显著增强,说明氨基与F-之间存在较强作用。图3(b)为CMCS-HAP材料吸附Cd2+前后的FT-IR图,复合材料CMCS-HAP在3 564 cm-1处的O-H的伸缩振动峰强度相比较HAP材料弱,说明材料复合过程中HAP晶型发生变化,在1 775 cm-1出现了新的吸收峰,说明CMCS与GA交联生成席夫碱,形成C=N双键,在1 162 cm-1处也出现了新的吸收峰推测在材料复合过程中由于偏碱环境导致部分C=N双键被还原成C-N单键;复合材料中代表羧基官能团的吸收峰1 620 cm-1强度变大,说明羧基与Cd2+有较强的结合。综上所述,制备的复合材料基本没有改变单一材料中存在的化学基团,目标离子都与制备材料有较好的结合。
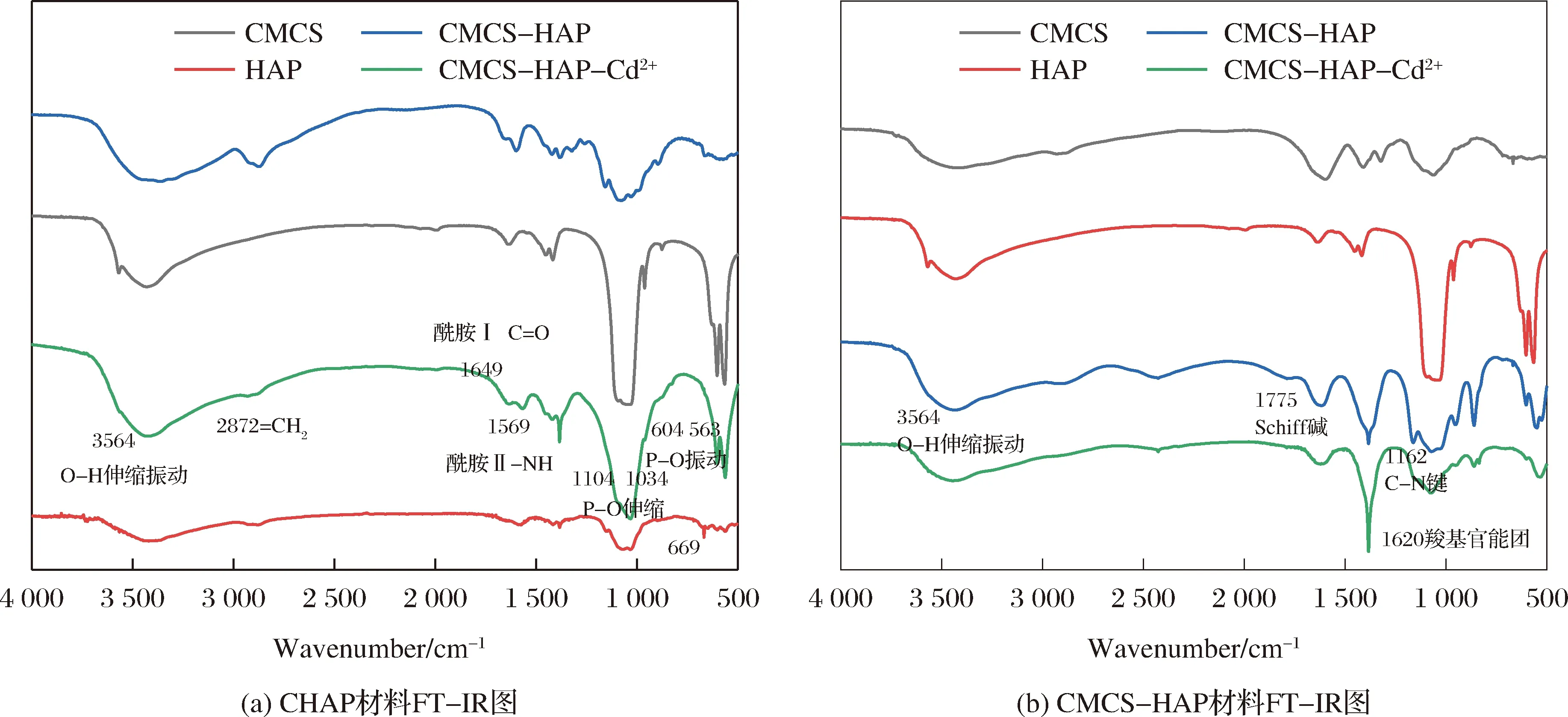
图3 复合材料FT-IR图Fig.3 FT-IR diagram of composite materials
2.2.2 X射线衍射分析
HAP及复合材料吸附离子前后的X射线衍射(X-ray diffraction,XRD)图谱见图4,从图4(a)中可以看出在2θ角为24.2°、32.14°、33.04°、34.02°、40.56°、45.54°和56.07°处的峰对应于HAP的(002)、(211)、(112)、(300)、(310)、(222)、及(322)晶面特征吸收峰[28];复合CS后HAP的特征吸收峰位置及强度未发生较大变化,2θ=20.3°对应于CS特征吸收峰[44],在吸附F-后峰强变弱,说明吸附后的CHAP材料中CS分子呈无定形状态,HAP镶嵌在表面,使CS晶形改变。同时吸附后F-的复合材料在32.14°、33.04°及34.02°处的峰强减弱,而在40.56°及56.07°处的峰强明显增强,说明材料的复合对HAP结晶影响不大,但是吸附F-后材料结晶度发生变化。而从图4(b)中对比HAP以及CMCS-HAP材料吸附Cd2+前后XRD图可以发现,几种材料XRD图中HAP特征吸收峰位置未发生变化,只是峰强发生变化,CMCS-HAP材料中HAP结晶度明显提高,吸附Cd2+后结晶度有所下降。复合材料在2θ=11.9°及21.1°对应的CMCS特征峰峰强非常弱,说明在交联过程中CMCS的晶形发生变化,这与CMCS交联度有关。
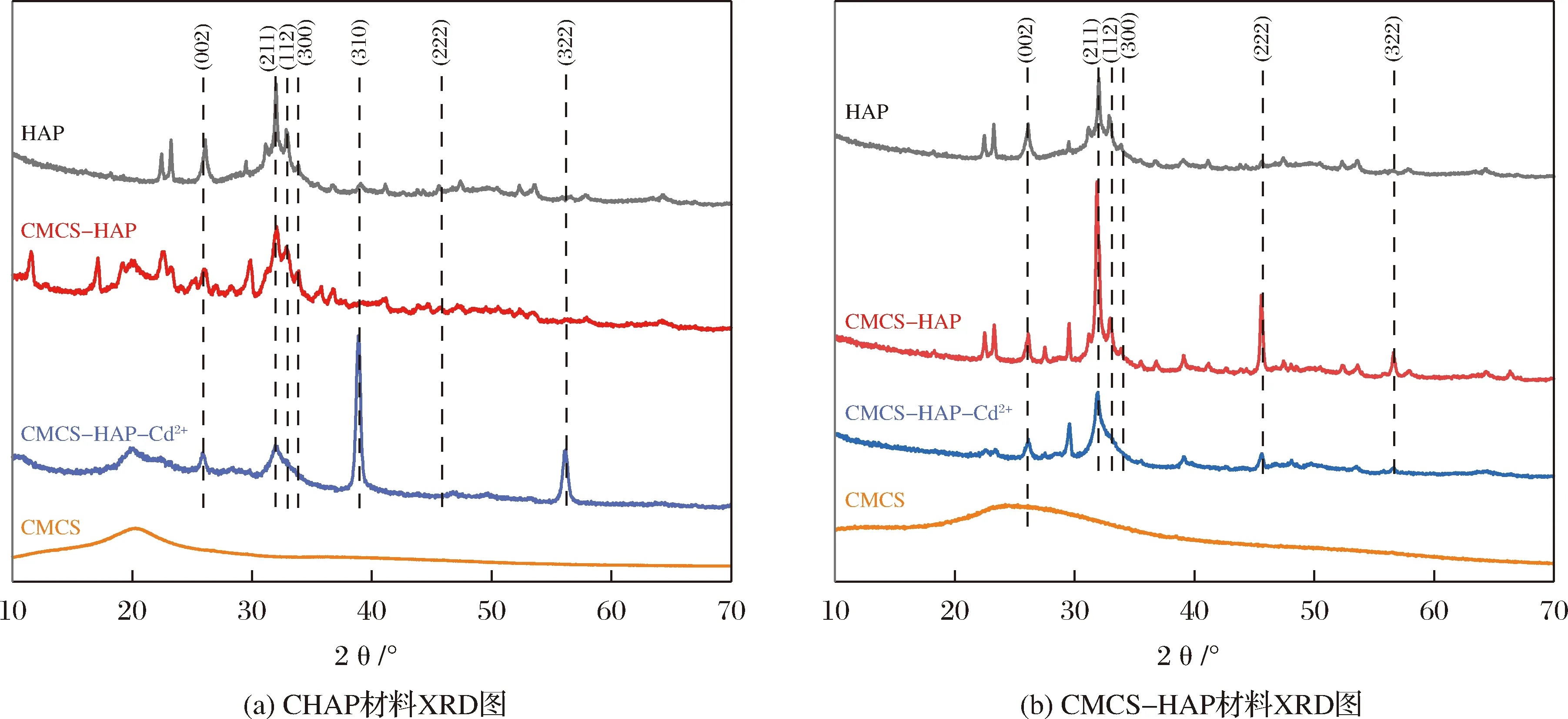
图4 复合材料XRD图Fig.4 XRD diagram of composite materials
2.2.3 材料扫描电镜表征
图5为OS、HAP、CHAP以及CMAS-HAP材料SEM图,从图5(a)可以看出球磨后的牡蛎壳主要为片状结构,具有一定的孔隙;图5(b)为合成的HAP材料具有疏松多孔的形状,但主要呈现为棱片状结构,CHAP 及CMCS-HAP材料SEM图表明HAP基本粘附在CS及CMCS膜表面使目标离子结合位点增多,有利于离子结合。

图5 各材料SEM图Fig.5 SEM diagram of each material
2.3 吸附动力学研究
为研究 CHAP及CMCS-HAP复合材料对离子的吸附机理,采用拟一级动力学、拟二级动力学拟合吸附动力学过程。从图6及表2可以看出两种复合材料拟二级动力学决定因子R2均大于拟一级动力学的决定因子,因此两种复合材料吸附相应离子均符合拟二级动力学模型,分析可以得出两种材料吸附对应离子的吸附动力学的吸附速率主要依靠内表面的化学吸附来控制。

图6 复合材料吸附动力学探究Fig.6 Study on adsorption kinetics of composite materials
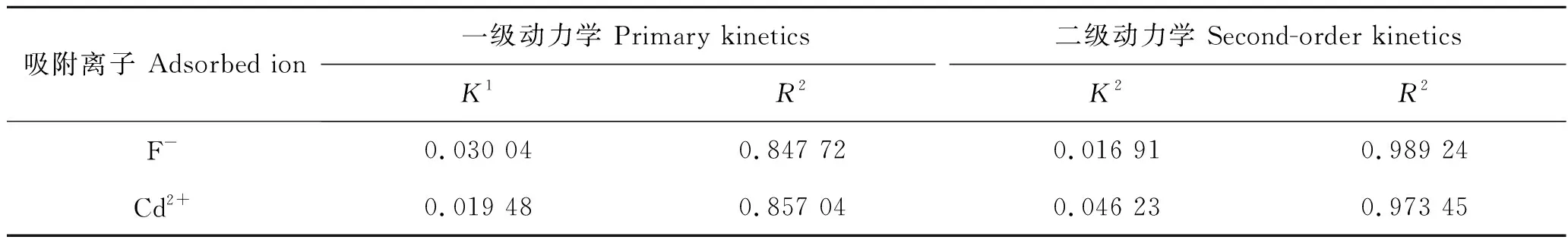
表2 两种离子拟一级、二级动力学参数Tab.2 Pseudo-first order kinetics and second-order kinetic parameters of the two ions
同时利用一级动力学的吸附速率常数,通过动力学函数的计算公式可以计算得出表3所示动力学常数。
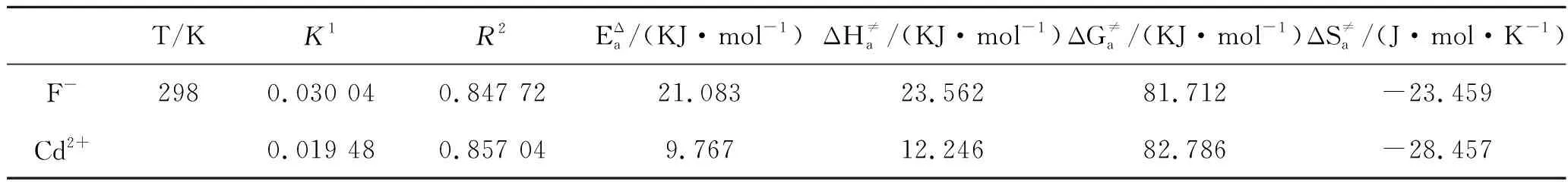
表3 两种离子吸附动力学常数Tab.3 Adsorption kinetic constants of the two ions
2.4 等温吸附曲线
用等温吸附模型在吸附浓度范围内对实验所得数据进行拟合处理,结果如图7所示,从图7(a1)以及图7(b1)可以看出材料吸附容量均随离子的初始浓度的增大而逐渐增大,温度为308 K即35 ℃时,在同样的离子浓度下,两种材料的吸附效果均最佳,拟合的各项数值见表4。

表4 复合材料吸附离子等温吸附曲线及模型分析Tab.4 Isothermal adsorption curve and model analysis of adsorption ions on composite materials
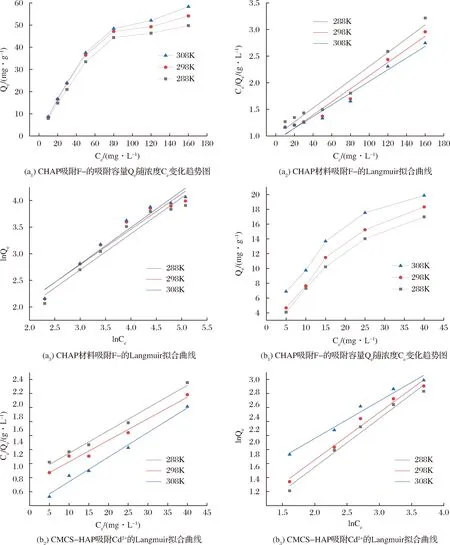
图7 复合材料吸附离子等温吸附曲线及模型Fig.7 Isothermal adsorption curve and model of adsorption ions by composite materials
对比所得拟合曲线的R2,CHAP对F-的吸附行为较符合Langmuir模型,这一结果表明CHAP对F-的吸附可能属于单分子吸附,而且吸附过程主要为化学吸附;CMCS-HAP对Cd2+的吸附行为研究得出两种吸附模型的决定因子R2相同,说明CMCS-HAP对Cd2+的吸附可能包括单分子吸附同时还有其他吸附类型的存在。
3 结论
本研究以OS为原料制备HAP,并通过共沉淀法及交联法分别对HAP修饰制备复合了CHAP与CMCS-HAP两种材料,通过单因素实验优化了复合材料吸附对应离子的条件,优化后F-与Cd2+吸附容量分别可以达到53.67 mg/g、18.41 mg/g。比较了单一材料与复合材料的离子能力,结果表明等质量复合材料相比单一材料离子吸附容量均有提高。材料表征结果显示复合前后未改变单一材料化学基团,吸附离子前后材料结晶度发生变化,复合材料表面粗糙。吸附动力学研究表明复合材料吸附离子均符合拟二级动力学吸附,Langmuir模型能更好描述CHAP吸附F-过程,CMCS-HAP对Cd2+的吸附可能包括单分子吸附同时还有其他吸附类型的存在。本研究基于牡蛎壳制备了羟基磷灰石修饰复合材料并分别对其进行表征及吸附动力学研究,以期为海洋生物废料高值化利用提供参考。

