淡水养殖花鲈胃排空特性及最佳投喂频率研究
李刚,王庆龙,陈志方,张龙,徐扬涛,温海深,李吉方,张凯强*
(1. 全国水产技术推广总站 中国水产学会, 北京100125;2.海水养殖教育部重点实验室(中国海洋大学), 山东 青岛266003;3. 北京市水生野生动植物救护中心, 北京102199;4.利津县双瀛水产苗种有限责任公司, 山东 东营355200)
投喂频率是决定鱼类摄食的关键因素,在控制机体食欲及营养利用方面起重要作用[1]。鱼类在进化过程中,形成了自身特定的摄食节律,在实际生产中如果投喂频率过低将无法满足鱼类自身的生长所需,造成鱼类生长速度减慢、大小差异加大、抵抗力下降等问题,而投喂频率过高将造成饲料浪费和水质污染[2-3]。因此,在养殖过程中,为了提高鱼类生长性能、养殖效益,需要探索鱼类最佳的投喂频率。关于鱼类投喂频率的研究主要是通过设置不同的投喂策略来进行长期的养殖试验,然后通过比较各投喂处理间鱼体生长性能等确定最佳的投喂频率。胃排空率(Gastric evacuation rate, GER)是指胃内食物排出的速率,也可通过胃排空率来制定鱼类合理的投喂策略[4-5]。近年来,大多研究者将投喂频率试验结合胃排空率来综合确定鱼类最佳的投喂频率。
花鲈(Lateolabraxmaculatus)隶属硬骨鱼纲(Osteichsthyes)鲈形目(Perciformes)鮨科(Serranidae)花鲈属(Lateolabrax),又称中国花鲈,俗称海鲈、寨花、七星鲈等,分布于中国沿海、日本靠近中国一侧沿海,南至越南边界,北至朝鲜半岛西岸,为东北亚特有种[6]。其肉质细嫩、味道鲜美、营养价值高,广受消费者喜爱。花鲈为典型的广温、广盐性鱼类,抗逆、抗病能力强,在池塘、工厂化及网箱等水体中均可良好生长,具有非常广阔的养殖前景。目前对花鲈的相关研究主要集中在养殖环境因子生理应答机制方面,如盐度[7-11]、温度[12]、溶解氧[13-14]等,对淡水养殖条件下花鲈胃排空和投喂频率试验相结合来确定最佳投喂策略的研究未见报道。本研究以淡水养殖花鲈为研究对象,通过胃排空和投喂试验相结合的方式确定其最佳日投喂频率,从而为花鲈淡水养殖生产提供指导。
1 试验材料与方法
1.1 试验材料
试验地点为全国水产技术推广总站北京淡水良种示范基地。挑选1 200尾花鲈,体质量(143.18±4.69) g,体长(18.82±0.17) cm,用于胃排空和投喂频率试验,幼鱼体质健壮、无伤无病、无畸形。试验在“鱼菜共生”系统中进行,所用养殖容器为15个4.0 m3的圆柱形桶。试验所用饲料为加州鲈全价配合饲料,其中粗蛋白含量≥45%,粗脂肪含量≥10%,粗灰分含量≤16%,粗纤维含量≤5%。两试验期间溶解氧大于5 mg/L,pH为7.98~8.04,氨氮浓度小于0.2 mg/L,亚硝酸盐含量小于0.1 mg/L,光周期为10 h∶14 h。
1.2 试验设计
1.2.1 淡水养殖花鲈胃排空试验
随机选取240尾花鲈暂养于3个4.0 m3的圆柱形桶中,每个水桶80尾。每天饱食投喂2次,幼鱼正常摄食1周后进行胃排空试验。试验鱼饥饿24 h后每个水桶随机捞取6尾幼鱼检查胃内有无残饵,确定无残饵后开始胃排空试验。胃排空试验开始时,一次性投喂直至幼鱼达饱食状态,饱食后每个水桶分别于0、3、6、9、12、15、18、21和24 h时随机捞取6尾幼鱼,MS-222(200 mg/L)麻醉后称量体重,然后解剖取出胃组织称量胃含物质量(湿重)。胃排空试验期间水温为24 ℃。
1.2.2 投喂频率试验
投喂频率试验设置了4个处理组,分别为1次/2 d(F1组)、1次/d(F2组)、2次/d(F3组)、3次/d(F4组)。每组设3个重复,试验周期为7周。每个养殖桶中随机放入80尾花鲈幼鱼。暂养1周使幼鱼正常摄食后开始投喂频率试验,暂养期间每天早晚两次饱食投喂加州鲈配合饲料。
试验按照具体投喂时间进行投喂(表1)。投喂前称量饲料重量,待绝大多数花鲈幼鱼不再摄食时停止投喂,此时称量剩余的饲料,两次差值即为投喂量。每天记录投喂量、死亡等情况。每隔3~5 d清除残饵、粪便等污物一次,同时往循环系统中添注新鲜井水。试验用水为循环的地下井水,暂养、试验期间每天循环水量为200%。试验期间水温20~24 ℃。

表1 各组花鲈幼鱼投喂时间和投喂频率Tab.1 Feeding time and frequency of Lateolabrax maculatus in each group
试验结束后,每组随机捞取30尾鱼,测量体长、体重。200 mg/L MS-222麻醉后,每组采集6尾鱼的尾部静脉血,按照血液∶抗凝剂(15 g/L EDTA-2Na)=500∶150的比例制备抗凝血,4 ℃冰箱保存,用于血液生理指标的测定。血液白细胞数、红细胞数、血红蛋白数以及血小板数采用深圳迈瑞生物医疗电子股份有限公司生产的全自动血液细胞分析仪(BC-2600)进行测定。
1.3 数据处理
1.3.1 胃排空模型的拟合
选择线性模型、指数模型和平方根模型3种数学模型进行胃排空数据的拟合。通过比较分析3种拟合模型的相关系数(R2)、残差平方和(RSS)及残差标准差(SDR)来确定淡水养殖花鲈最佳胃排空模型。3种模型的数学方程式见式(1)~式(3):
线性模型:Y=A-B×t
式(1)
指数模型:Y=A×e-B×t
式(2)
平方根模型:Y0.5=A-B×t
式(3)
式中:Y为胃含物湿重百分比=胃内含物湿重/总摄食量×100%;B为瞬时胃排空率(g/h);t为摄食后的时间(h);A为常数。
1.3.2 投喂频率相关生长指标测定
投喂频率试验生长指标有存活率(survival rate,SR)、增重率(weight gain rate,WGR)、特定生长率(specific growth rate,SGR)、饲料转化率(food conversion efficiency,FCE)、摄食率(feeding rate,FR)、肝体指数(hepato somatic index,HSI)、脏体指数(visceral somatic index,VSI)、肥满度(condition factor,CF)。以上测定生长指标公式见式(4)~式(11):
SR=N2/N1×100%
式(4)
WGR=(W2-W1)/W1×100%
式(5)
SGR=(lnW2-lnW1)/(t2-t1)×100%
式(6)
FCE=(W2-W1)/F×100%
式(7)
FR=F/[(t2-t1)(W2+W1)/2]×100%
式(8)
HSI=G/W×100%
式(9)
VSI=N/W×100%
式(10)
CF=W/L3×100
式(11)
上式中,N1、N2分别表示t1、t2时的鱼尾数(尾);W1、W2分别表示t1、t2时的鱼体重(g);F表示饲料投喂量(g);G表示鱼体肝重(g);N表示鱼体内脏(g);W表示鱼体重(g);L表示鱼体长(cm)。
1.4 统计分析
试验数据均以平均值±标准差(M±SD)表示,实验前、结束后的数据用Excel 2021和SPSS 20.0统计软件进行统计处理。运用单因素方差分析(One-way ANOVA)检验各组的各项指标,应用Duncan′s多重比较检验各组数据间差异显著性。以P<0.05为显著性水平。
2 结果
2.1 淡水养殖花鲈的胃排空特征
在24 ℃条件下,淡水养殖花鲈胃内容物湿质量及其百分比的变化见表2。由表2可知,花鲈幼鱼饱食后各取样点间体重无显著性差异,花鲈幼鱼瞬时胃含物湿重随饱食后时间的变化先降低后趋于平缓,之后再降低,最后达到0。在饱食后0~3 h,胃内容物湿重及其百分比略有下降,但无显著差异;3~6 h,胃内容物湿重及其百分比迅速降低,在饱食后6 h时下降到(1.80 ± 0.36) g和(47.12 ± 9.53)%,与0 h存在显著差异(P<0.05);6~12 h,胃内容物湿重及其百分比趋于稳定;15~21 h,胃内容物湿重及其百分比持续下降,但与12 h无显著性差异;饱食后24 h,胃内容物湿重及其百分比显著低于12 h(P<0.05),且胃内容物基本排空。

表2 花鲈胃内容物湿质量及其百分比的变化Tab.2 The changes for wet mass and percentage of gastric contents in Lateolabrax maculatus
2.2 淡水养殖花鲈的胃排空模型选择及胃排空时间预测
花鲈幼鱼3种胃排空模型拟合情况见表3。由表3可知,从决定系数R2来看,花鲈幼鱼胃排空拟合程度平方根模型优于线性模型,指数模型最差,而线性模型(R2=0.874)与平方根模型(R2=0.893)差距较小;从残差平方和RSS及残差标准差SDR来看,指数模型最小,平方根模型次之,线性模型最大。因此,综合3种拟合模型的R2、RSS和SDR,平方根模型相比于其他两种模型拟合程度更好,可以定量描述淡水养殖花鲈胃排空曲线。
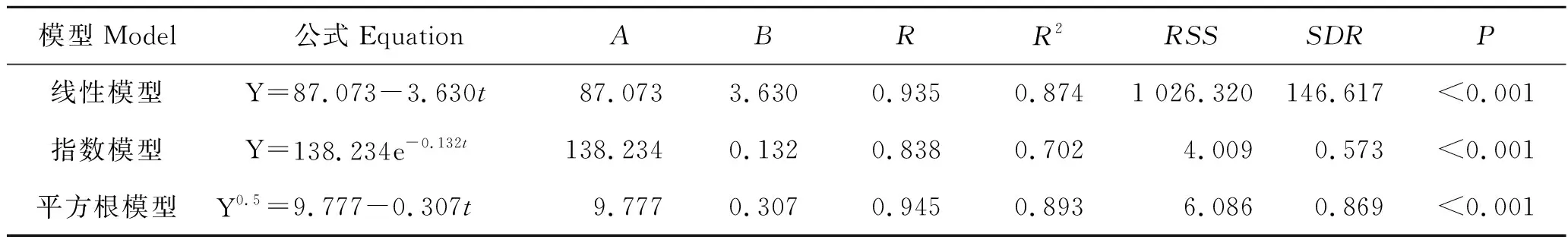
表3 花鲈幼鱼胃排空模型参数比较Tab.3 Parameter comparison of gastric evacuation model for juvenile Lateolabrax maculatus
平方根模型拟合的花鲈幼鱼胃排空时间预测结果见表4。由表4可知,花鲈幼鱼的胃排空率为0.307 g/h,50%胃排空的时间、80%胃排空的时间和99%胃排空的时间分别为8.82、17.29 和28.59 h。

表4 花鲈幼鱼胃排空时间预测Tab.4 Prediction for gastric evacuation time of juvenile Lateolabrax maculatus
2.3 投喂频率对淡水养殖花鲈生长性能的影响
经过7周的养殖试验,不同投喂频率对淡水养殖花鲈幼鱼存活率、终末体重、增重率、摄食率和特定生长率和饲料转化率的影响见表5。如表5所示,养殖试验期间各处理组成活率均接近100%;F3组终末体重、增重率和特定生长率最高,与F2和F4组间无显著差异,但显著高于F1组(P<0.05)。摄食率F1组显著低于其他3组(P<0.05),而其他3组间无显著差异。饲料转化率各组间无显著差异。F2和F4组间各生长指标间均无显著差异。
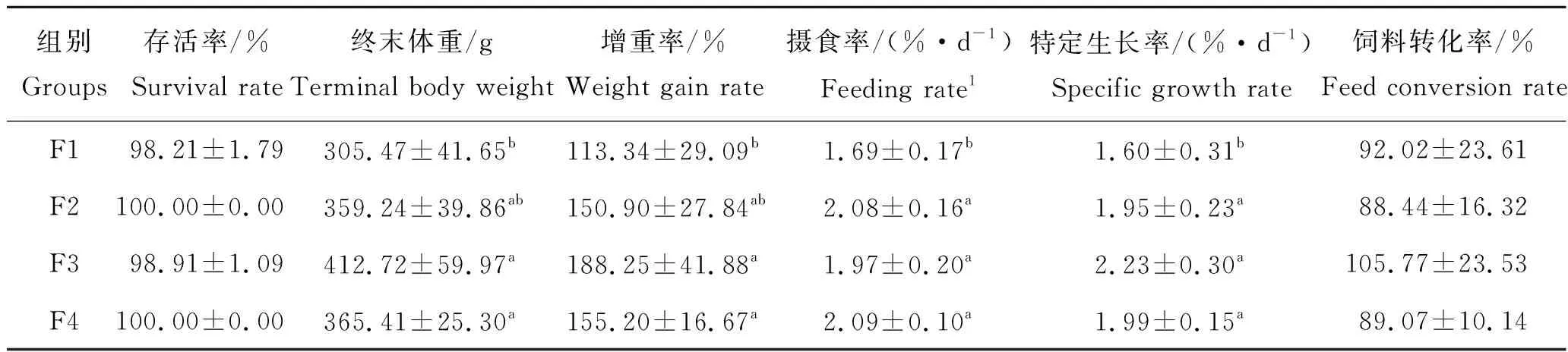
表5 投喂频率对淡水养殖花鲈幼鱼生长性能的影响Tab.5 Effects of feeding frequency on growth performance of juvenile Lateolabrax maculatus
试验结束后,对各投喂组花鲈幼鱼形体指标进行了统计(表6)。如表6所示,肝重、肝体指数、脏体指数和肥满度在不同投喂组间差异不显著。F3组终末体长和内脏重最高,显著高于F1组(P<0.05),但与其他两组无显著差异。
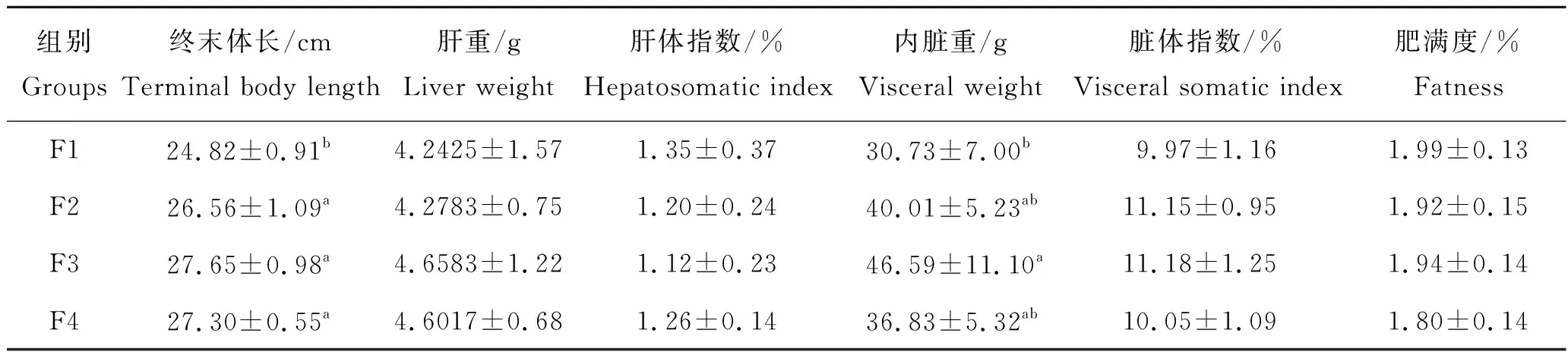
表6 投喂频率对淡水养殖花鲈幼鱼形体指标的影响Tab.6 Effects of feeding frequency on body indicators of juvenile Lateolabrax maculatus
2.4 投喂频率对淡水养殖花鲈血液生理指标的影响
试验结束后,对各投喂组花鲈幼鱼血液生理指标进行了测定(图1)。如图1所示,F1组红细胞、血红蛋白和白细胞数量均显著小于其他3组(P<0.05),而血小板数量显著高于其他3组(P<0.05)。F2、F3和F4组间红细胞、血红蛋白和血小板数量无显著性差异,而F3和F4组间白细胞数量无显著差异但显著高于F2组(P<0.05)。
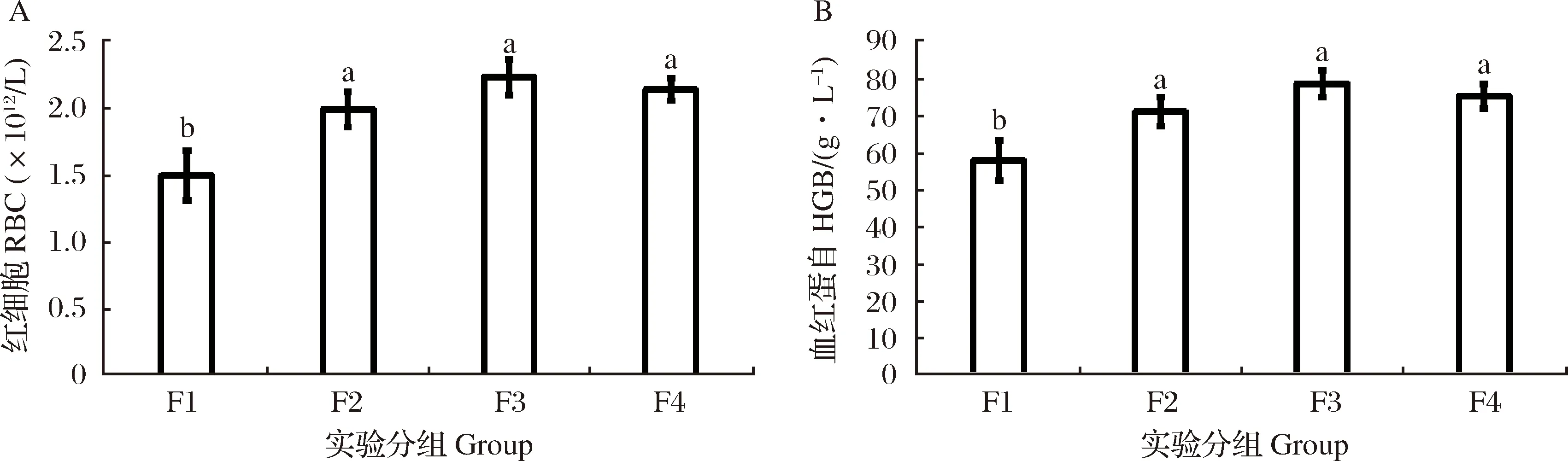
图1 投喂频率对淡水养殖花鲈血液生理指标的影响A:红细胞;B:血红蛋白;C:白细胞;D:血小板Fig.1 Effects of feeding frequency on blood physiological indexes of freshwater cultured Lateolabrax maculatusA: RBC; B: HGB; C: WBC; D: PLT
3 讨论
3.1 淡水养殖花鲈胃排空特征及胃排空时间
鱼类因种类差异、大小差异、食性差异、消化道类型多样性等原因,导致胃排空方式复杂多样。目前,用于拟合硬骨鱼类胃排空方式的模型主要有3种,即线性模型、指数模型和平方根模型[15]。线性模型特点是胃排空速率呈直线下降趋势,多见于肉食性鱼类,如美国红鱼(Sciaenopsocellatus)[16]、许氏平鲉(Sebastesschlegelii)[17]等;指数模型特点是胃排空速率先快后慢,常见于摄食浮游生物的小型鱼类,如玉筋鱼(Ammodytespersonatus)、赤鼻棱鳀(Thryssakammalensis)、小鳞鱵(Hemirhamphussajori)、斑鰶(Clupanodonpunctatus)[18]、小规格虹鳟(Oncorhynchusmykiss)[19]、金头鲷(Sparusaurata)[20];平方根模型特点是胃排空速率先缓慢下降,后快速下降,而后缓慢下降,多见于一些杂食性的鱼类,如条纹锯鮨(Centropristisstriata)[21]、绿鳍马面鲀(Thamnaconusseptentrionalis)[22]、厚颌鲂(Megalobramapellegrini)[23]等。本研究中,花鲈饱食后3 h内胃内容物湿重略有下降,3~6 h胃内容物湿重迅速降低,而后胃内容物湿重缓慢下降,至饱食后24 h时基本排空,拟合胃排空数据结果表明,平方根模型是模拟花鲈胃排空变化的最佳模型。
有研究表明,鱼类食欲的恢复与其胃排空的程度密切相关,50%胃排空时食欲恢复超过一半,80%胃排空时食欲基本恢复,100%胃排空时食欲完全恢复[24-26]。在本研究中,由平方根模型公式Y0.5=9.777-0.307t得出花鲈幼鱼的胃排空率为0.307 g/h,50%胃排空时间、80%胃排空时间和99%胃排空时间分别为8.82、17.29和28.59 h,即淡水养殖花鲈在饱食投喂8.82~17.29 h后食欲至少恢复50%以上。因此,在实际生产中,建议淡水养殖花鲈幼鱼的投饲时间间隔为8.82~17.29 h,即投饲频率为1.38~2.0 次/d。与本研究不同的是,王伟等[2]对海水养殖小规格花鲈幼鱼(2.02±0.03) g胃排空的研究结果表明,胃排空率为0.586 g/h,50%胃排空时间、80%胃排空的时间和99%胃排空的时间分别为4.95、9.38、15.30 h。究其原因可能与花鲈规格有关,有研究表明同鱼种间小规格比大规格消化速率快[19,27]。与本研究相似的是,史氏鲟幼鱼(26.29±1.14) g 50%胃排空的时间、80%胃排空的时间和99%胃排空的时间分别为9.53、17.98、29.17 h[28]。
3.2 投喂频率对淡水养殖花鲈生长指标的影响
研究表明,鱼类最佳投喂频率受到鱼体大小、营养水平、养殖环境等的影响,投喂频率对鱼类生长的影响主要通过改变摄食率和饵料转化率实现[29-31]。鲍枳月等[32]关于不同投喂频率对牙鲆(Paralichthysolivaceus)生长和饵料转化率影响的研究结果表明,随着投喂频率的增加,牙鲆的摄食率、增重率和特定生长率显著增加,而饲料转化率无显著差异,投喂频率对牙鲆生长的影响是由改变摄食率实现的。刘伟等[33]关于投喂频率对吉富罗非鱼(Genetic Improvement of Farmed Tilapia)生长影响的研究中,随着投喂频率的增加,吉富罗非鱼的终末体重、摄食率、增重率和特定生长率显著增加,而饲料转化率出现降低,吉富罗非鱼体重增长是由增加摄食率实现的。相似的,在投喂频率对尼罗罗非鱼(Oreochromisniloticus)生长影响的研究中,随着投喂频率由2次/d增加到3、4次/d,其摄食率、终末体重、增重率均显著增加[34]。随着投喂频率的增加,摄食率、增重率、特定生长率均显著增加,而饵料转化率1次/d组显著高于其他组,表明绿鳍马面鲀的生长与摄食量的增加相关[35]。在本试验中,1、2、3次/d组花鲈的终末体重、摄食率、增重率、特定生长率显著高于1次/2 d组,而饵料转化率4组间虽有差异但差异不显著,因此,花鲈体重的增加主要是由摄食率的增加决定的,与以上研究结果相类似。在1、2、3次/d组中,2次/d组的终末体重、增重率、特定生长率、饵料转化率均最高,而摄食率最低,综合以上指标,淡水养殖花鲈幼鱼每天投喂2次时,生长最快,最节省饲料成本,为最佳投喂频率。
7周养殖试验后,各投喂组花鲈幼鱼肝重、肝体指数、脏体指数和肥满度在不同投喂组间差异不显著。随着投喂频率的增加,饲料蛋白为26.02%时,吉富罗非鱼肝体指数、脏体指数和肥满度均无显著性差异,此结果与本研究结果相一致[33]。同样的,Wu等[36]对草鱼(Ctenopharyngodonidellus)的研究中,投喂频率由1次/d增加到2、3次/d时,肝体指数、脏体指数和肥满度均无显著性差异;Hu等[37]对中华鲟(Acipensersinensis)的研究表明,投喂频率由2次/d增加到3、4次/d时,肥满度无显著性差异。有关红鳍东方鲀(Takifugurubripes)适宜投喂频率研究中,3次/d组肝体指数、脏体指数最高且显著高于2次/d组,与以上研究结果不同[38]。出现投喂频率对形体指标影响结果不同的原因可能与物种差异相关。
3.3 投喂频率对淡水养殖花鲈血液生理指标的影响
血液中白细胞数量是鱼类细胞免疫和体液免疫的重要组成部分,可帮助机体抵御外界及内部伤害;一般血液中血小板数量较为恒定,在机体受伤止血、炎症反应中起重要作用;红细胞是血液中的主要组成成分,主要功能为携带和运输氧气;血液中血红蛋白是氧气的直接载体[13]。本研究中随着投喂频率的增加,红细胞、血红蛋白和白细胞数量呈现上升的趋势,这可能与试验期间花鲈幼鱼的运动情况相关,随着投喂频率的增加,其摄食行为增加致使运动强度增加,导致需氧和抗逆能力增强;而血小板呈现相反的变化趋势,1次/2 d组显著高于其他3组,这可能与1次/2 d组因低的投喂次数导致鱼体抵抗力下降,出现炎症反应等相关。关于饥饿胁迫对花鲈血液生理指标影响的研究表明,花鲈血液中红细胞、血红蛋白、白细胞的数量受到饥饿胁迫后均大幅度下降,表明其运输氧气能力和免疫能力减弱[39]。在本研究中,1次/2 d组红细胞、血红蛋白、白细胞的数量显著低于其他投喂组,与以上花鲈饥饿胁迫研究相同,低投喂频率组具有低的氧气运输能力、免疫能力。关于低氧胁迫对花鲈血液生理指标影响的研究表明,花鲈血液中红细胞、血红蛋白、白细胞、血小板的数量受到低氧胁迫后显著上升,复氧后各指标又恢复到正常水平,这可能与花鲈在短时间低氧胁迫后为维持机体稳态所采取的生理响应机制[13]。以上研究结果表明,花鲈在面对不同外界环境刺激时,其血细胞数量出现不同的变化趋势。
4 结论
本研究以淡水养殖花鲈为研究对象,开展了1次/2d、1次/d、2次/d和3次/d的投喂试验。结果表明,2次/d组的血液生理指标与1次/d、3次/d无显著差异,但其终末体重、增重率、特定生长率、饵料转化率均最高,摄食率最低;胃排空试验结果表明淡水养殖花鲈的日投饲时间间隔应为8.82~17.29 h,即投饲频率为1.38~2.0次/d。综合两试验结果得出淡水养殖花鲈的最佳日投喂频率为每天投喂2次。

