转小麦 TaPDI-A、 TaTRXh-A和 TaPP2Ac-D基因拟南芥植株的主要抗旱性研究
张云瑞,魏 凡,杨燕宁,田淑媛,张双星,张晓科
(西北农林科技大学农学院,陕西杨凌 712100)
小麦(L.)是世界上最重要的粮食作物之一,在生长发育过程中会面临各种生物胁迫和非生物胁迫。干旱作为主要的非生物胁迫之一,严重影响作物的生长发育,是导致作物减产的重要原因。核氧还蛋白(nucleoredoxin,NRX)是硫氧还蛋白(thireodoxin,TRX)超家族的成员,在植物的生长发育、花粉萌发以及抗旱等方面发挥重要作用。研究表明,NRX可通过还原目标蛋白的二硫键来调控蛋白的生物活性。因此,研究NRX互作蛋白的抗旱性功能,对于解析NRX响应干旱胁迫的分子调控机制具有重要意义。
植物NRX蛋白根据TRX-like结构域的数量和氨基酸序列分为3大类:第Ι类NRX含有三个结构域,其中第一个和第三个结构域包含典型的WCG/PPC氧化还原位点,而第二个结构域是一个非典型的TRX结构域,没有任何典型的TRX活性位点;第Ⅱ类和第Ⅲ类NRX包含两个结构域,其中第Ⅱ类NRX包含非典型活性位点(WYP/AK/PC和W/R/HCL/A/V/RPC/G),第Ⅲ类NRX的第一个结构域包含一个高度保守的氧化还原位点(WCRPC),第二个结构域包含一个典型的TRX活性位点(WCPPC/F/S)。研究表明,小麦第Ι类NRX蛋白基因()受干旱胁迫诱导表达,与植物的抗旱性相关。程 洁等研究表明,TaNRX1蛋白具有体外TRX蛋白还原活性,并且其3个结构域均具有还原胰岛素二硫键的活性。蛋白质并不是独立在细胞中发挥其功能,通常与其他蛋白质相互作用形成复合体后才能完成特定的功能,比如某些赖于构象变化或翻译后修饰的蛋白质功能只有在复合体形成后才能发挥出来。田淑媛等利用生物信息学方法筛选了TaNRX1的候选互作蛋白,然后经过酵母双杂交和双分子荧光互补验证,发现小麦TaNRX1蛋白与蛋白质二硫键异构酶(protein disulfide isomerase,PDI)、h型硫氧还蛋白(h-type thioredoxin,TRXh)和蛋白磷酸酶2A催化亚基(protein phosphatase 2A catalytic subunit,PP2Ac)均存在互作关系,互作部位主要为细胞核和细胞膜,说明TaNRX1与其互作蛋白在生物体内广泛存在,可行使多种生物学功能。研究表明,玉米和小麦基因在非生物胁迫下均上调表达,在硫氧还蛋白的氧化还原途径中具有重要作用,并构成抗氧化防御系统的一部分;豌豆基因由氧化应激诱导表达,可以通过还原抗氧化蛋白参与豌豆组织中活性氧(ROS)的清除;小麦基因同样受胁迫诱导表达,在植物对干旱胁迫的应答中起重要作用。
田淑媛等通过Wheat Exp数据库预测了TaNRX1互作蛋白基因的表达量,的A基因组()和的A基因组()在干旱胁迫下表达量明显升高。Xu等研究表明,基因具有抗旱功能。因此选择、和三个基因进行后续试验。田淑媛等发现,在酵母中过表达、和基因,缓解了干旱胁迫对酵母生长的抑制作用。但是蛋白的抗旱功能在微生物中和植物中可能存在一定差异,为了进一步验证、和基因在植物中的抗旱功能,本研究在模式植物拟南芥()中分别对三者进行了抗旱功能验证。通过农杆菌介导的遗传转化将普通小麦、和基因转化拟南芥获得过表达株系,以T代转基因纯合株系为材料进行抗旱性功能分析,以期为TaNRX1与其互作蛋白TaPDI、TaTRXh和TaPP2Ac的抗旱调控机制研究奠定基础。
1 材料与方法
1.1 植物材料及培养条件
拟南芥()为Columbia生态型,由本实验室保存。
1.2 过表达载体的构建
植物双元表达载体pBI121由本实验室保存。用限制性内切酶H I和I(NEB,美国)双酶切线性化pBI121载体,依据前期克隆的小麦、和基因开放阅读框(open reading frame,ORF)序列,设计带有H I和I酶切位点的同源臂引物121-TaPDI-A-F/R、121-TaTRXh-F/R和121-TaPP2Ac-F/R(表1),利用ClonExpressII One Step Cloning Kit(诺唯赞,南京)将、和基因完整的ORF序列连接到线性化pBI121载体上。测序正确的重组载体分别命名为pBI121:、pBI121:和pBI121:,提取质粒保存备用。

表1 试验所用引物
1.3 拟南芥的遗传转化与鉴定
将pBI121:、pBI121:和pBI121:重组载体转化农杆菌GV3101,通过浸花法侵染拟南芥。T代拟南芥单株种子收获后,利用卡那霉素(Kan)抗性筛选获得T代转基因拟南芥。T~T代拟南芥利用Kan抗性筛选和PCR检测筛选阳性株系。PCR所用引物为121-TaPDI-A-F/R、121-TaTRXh-F/R和121-TaPP2Ac-F/R(表1)。PCR反应体系为20 μL,包括10 μmol·L的模板DNA 1.0 μL,10 μmol·L的上下游引物各0.5 μL,2 × Rapid Taq Master Mix 10.0 μL(诺唯赞,南京),ddHO 8.0 μL。PCR反应程序:95 ℃ 3 min;95 ℃ 15 s,70 ℃ 退火15 s,72 ℃ 延伸30 s,35个循环;72 ℃ 4 min。PCR产物在电压120 V、电流250 mA条件下,利用1%的琼脂糖凝胶电泳检测是否含有目标条带,用E.Z.N.A.Gel Extraction kit试剂盒(Omega,美国)胶回收纯化后连接克隆载体pEAsy-Blunt Cloning Kit(全式金,北京),转化大肠杆菌DH5α,挑单克隆进行测序。测序正确的阳性植株种子单株收获,培养获得转基因拟南芥T代纯合株系。本试验涉及的引物合成和测序服务均由西安热默尔生物科技有限公司完成。
1.4 转基因拟南芥的抗旱性鉴定
幼苗期干旱胁迫后根长的测定:分别选择3个T代转、和基因拟南芥纯合株系(用OE1~OE3表示),用甘露醇模拟干旱胁迫,以野生型作为对照鉴定干旱胁迫对根长的影响。拟南芥种子先用2%的NaClO溶液消毒10 min,蒸馏水冲洗3次后,再用70%酒精处理2 min,蒸馏水冲洗3次。将经过消毒处理的的拟南芥种子(野生型和转基因株系)点播在1/2 MS培养基上,在光照培养箱内竖直培养3 d;挑选长势一致的幼苗,移至1/2 MS培养基以及添加250 mmol·L甘露醇的1/2 MS培养基上;每个株系调查5株幼苗,每个处理重复3次,在光照培养箱(在光照强度为120 μmol·m·s,昼夜温度为25 ℃/20 ℃,光暗周期为16 h/8 h)内竖直培养7 d后测量并记录根长。
成株期抗旱性鉴定:拟南芥成株期抗旱性鉴定采用干旱胁迫复水法,以野生型为对照,将T代转、和基因拟南芥株系OE1~OE3种子直接种植于营养土(基质∶蛭石=3∶1)中,置于光照培养箱中培养21 d后停止浇水,干旱胁迫21 d,待全部拟南芥都呈萎蔫状态后恢复供水,复水5 d后计算存活率。使用IBM SPSS Statistics 20.0对数据进行统计分析。
1.5 转基因拟南芥抗旱相关指标的测定
离体叶片失水率的测定:取在营养土中培养至4周龄的野生型和转基因拟南芥,叶片离体后立即称重(视为初始重量,W1),然后将样品在室温下放置0.5、1.0、2.0、4.0、5.0和6.0 h后称重(W2),参照Srivastava等的方法进行测定,每个试验设置3个生物学重复,计算相对于初始重量减轻的比例,失水率=(W1-W2)/W1×100%。
叶片MDA、脯氨酸及HO含量的测定:野生型和转基因植株在营养土中生长至4周龄后,部分正常供水作为对照,部分停止浇水进行干旱胁迫,7 d后分别取正常供水和干旱胁迫的野生型和转、、基因拟南芥测定叶片中MDA、脯氨酸和HO含量。MDA和脯氨酸含量的测定参照王学奎等的方法;HO含量的测定采用二氨基联苯胺(DAB)染色法:取正常供水和干旱胁迫的拟南芥叶片浸没在0.1 mg·mLDAB溶液中染色 4 h,用清水冲洗去除染色液后加入无水乙醇∶乙酸∶甘油=3∶1∶1(V/V/V),于沸水中脱色 15 min后记录照相,根据DAB染色的深浅来推断叶片中HO的含量。所有试验至少重复3次,使用IBM SPSS Statistics 20.0对数据进行统计分析。
2 结果与分析
2.1 干旱胁迫对转TaPDI-A、TaTRXh-A和TaPP2Ac-D基因拟南芥根长和存活率的影响
为了鉴定转、和基因拟南芥的抗旱性,分别在苗期和成株期对拟南芥进行干旱胁迫处理。在不含甘露醇的1/2 MS固体培养基上,苗期野生型拟南芥的平均根长分别为3.08 cm,转、和基因拟南芥的平均根长为 3.10、2.97和3.01 cm,野生型和转基因拟南芥的根长之间无显著差异;在含有250 mmol·L甘露醇的1/2 MS固体培养基上,野生型拟南芥的平均根长为1.52 cm,转、和基因拟南芥的平均根长分别为2.24、2.42和2.37 cm,均极显著大于野生型,增幅分别为47.4%、59.2% 和 55.9%(图1)。

A:野生型和转基因拟南芥的根长;B:根长的比较分析。WT:野生型拟南芥;OE-1~OE-3:转基因拟南芥株系。图4同。TaPDI-A:转 TaPDI-A基因拟南芥;TaTRXh-A:转 TaTRXh-A基因拟南芥;TaPP2Ac-D:转 TaPP2Ac-D基因拟南芥。图2~6同。**表示转基因拟南芥与野生型拟南芥在0.01水平上差异显著。图2、图3、图5和图6同。
成株期拟南芥在干旱胁迫前,野生型和转基因拟南芥表型无明显差异;干旱胁迫21 d后,野生型拟南芥萎蔫枯死严重,而转、和基因拟南芥萎蔫枯死较轻;干旱胁迫复水后,转、和基因拟南芥存活植株较多,存活率分别为93.3%、93.3%和66.7%,而野生型拟南芥的存活率仅为33.3%(图2)。苗期和成株期的抗旱性鉴定结果均表明,过表达、和基因增强了拟南芥对干旱胁迫的耐受性。
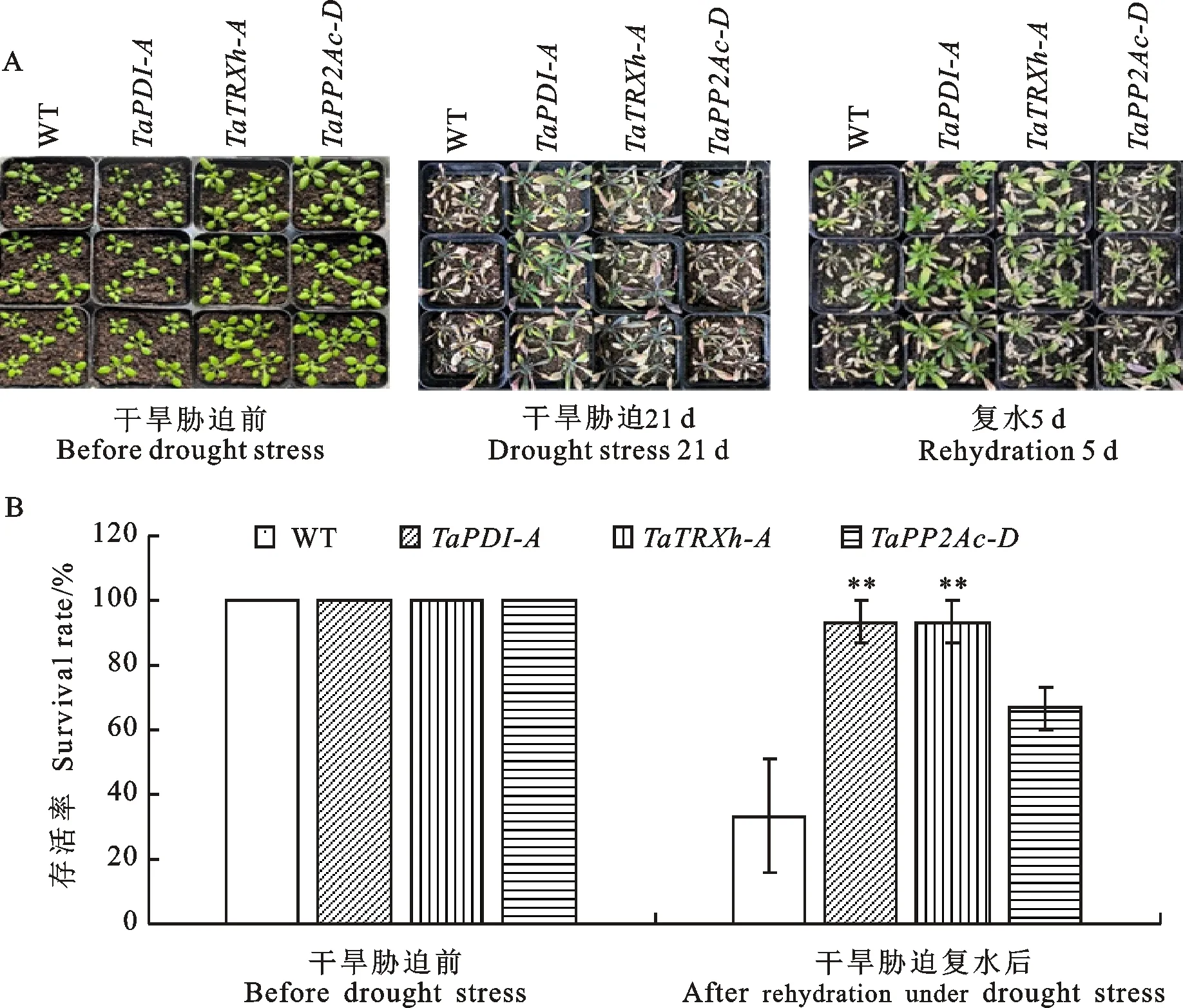
A:野生型和转基因拟南芥的干旱与复水表型;B:干旱胁迫复水后存活率。
2.2 干旱胁迫对转 TaPDI-A、 TaTRXh-A 和 TaPP2Ac-D基因拟南芥离体叶片失水率的影响
从图3可以看出,叶片离体0.5~6.0 h后,转、和基因拟南芥离体叶片均表现出较低的失水率,显著低于野生型,说明过表达、和基因降低了拟南芥在干旱胁迫下的叶片失水率,增强了拟南芥在干旱胁迫下的持水保水能力。
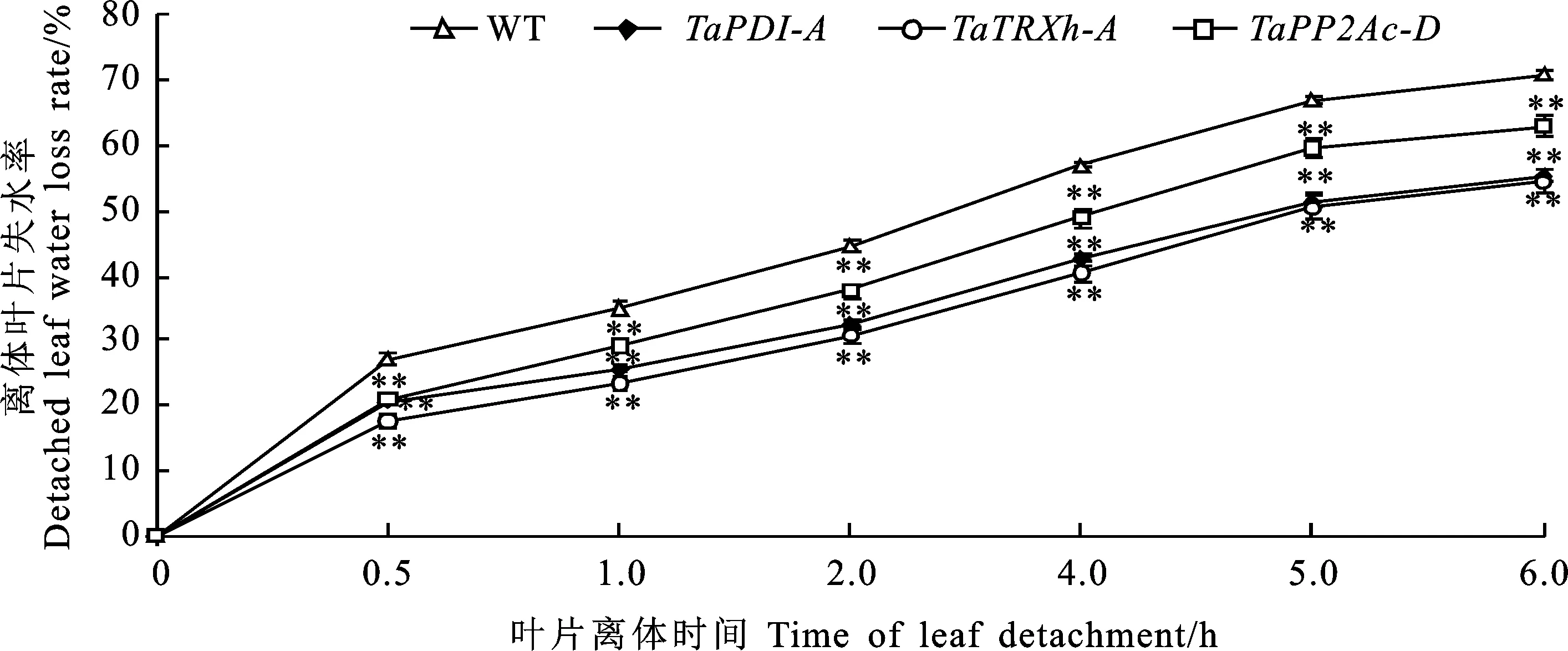
图3 野生型和转基因拟南芥离体叶片失水率
2.3 干旱胁迫对转 TaPDI-A、 TaTRXh-A和 TaPP2Ac-D基因拟南芥叶片H2O2含量的影响
通过DAB对HO组织定位染色发现(图4),正常供水条件下,野生型和转基因拟南芥的叶片染色程度均较浅,两者之间没有明显差异;干旱胁迫条件下,转、和基因拟南芥株系的叶片染色程度比野生型拟南芥浅,表明转基因拟南芥株系叶片中HO含量低于野生型。说明转、和基因拟南芥在干旱胁迫下积累的HO较少。
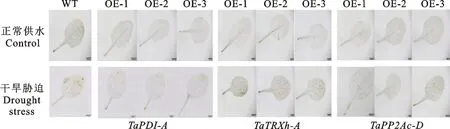
图4 正常和干旱胁迫条件下野生型和转基因拟南芥的DAB染色结果
2.4 干旱胁迫对转 TaPDI-A、 TaTRXh-A 和 TaPP2Ac-D基因拟南芥丙二醛(MDA)含量的 影响
从图5可以看出,正常供水条件下,转基因拟南芥与野生型拟南芥之间的MDA含量无显著差异;干旱胁迫条件下,转、和基因拟南芥的MDA含量均极显著低于野生型。说明转、和基因拟南芥在干旱胁迫下积累的MDA较少。
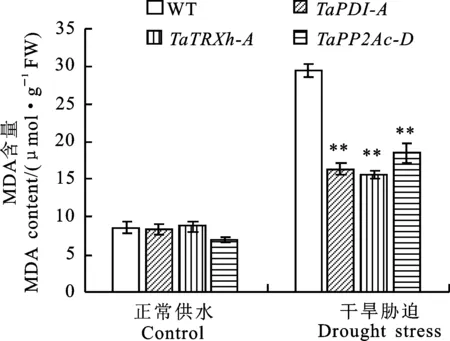
图5 正常和干旱胁迫条件下野生型和转基因拟南芥叶片的丙二醛(MDA)含量
2.5 干旱胁迫对转 TaPDI-A、 TaTRXh-A 和 TaPP2Ac-D基因拟南芥脯氨酸含量的影响
从图6可以看出,正常供水条件下,转基因拟南芥与野生型拟南芥的脯氨酸含量之间无显著差异;干旱胁迫条件下,转、和基因拟南芥的脯氨酸含量均极显著高于野生型。说明过表达、和基因增加了干旱胁迫后脯氨酸的积累,提高了拟南芥的渗透调节能力,对干旱胁迫的耐受性增加。
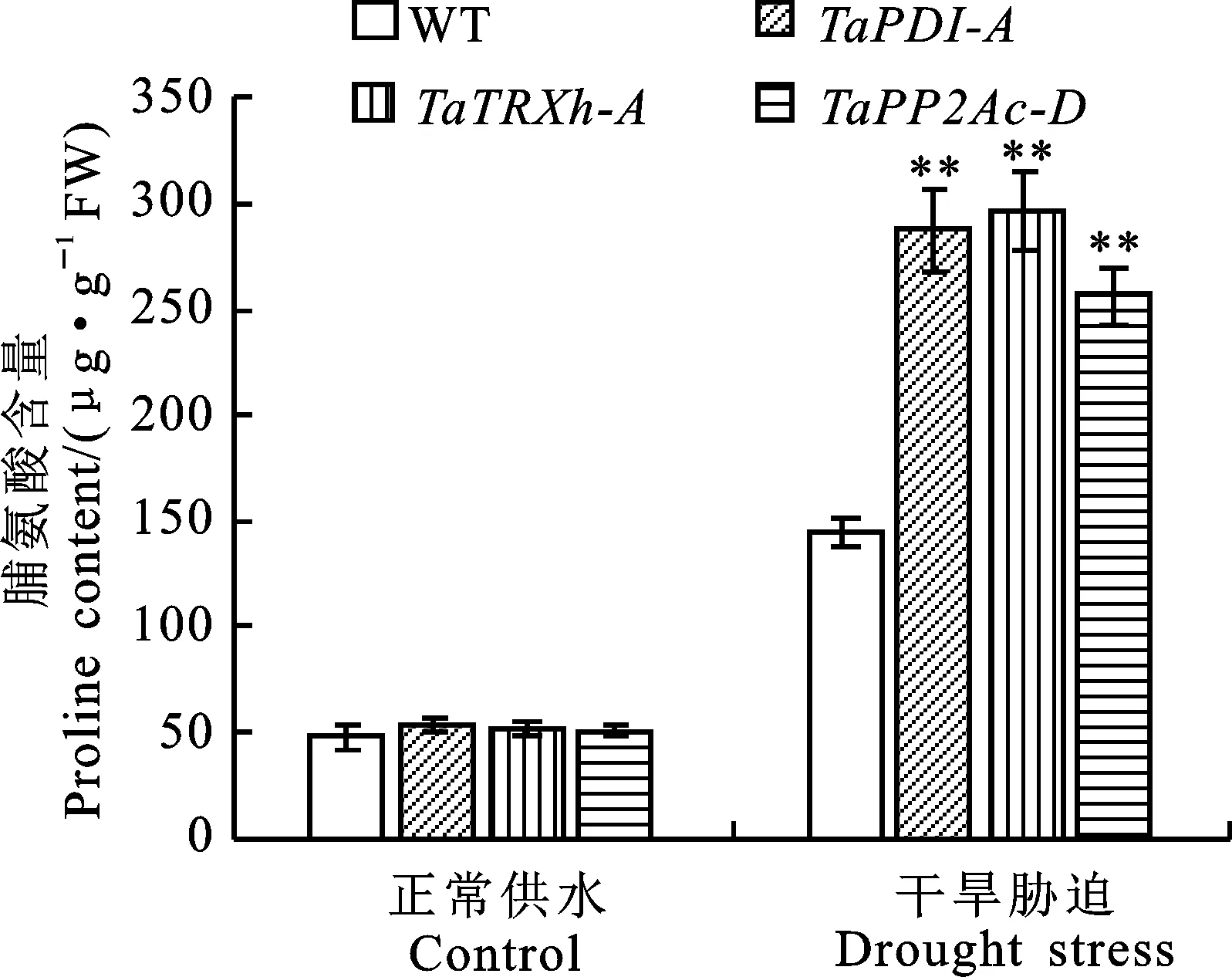
图6 正常和干旱胁迫条件下野生型和转基因拟南芥叶片的脯氨酸含量
3 讨 论
3.1 小麦 TaPDI-A、 TaTRXh-A和 TaPP2Ac-D基因正调控拟南芥的抗旱性
植物可通过提高水分吸收率和减少水分流失率来提高抗旱能力,根系是植物吸收水分和养分的重要器官。本研究发现,干旱胁迫后,转、和基因拟南芥的根长极显著大于野生型,提高了转基因拟南芥根系在干旱条件下的吸水能力,有助于植物抵御干旱胁迫。同时,转、和基因拟南芥的离体叶片失水率显著低于野生型,说明转基因拟南芥可能通过减少叶片的水分流失率来应对干旱胁迫。植物适应干旱胁迫的另一个重要途径是渗透调节,脯氨酸作为重要的渗透调节物质,当植物受到干旱胁迫后,体内会积累大量的游离脯氨酸,降低细胞内水势,减少水分流失或增加水分吸收,从而有助于植物更好地抵御逆境胁迫。本研究结果表明,干旱胁迫后转、和基因拟南芥植株中游离脯氨酸的含量增加,增强了对干旱胁迫的耐受性。前人研究表明,过表达基因增强了拟南芥幼苗对非生物胁迫的耐受性;拟南芥中基国在氧化胁迫条件下表达量明显增加;小麦基因能够被非生物胁迫因子诱导表达,且过表达的转基因烟草比野生型具有更强的抗旱性。本研究发现,在拟南芥中过表达小麦、和基因,提高了拟南芥干旱胁迫下的存活率,正调控拟南芥的抗旱性。这与前人研究结果一致。
3.2 小麦 TaPDI-A、 TaTRXh-A和 TaPP2Ac-D调节活性氧的积累
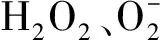
4 结 论
本研究基于本课题组前期筛选的TaNRX1互作蛋白,通过农杆菌介导遗传转化拟南芥。干旱胁迫下,转、和基因拟南芥的根长、存活率和脯氨酸含量均显著大于野生型;叶片离体失水率、MDA含量和HO含量均低于野生型。说明TaNRX1的互作蛋白基因、和能够显著增强拟南芥的抗旱性。本研究丰富了对小麦TaNRX1互作蛋白基因抗旱功能的认识,为小麦抗旱遗传改良提供了理论依据。

