低浓度硫酸下盐石膏相转变机制及石膏晶须制备研究
彭建波,罗兴国,刘 烨,杨丽梅
(云南省盐业有限公司,云南 昆明 650000)
1 前言
氯化钠是重要的化工原料,广泛应用于制碱行业、医药行业和冶金等领域,海洋、盐湖、井矿盐及工业上产生的高盐废水是生产氯化钠的重要来源[1-3]。采用蒸发或冷冻结晶等技术手段,可实现氯化钠的分离回收[4-5]。硫酸钙型卤水中除氯化钠外,还含有少量的硫酸钙和氯化钙[6]。在蒸发结晶分离回收氯化钠时,为防止硫酸钙在系统结垢析出,一般通过添加石膏作为晶种诱导卤水中的硫酸钙结晶长大,避免其沉积结垢,通过斜板沉降实现了石膏的开路[7]。由于石膏的含盐量(一般为10%),因此被称为盐石膏,是硫酸钙型卤水蒸发结晶分离氯化钠过程中重要的副产品[8]。据统计,每生产100万t真空制盐会产生石膏渣2万t左右。制盐企业一般采用堆存、返回矿井填埋或焚烧的方式进行处理,并未实现真正的资源化利用,目前已经成为制约企业发展的重要因素。因此,对盐石膏废渣进行资源化处理具有很重要的意义。
盐石膏制备硫酸钙晶须是提高产品附加值及实现盐石膏资源化利用的有效途径之一[9-10]。硫酸钙晶须(Calcium Sulfate Whisker)是硫酸钙的纤维状单体,无毒无害,具有韧性好、强度高、耐高温、抗化学腐蚀等优良的理化性质,是一种新型环保型绿色无机纤维材料,集增强纤维和超细无机填料二者优势于一体,广泛应用于新型轻质、高强、耐磨多功能高性能复合材料领域[11-12]。石膏晶须制备方法主要有水热合成法和常压酸化法。水热合成法制备石膏晶须过程中,将二水硫酸钙放置于压力反应釜中,在饱和蒸气压的作用下二水石膏变成细小针状的半水石膏,制备得到石膏晶须[13-14];常压酸化法将二水石膏悬浮在酸性溶液中,二水石膏转变成纤维状的半水石膏[15]。相比于水热合成法,常压酸化法不需要压力容器、设备投资成本低,易于实现工业化生产。
Miao等采用常压酸化法从氯化钙溶液中制备半水硫酸钙晶须,结果表明在反应温度102 ℃、1.5%硫酸、反应时间3.5 h条件下制备出长度为600 μm、直径5.7 μm的超细半水石膏晶须[16]。何航等以一种含钙离子的提盐废水为原料,在温度70 ℃,料液pH值2,转速150 r/min,反应时30 min条件下制备得到了平均直径为1 μm~5 μm,长度为20 μm~200 μm的硫酸钙晶须,长径比为71%[17]。常压酸化法的核心是选择合适的溶剂,提高石膏在溶剂中的溶解度。在早期研究中,山东科技大学朱利文等添加30%~40%的柠檬酸铵,硫酸钙在溶液中的溶解度可增加至4.41 g/100 mL溶剂,提高了石膏的转化效率[18]。倪丽娜等研究表明,采用硫酸酸浸纯化磷石膏时,当温度达到80 ℃时,硫酸钙的溶解度达到最高。当硫酸浓度高于10%时,二水硫酸钙溶解度,同时在结晶转化成无水硫酸钙,使磷石膏实现相转变[19]。
2 实验
2.1 实验原料及试剂
研究用的盐石膏原料是取自云南某制盐企业产出的盐石膏,外观呈灰白色,干燥后成块状。通过X荧光分析仪(XRF)对实验所用盐石膏的物质组成与含量进行分析,结果如表1。由表1可知,盐石膏中除主元素外,还含有镁、氯、钠等的杂质元素。因此,利用盐石膏制备石膏晶须时需要进行纯化处理。此外,通过SEM和XRD分析盐石膏的形貌以及物相组成,结果如图1(C)和(D)。
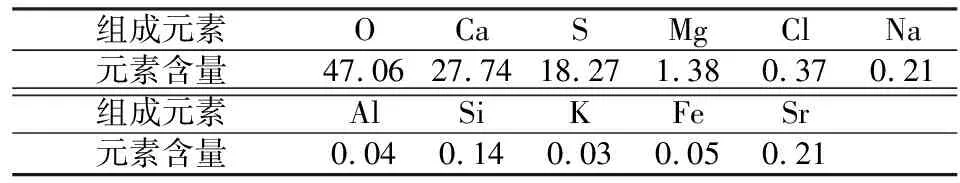
表1 盐泥的主要化学元素组成

(A)云南某企业堆存的盐石膏;(B)实验所用盐石膏原料;(C)盐石膏水溶后的光学显微镜图;(D)盐石膏的SEM图;(E)盐石膏的SEM局部放大图;(F)盐石膏的XRD图谱
2.2 实验方法
2.2.1 盐石膏预处理
盐石膏的水化进程相对缓慢,活性较差。根据表面能和表面活性的基本理论以及化学反应动力学原理可知,反应速率与反应物参加反应的表面积的大小成正比。机械研磨可以使石膏颗粒变小,比表面积增大,与水接触面积变大,吸水变多,溶解速度加大,尤其是钙离子溶出率变大,更有利于晶核生长,从而提高石膏活性。因此,实验开展过程中首先通过水热纯化和机械研磨预处理,其目的是降低盐石膏的粒度和杂质含量。将水洗后的盐石膏放置于干燥箱内,恒温60 ℃干燥6 h。对干燥后的石膏用研磨机研磨,研磨后再干燥6 h,最后进行筛分备用,颗粒形貌及粒度分布如图2。

图2 水热纯化-机械研磨后盐石膏的表观形貌(A)及颗粒粒径分布及其占比(B)
2.2.2 石膏晶须制备方法
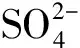
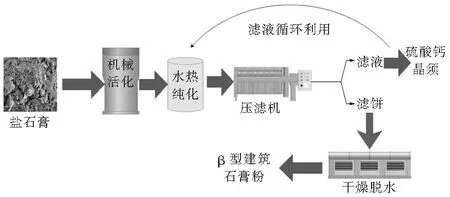
图3 盐石膏资源化利用的工艺流程图
2.2.3 石膏晶须长径比的测定
采用偏光显微镜初步观察晶须产品的形貌,并确定其平均长径比,方法如下:将硫酸钙晶须微溶于乙醇后取少量放在载玻片上,用盖玻片将其轻轻分散呈单层。将放有样品的载玻片放在载物台上,用10×10或10×4的目镜,以所占方格数位单位,分别对硫酸钙晶须的长度和直径进行测量,并以它们所占方格数之比作为晶须样品的长径比。每个样品随意取30个点,记录下每个点的长径比,取其平均值作为所测硫酸钙晶须的平均长径比[20]。
2.3 石膏晶须制备原理
据文献报道,石膏晶须的生成通常包括结晶理论(溶解沉淀理论)和胶体理论(局部化学反应理论),支持前者的学者居多。结晶理论认为硫酸钙晶须的生成实质上是颗粒状的CaSO4·2H2O转化成半水或者无水CaSO4的过程,生成过程是一个“溶解—结晶—脱水”的过程,可用式(1)~式(4)表示。在整个盐石膏溶解、制备晶须过程,盐石膏的溶解是关键。图4是CaSO4·2H2O和CaSO4在不同酸溶浓度和温度下的溶解度。图4表明,在硫酸浓度低于1.0 mol/kg内(硫酸浓度180 g/L),CaSO4·2H2O、CaSO4的溶解度与硫酸浓度和温度成正比。因此,通过提高酸的浓度和温度可以使盐石膏的溶解量增加,石膏晶须的转变效率更高。
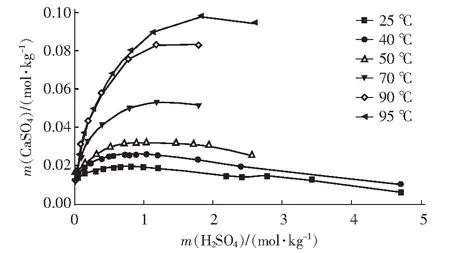
图4 CaSO4·2H2O和CaSO4在硫酸溶液中的溶解度[21-25]
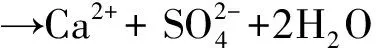
(1)

(2)
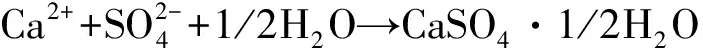
(3)
CaSO4·1/2H2O(纤维状)→CaSO4(纤维状)+1/2H2O
(4)
3 结果与讨论
3.1 硫酸浓度对盐石膏纯化及相转变行为的影响
取400 g去离子水分别配置为H2SO4浓度5 g/L、10 g/L、20 g/L、30 g/L、40 g/L、50 g/L的溶液,称量50 g石膏与配置好的溶液一同加入三口烧瓶中进行反应,控制反应温度为90 ℃,搅拌反应2 h后过滤,反应结束后经过固液分离得到纯石膏和酸化液。纯石膏的主要化学组成如图5,由图5可知,盐石膏经硫酸纯化后,能有效脱除镁、钠、氯等杂质元素,Cl-浓度小于0.5%,满足GB/T 21371-2019的要求。同时,钙得到富集,石膏纯度上升。天然石膏中CaO含量为32.56%,SO3含量为46.51%,经纯化后的盐石膏其纯度基本达到了天然石膏的标准,可作为水泥原料,实现盐石膏的资源化利用。
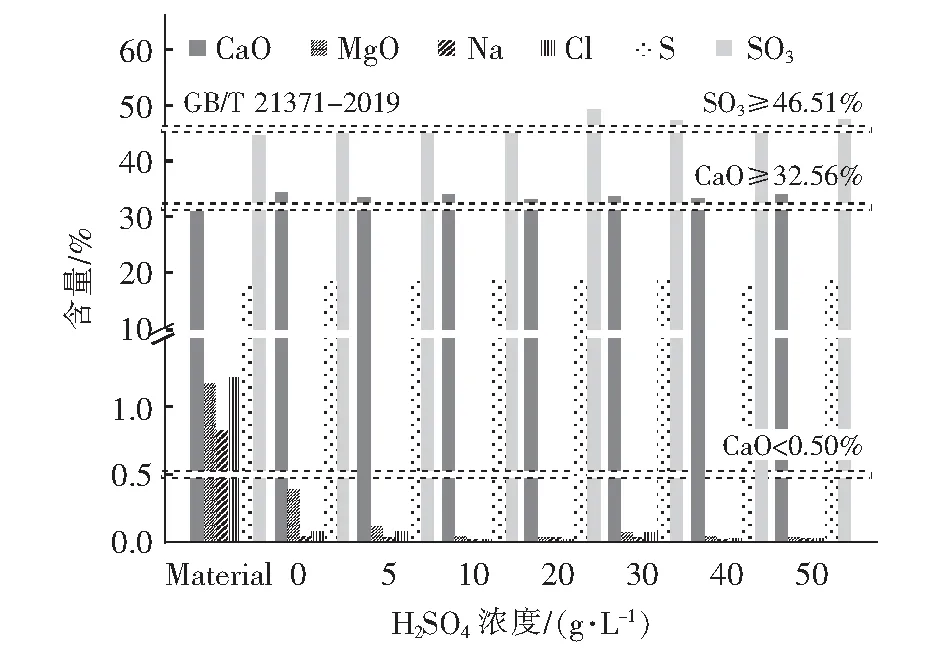
图5 盐石膏40 g·L-1硫酸纯化效果
为探究硫酸浓度对盐石膏纯化过程的晶体相转变行为的影响,采用SEM和XRD对纯化后的石膏进行分析,结果分别如图6和图7。
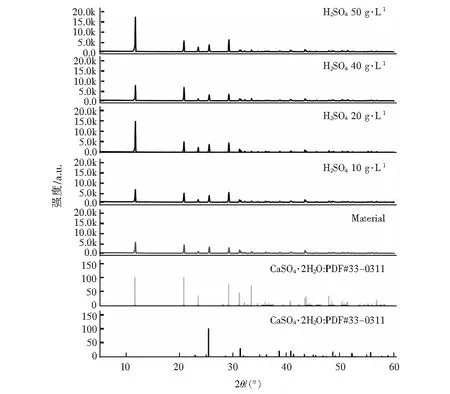
图6 不同硫酸浓度酸化条件下盐石膏的XRD图谱
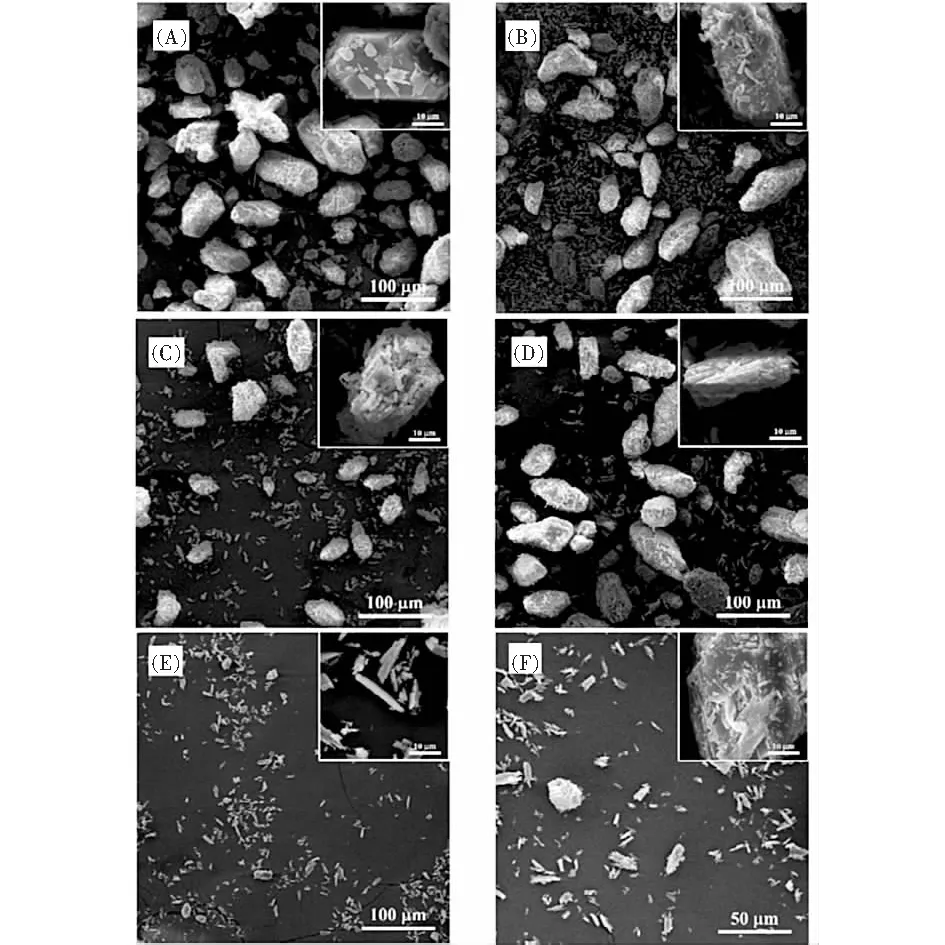
(A)5 g·L-1 H2SO4;(B)10 g·L-1 H2SO4;(C)20 g·L-1 H2SO4;(D)30 g·L-1 H2SO4;(E)40 g·L-1 H2SO4;(F)50 g·L-1 H2SO4
3.2 硫酸浓度对石膏晶须形貌的影响
盐石膏制备石膏晶须的过程,实质是溶解再结晶的过程。硫酸钙晶形貌是判断其理化性质的一个重要指标。根据硫酸钙晶须生成的化学反应方程式,在具体实验研究中,将温度控制在90 ℃,反应时间为2 h,转晶盐石膏在硫酸溶液中的质量分数的范围控制在1%、2%、3%、4%、5%,反应后进行过滤,利用光学显微镜观察滤液结晶形貌,结果如图8。图8表明随着硫酸度的增高,晶须的长度在逐渐增大。

(A)5 g·L-1 H2SO4;(B)10 g·L-1 H2SO4;(C)20 g·L-1 H2SO4;(D)30 g·L-1 H2SO4;(E)40 g·L-1 H2SO4;(F)50 g·L-1 H2SO4
3.3 酸化反应温度对盐石膏溶解度及石膏晶须结晶过程的影响
3.3.1 酸化反应温度对盐石膏溶解行为的影响
根据单因素确定酸化反应过程中硫酸浓度为40 g/L,可制备得到理化性质比较好的石膏晶须,尤其是拥有高的长径比。为了进一步优化石膏晶须制备工艺参数,考察了不同反应温度对盐石膏溶解量的影响,结果如图9(F)。静置时间为0 h指的是酸化反应后溶液中硫酸钙的浓度,及盐石膏的溶解量。由图9(F)可以看出,随着温度的升高,硫酸钙的溶解量在逐渐增大,在95 ℃时滤液静置0 h和7 h硫酸钙浓度的差值最大。因此确定95 ℃为常压酸化反应生成晶须的最佳时间。此外,硫酸钙转化为石膏晶须的转化率随着温度和硫酸浓度的升高而升高,原因可以从结晶学角度去分析。首先,过饱和度是晶体成核及生长的驱动力。在冷却降温过程中,溶液体系发生改变,由此而产生过饱和度。过饱和度的产生速率与过冷度和浓度有关,过冷度越高产生的过饱和度越大。因此,在较高温和高浓度下,溶液中CaSO4的转化率越高。
3.3.2 酸化反应温度对石膏晶须结晶成核及长大过程的影响
图9(A)~(E)是盐石膏在硫酸浓40 g/L,温度分别为60 ℃、70 ℃、80 ℃、90 ℃、95 ℃下反应2 h,再降温结晶后得到的石膏晶须(温度降低至25 ℃)。图9表明,不同转化温度下得到的石膏晶须在长度和直径上都有很大的差异。晶体结晶过程一般包括溶质分子扩散、吸附、成核和生长四个主要过程,不同条件下分别受动力学扩散控制的热力学反应控制。在石膏晶须结晶长大的过程中,温度的影响主要溶质分子动力学扩散过程和由过冷度产生的过饱和度。在两者的共同作用下,60 ℃~80 ℃条件下得到的晶须细而短,90 ℃~95 ℃得到的晶须粗而长。综合考虑95 ℃下盐石膏的溶解量较90 ℃高,因此酸化反应的温度选95 ℃。

(A)60 ℃;(B)70 ℃;(C)80 ℃;(D)90 ℃;(E)95 ℃
3.4 结晶温度和结晶时间对CaSO4转化率和晶须长径比的影响
配制40 g/L H2SO4,反应温度95 ℃,固液比8∶1,将400 mL溶液与50 g石膏混合,酸化反应时间分别2 h、3 h、4 h。反应结束后将酸化液在25 ℃和60 ℃恒温条件下降温结晶,通过测定不同降温时间的硫酸钙浓和石膏晶须的长径比来确定最佳酸化反应时间和降温结晶的时间,实验结果如图10。图10(A)和(B)表明,降温结晶的温度越低(过冷度越大),石膏的转化率就越高。图10(C)表明,随着降温结晶时间的延长,硫酸钙晶须的长径比在下降。当酸化反应时间为2 h,降温结晶时间为5 h,晶须平均长径比达到79%;25 ℃恒温结晶7 h晶须长径比为71%。实验现象显示,酸化液静置7 h后析出石膏晶须的量不再增加。综上所述,盐石膏低硫酸浓度下酸化纯化和制备石膏晶须的优化实验条件为硫酸浓度40 g/L、酸化反应时间2 h、酸化反应温度95 ℃、降温结晶温度25 ℃、降温结晶时间7 h。优化条件下得到盐石膏满足建筑石膏的要求(GB/T 21371-2019),长径比达到79%。
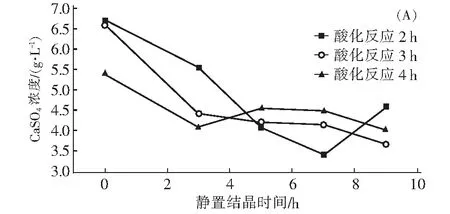
(A)25 ℃静置结晶;(B)60 ℃静置结晶;(C)不同静置结晶时间得到石膏晶须的长径比分布
3.5 硫酸钙晶须表征
图11是在硫酸浓度40 g/L、酸化反应时间2 h、酸化反应温度95 ℃、降温结晶温度25 ℃、降温结晶时间7 h优化条件下制备得到的石膏晶须在30 ℃~1 000 ℃之间的TG-DSC曲线。一般而言,纯石膏的热分解过程大约分为4个阶段,第一阶段是纯石膏的干燥过程,第二阶段是纯石膏失去结晶水的过程,第三阶段是纯石膏不发生任何反应,重量维持恒定不变的一个阶段,第四阶段是纯石膏中硫酸钙发生熔化与分解反应的过程。在进行热分析之前样品已经被干燥过了,所以没有第一阶段的干燥过程,由图11可知,在110 ℃~170 ℃下出现了明显失重,即为第二阶段失去结晶水的过程,样品在此温度范围内失重率是14%(CaSO4·2H2O理论含水量20.93%)。CaSO4·0.5H2O理论含水量为6.21%,可知反应的产物主要是CaSO4·2H2O晶须。在170 ℃~1 000 ℃之间为第三阶段重量维持恒定不变的阶段。纯石膏大约在1 250 ℃时发生分解反应,图11的范围在30 ℃~1 000 ℃之间,所以并未出现第四阶段的现象,但由上图可以看到在850℃时TG曲线有了微微向下的趋势,分析原因可能是因为盐石膏含有的其他微量杂质开始了分解。
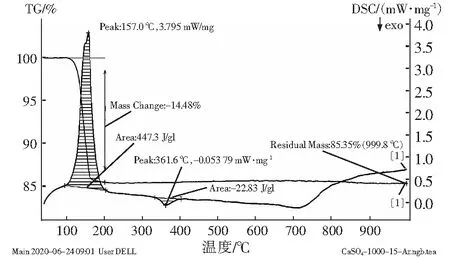
图11 石膏晶须的差热差重图谱
图12是在优化条件下制备得到的石膏晶须的SEM图和XRD谱。图12(A)和(B)显示,在优化条件制备得到的晶须长而粗、表面光滑、长径比达到79%,质量较好。XRD图谱中主要为CaSO4·H2O且峰型好,表明制备得到的石膏晶须纯度高,主要以CaSO4·H2O为主。

(A)和(B)SEM图,(C)XRD谱
4 结论
研究采用常压酸化法制备高纯石膏和石膏晶须,实现了钙型卤水真空蒸发结晶过程盐石膏副产物的资源化利用。
1)盐石膏常压酸化法制备高纯石膏和石膏晶须的最佳反应条件为硫酸浓度40 g/L、酸化反应时间2 h、酸化反应温度95 ℃、降温结晶温度25 ℃、降温结晶时间7 h,制备得到的高纯石膏满足建筑石膏的要求,长径比达到79%。
2)盐石膏经硫酸纯化后镁降低至0.02%、钠降低至0.01%、氯离子浓度小于0.5%,CaO和SO3的含量分别为33.34%和45.07%,制备得到的高纯石膏符合GB/T 21371-2019规定的限定值,可作为水泥等建筑原料,实现盐石膏的资源化利用。
3)物相分析结果表明制备得到的石膏晶须的物相主要以CaSO4·H2O为主,纯度较高。SEM分析表明,晶须长度180 μm,表明致密且光滑,有利于石膏晶须的后续使用。

