多模态导航辅助电生理技术应用于脑胶质瘤治疗的效果及术后复发的影响因素分析
程慧冉
脑胶质瘤是颅内常见恶性肿瘤,占颅内肿瘤的35.2%~61.0%[1],具有发病率、复发率及死亡率高,治愈率低的“三高一低”特点[2-3]。近年来,外科手术是治疗脑胶质瘤重要手段之一,但难点在于如何把控病灶彻底切除与保留功能间的平衡点[4-5]。此外,由于脑功能区存在个体差异,并受病灶对功能区的推挤移位、功能区重塑等诸多因素影响,功能区定位困难,而客观准确定位脑功能区,成为脑胶质瘤手术效果的关键技术[6]。目前,定位脑功能区的方法主要有术前功能影像定位技术与神经电生理监测技术两大类,本研究综合上述定位技术,观察多模态导航辅助电生理技术用于治疗脑胶质瘤的疗效,在此基础上进一步分析术后复发的影响因素,以期为临床采取针对性预防措施,降低复发风险提供科学依据。具体如下。
1 资料与方法
1.1 一般资料
收集2017年1月至2020年10月我院264例脑胶质瘤患者临床资料并进行回顾性分析。选取标准:均为于我院接受手术治疗的脑胶质瘤患者,均具有完整临床病历及完善的影像学检查资料,预计生存期≥6个月;排除标准:合并其他恶性肿瘤者。
1.2 方法
1.2.1 多模态导航辅助电生理技术应用 语言区肿瘤患者,术中运用神经导航引导定位病灶,皮层-皮层下直接电刺激术(DES),以数数、图片命名、朗读等语言任务实施语言功能监测,语言区保护前提下切除肿瘤;运动区肿瘤患者,依据术前影像与功能神经导航,明确病灶和功能区间的相对位置关系,计划手术路径,全麻下实施手术操作,麻醉诱导后肌松剂停用或减量,直至监测完成,手术在功能神经导航引导下实施;首先进行皮层体感诱发电位(SEP)描记,根据SEP最大波幅或相位翻转初步定位中央沟,术中间断性采用皮层-皮层下DES监测与定位功能区及皮层下传导束,切除肿瘤的同时保留运动功能。
1.2.2 疗效评估 统计患者定位准确率、手术时间、住院时间及术前1d、出院时功能状态,其中功能状态采用卡氏评分(KPS)评估,内含体力状况、功能状况两部分内容,分值0~100分,评分越高,提示受试者功能状态越好。治疗效果评估,完全缓解(CR):病灶消失,维持>4周;部分缓解(PR):肿瘤体积缩小>50%;好转(MR):肿瘤体积缩小25%~50%;稳定(SD):肿瘤体积缩小<25%或增大<25%,且无新发病灶;进展(PD):出现新病灶,肿瘤体积增大>25%[7]。总有效率=(CR+PR+MR+SD)/总例数×100.00%。
1.2.3 复发评估 ①胶质瘤初治患者接受手术治疗切除胶质瘤;②术后复查时MRI、CT等检查显示手术部位无病灶;③术后6个月复查时MRI、CT提示原病灶再次发现胶质瘤。
1.2.4 病例资料收集 通过医院电子病历系统收集整理患者资料,包括性别、年龄、切除范围、病理级别、癫痫发作、术后放化疗、肿瘤直径、术前卡氏评分(KPS)、病理类型、肿瘤部位、是否为多病灶、病程、异柠檬酸脱氢酶-1(IDH1)、免疫组化Ki-67。
1.3 统计学方法
2 结果
2.1 疗效及并发症
264例脑胶质瘤患者采用多模态导航辅助生理技术治疗,定位准确率为100%(264/264),手术时间为(233.42±19.68)min,住院时间(9.73±2.38)d。治疗总有效率为92.80%(245/264),其中71例CR、99例PR、75例SD、19例PD。术前、出院时KPS评分分别为(65.51±2.43)分、(70.18±3.26)分,差异有统计学意义(t=18.662,P<0.001)。
并发症发生率为4.55%(12/264),包括4例颅内感染,5例肺部感染,3例偏瘫。颅内感染出现时,可缩短引流管留置时间,无菌处理引流口,并给予抗生素治疗;肺部感染除给予莫西沙星、头孢哌酮等抗菌药物外,指导其反复排痰,练习呼吸操;偏瘫者加强主被动肢体训练。经对症处理后均得到缓解。
2.2 复发情况及其单因素分析
术后6个月复发率为24.89%(61/245)。根据复发情况分为复发组(n=61)和未复发组(n=184)。2组年龄、切除范围、病理级别、癫痫发作、术后放化疗、肿瘤直径、术前KPS评分、IDH1比较,差异有统计学意义(P<0.05)。见表1。
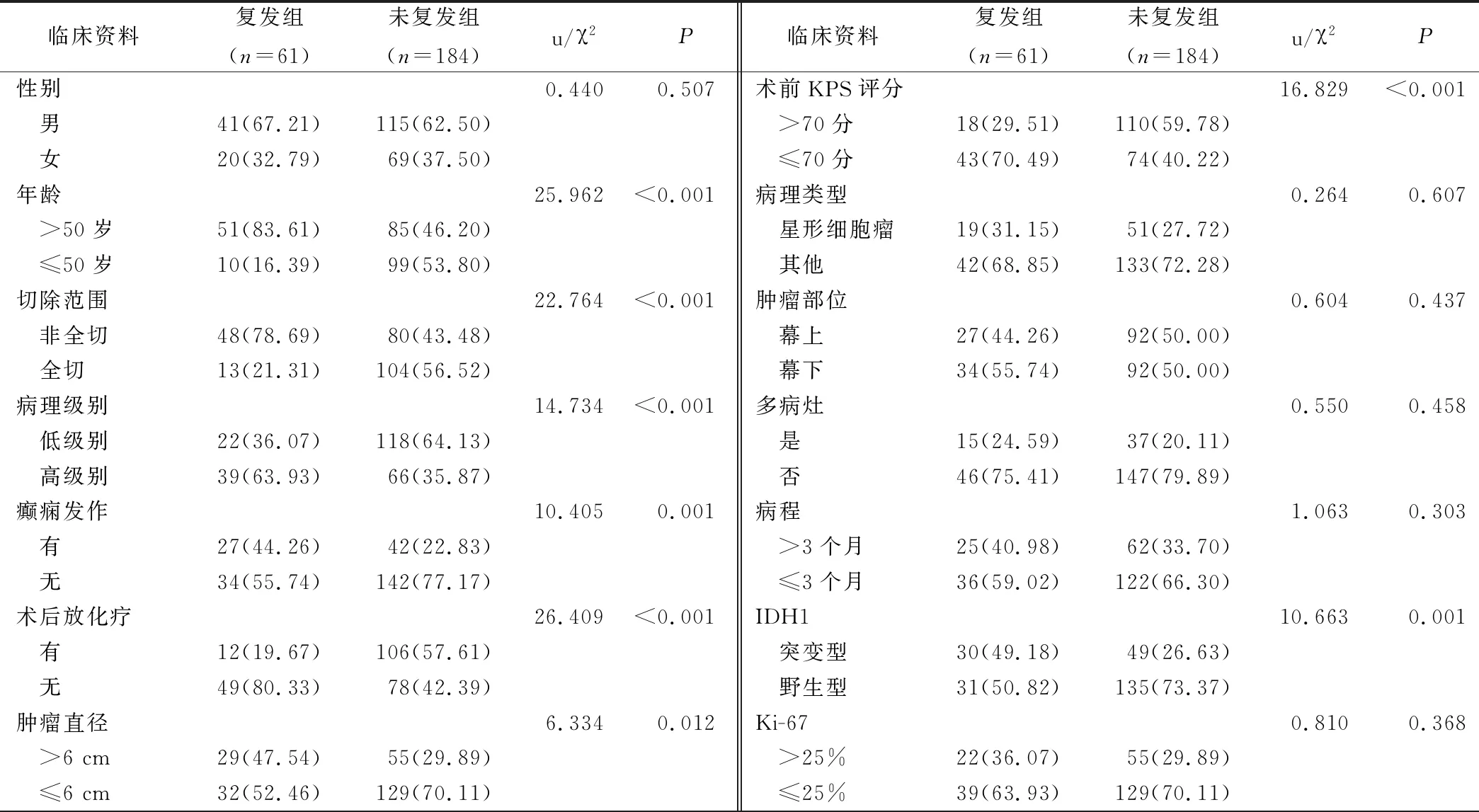
表1 复发单因素分析(例,%)
2.3 复发多因素分析
以脑胶质瘤术后6个月有无复发作为因变量(无=0,有=1),将单因素中具有统计学意义指标作为自变量(赋值见表2),Logistic回归方程分析显示,非全切、高级别、癫痫发作、肿瘤直径>6 cm、IDH1突变型是脑胶质瘤术后复发危险因素,术后放化疗、术前KPS评分>70分是脑胶质瘤术后复发保护因素(P<0.05)。见表3。

表2 赋值情况
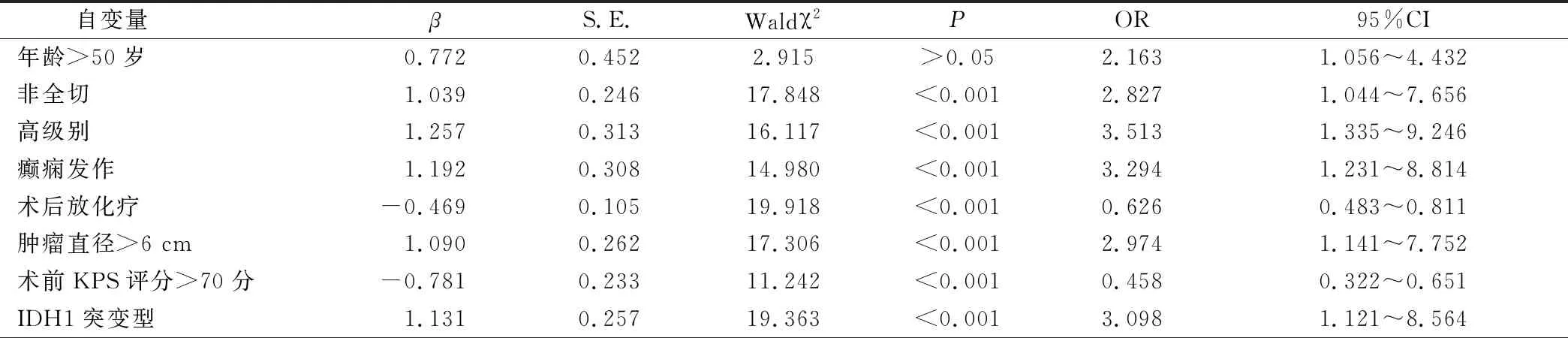
表3 复发多因素分析
3 讨论
近年来,神经导航已常规应用于神经外科手术中,在非功能区颅内病灶定位中具有重要作用,但若术中出现脑移位,可加用超声进行纠正,若涉及功能区病灶手术,神经导航易造成术中脑移位,损伤皮层运动激活区或深部锥体,而多模态导航技术应用于头颅术中尽可能切除肿瘤的同时又不损伤大脑功能区纤维束或皮层,成为功能区胶质瘤手术中关键技术[8-9]。本研究将多模态导航辅助电生理技术应用于脑胶质瘤手术中,结果显示,264例脑胶质瘤患者的总有效率高达92.80%,与以往研究[10]相近,表明多模态导航辅助电生理技术是治疗脑胶质瘤患者的有效手段。另外,本研究显示,264例患者中,术后并发症发生率为4.55%,提示多模态导航辅助电生理技术的应用存在并发症风险,但并发症发生率较低,具有较大临床应用价值;术后并发症主要包括颅内感染、肺部感染、偏瘫,针对感染,临床可加强防控,降低感染风险,对于合并偏瘫患者,可加强主被动肢体训练,最大程度减轻偏瘫症状。
手术是外科治疗的主要方式,手术目标为最大程度切除病灶组织,保留正常组织,减轻对神经功能的影响[11-12]。脑胶质瘤恶性程度高,其快速增长性与不断渗入正常脑组织使其术后存在复发风险[13]。本研究调查显示,术后6个月,脑胶质瘤复发率高达24.89%,对预后造成不良影响。因此,进一步分析术后复发影响因素,采取针对性管理措施,降低复发或延长复发时间成为临床亟待解决问题。本研究经Logistic分析得知,高级别、非全切、IDH1突变型是脑胶质瘤术后复发危险因素。多数研究证实,恶性程度和病理级别对肿瘤的治疗与预后判定具有重要意义[14-15]。另有研究指出,脑胶质瘤复发的间隔时间、复发风险与其病理分级密切相关,恶性程度越高,复发风险越大,间隔时间越短[16]。本研究显示,61例复发患者中,高级别患者占63.93%,且高级别是术后复发的危险因素,提示高级别脑胶质瘤患者预后较差,术后应定期严格复查,力求早发现早治疗,以赢得宝贵生存时间。另外,手术切除是脑胶质瘤治疗策略中关键步骤,最大程度切除病变组织仍是目前手术主要原则,但因脑胶质瘤生长的浸润性,且与周围组织无明显边界,术中难以完全切除病灶,致使肿瘤细胞残存,成为术后脑胶质瘤复发的主要原因[17]。本研究显示,非全切是术后复发的危险因素,随社会进步和医疗观念的转变,人们对脑胶质瘤手术治疗的观念也出现了新转变,由过去的“最大范围切除”转变为“最大程度安全切除”,在确保肿瘤切除的同时,强调患者神经功能的保护,保持患者神经功能完整方能更好地进行后续放化疗,为改善生活质量、延长生存时间奠定基础。2008年,学者Parsons DW在胶质母细胞瘤(GBM)的外显子序列中首次发现IDH1突变,与脑胶质瘤发生发展息息相关,这一发现对脑胶质瘤治疗具有深远影响[18]。本研究经多因素分析,IDH1突变型是脑胶质瘤术后复发危险因素,IDH1突变可造成2-HG异常增高,而2-HG是一种肿瘤细胞代谢产物,在恶性脑肿瘤发生中发挥重要作用,IDH1突变是脑胶质瘤发生、进展及复发的重要因素之一[19-20]。此外,肿瘤直径>6 cm是本研究发现的造成术后复发的影响因素,肿瘤体积越大,累及周围组织范围越广泛,手术切除时难以做到完全切除,成为术后复发的隐患。脑胶质瘤是发生于脑组织的恶性肿瘤,研究发现,30%~50%的脑胶质瘤患者可继发癫痫发作[21-22]。而本研究显示,癫痫发作是脑胶质瘤术后复发影响因素,临床工作中对于继发癫痫者,应加强检查,做到早发现,早治疗。另外,本研究显示,术后放化疗、术前KPS评分>70分是脑胶质瘤术后复发保护因素,术后辅助放化疗是脑胶质瘤治疗的重要辅助手段,对于低级别的脑胶质瘤患者,若手术完全切除,且无预后不良因素者,可进行观察,对于存在不良因素者,观察或选择放化疗;若手术不能完全切除,进展或症状未控者,可化疗或放疗;对于症状稳定者,可放化疗或观察。而对于高分级的脑胶质瘤,不管手术情况如何,均需进行术后辅助放化疗。KPS评分是评估患者身体和机能状态重要评估工具,KPS评分越高,患者神经损伤越小,肿瘤对脑组织造成的压迫或侵袭越少,更有利于预后,因此KPS评分较高者,一般预后较好。
综上所述,在脑胶质瘤治疗中,多模态导航辅助电生理技术治疗效果显著,但存在非全切、高级别、癫痫发作、肿瘤直径>6 cm、IDH1突变型等因素的患者术后复发脑胶质瘤的可能性较大,临床对此类人群,应加强防控,尽量减少危险源,降低复发风险。

