GDF-15及三维斑点追踪技术对应用蒽环类药物的乳腺癌患者出现早期心脏毒性的预测价值
张娜贤 丁旭萌 王 喆 刘 柳 李 刚 刘丽娜
乳腺癌是较为多见的女性恶性肿瘤之一,其起病隐匿,绝大多数患者在诊断时已处中晚期。目前临床上常应用手术、化/放疗及分子靶向治疗等手段来缓解乳腺癌患者的病情进展,以提高其生存率[1]。化疗治疗首选蒽环类药物,但其可引起心脏毒性,而蒽环类药物导致的心肌损伤不可逆,因此,早期准确的心脏功能监测十分重要[2]。但如何早期发现乳腺癌患者的心脏毒性成为关键。目前对于早期心脏毒性检测比较明确的指标为TnL,但仅有一个指标是有限的[3]。生长分化因子-15(GDF-15)被发现与心血管疾病发生发展密切相关,且是转化生长因子-β超家族成员,同时是机体应激时被激活的主要信号蛋白之一[4]。有文献报道GDF-15可能对应用蒽环类化疗药物联合曲妥珠单抗治疗的Her-2阳性乳腺癌患者的心脏毒性发生风险具有预测价值[5]。另外,最新技术三维斑点追踪技术(3D-STI)因可行心肌运动时间和空间的同步性分析,且能客观地量化评估心肌的三维力学状态等而被用于评估乳腺癌患者蒽环类化疗后出现心脏毒性的情况。但上述相关研究仍较少,参考价值有限[6]。因此本研究通过联合分析GDF-15及三维斑点追踪技术对应用蒽环类药物的乳腺癌患者出现早期心脏毒性的预测价值,旨在为此类患者应用蒽环类化疗药后出现心脏毒性的预测进一步提供临床支持。
1 资料与方法
1.1 一般资料
选取2019年10月至2020年9月我院收治的乳腺癌患者60例,年龄36~59岁,平均年龄为(46.9±7.1)岁,均为女性。
1.2 纳入及排除标准
①所有患者均行蒽环类药物为主的化疗治疗,同时未行放疗或其他药物治疗;②在化疗前、化疗2个周期及4个周期完成后2日内行常规超声心动图、3DSTI检查及抽血检验相关指标;③排除先天性心脏病、高血压、冠心病等心血管疾病;④排除心电图、肝肾功能指标等异常者;⑤排除转移性乳腺癌、既往或同期患有其他恶性肿瘤等者。
1.3 检查方法
所有患者接受EC/AC-D方案治疗,具体如下:100 mg/m2表柔比星(E) d1静脉滴注/多柔比星(A)60 mg/m2d1静脉滴注,600 mg/m2环磷酰胺(C) d1 iv,1周期是21天,连续治疗4周期。然后序贯75~100 mg/m2多西他赛(D) d1 iv,1周期是21天,连续4周期。分别于化疗前(T0)、环磷酰胺及表柔比星化疗第2个周期(T2)及第4个周期(T4)结束时,采集所有患者的血样,检测患者血清中GDF-15、cTnL和NT-proBNP水平。cTnL和NT-proBNP用免疫发光分析仪检测;GDF-15用酶联免疫吸附测定试剂盒检测。同期接受三维斑点追踪技术检查,受检者平静状态下应用探头行常规二维超声检查,然后切换探头至三维超声模式采集三维数据,患者发生心脏毒性定义为:①LVEF较治疗前下降≥10%且LVEF绝对值低于53%;②急性冠状动脉综合征、心衰或重度威胁生命的心率失常。
1.4 观察指标
①化疗前后常规超声心动图参数的差异情况;②化疗前后各应变参数的差异情况;③2组患者化疗前后血液相关指标(GDF-15、cTnL、NT-proBNP)的差异情况;④患者心脏毒性预测因素的Logistic回归分析。
1.5 统计学方法
采用SPSS 19.0统计学软件对数据进行处理。计量资料用方差分析。心脏毒性预测因素采用单因素和多因素Logistic回归分析,以P<0.05为差异有统计学意义。
2 结果
2.1 化疗前后常规超声心动图参数的差异情况比较
与化疗前常规超声心动图参数相比,化疗2周期及4周期后患者左室ESV、EDV、LVEF、SV及E/A均无明显变化(P>0.05),见表1 。

表1 化疗前后常规超声心动图参数的差异情况比较
2.2 化疗前后各应变参数的差异情况比较
与化疗前应变参数相比,化疗2周期及4周期后患者GLS及GAS均下降(P<0.05),而另外两个参数变化不明显(P>0.05),见表2。

表2 化疗前后各应变参数的差异情况比较
2.3 化疗前后血液相关指标差异情况比较
与化疗前相比,化疗2周期及4周期后患者血液相关指标均显著升高(P<0.05),见表3。

表3 化疗前后血液相关指标差异情况比较
2.4 患者心脏毒性预测因素的Logistic回归分析
多因素 Logistic回归分析表明仅有GDF-15、cTnl及GLS均为乳腺癌患者接受蒽环类药物治疗出现心脏毒性的独立预测因素(P<0.05),见表4。
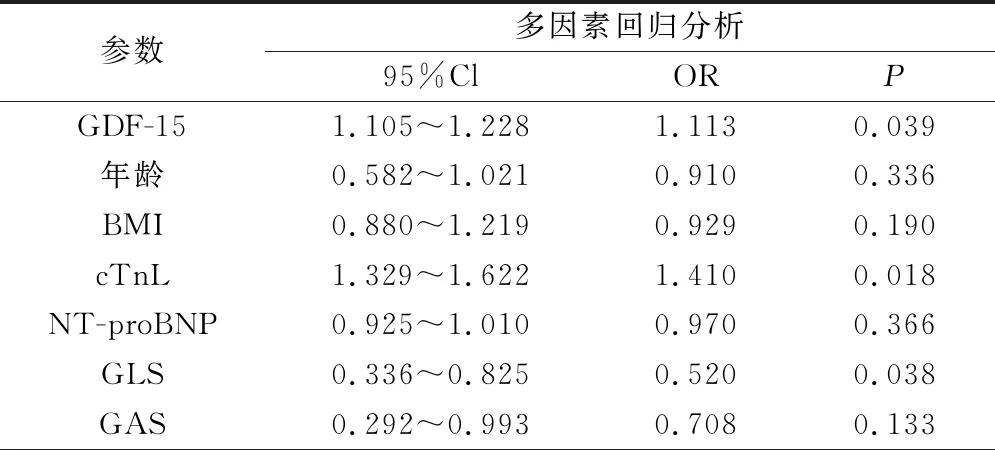
表4 乳腺癌患者心脏毒性预测因素的Logistic回归分析
3 讨论
蒽环类被广泛用于治疗多种恶性肿瘤,包括乳腺癌、卵巢癌等,它的主要不良反应之一是心脏毒性[7]。但由于蒽环类药物引发心脏毒性通常不可逆,因此若能及时发现,其心肌损害是可逆转的[8]。因此,如何早期发现癌症患者的心脏毒性成为关键,对于使用蒽环类药物的乳腺癌患者,都需行风险分层评估[9-10]。目前对于早期心脏毒性检测较为常用的指标是TnI,但仅一个指标是有限的,本研究的目的就是找到更好的检测方法,来检测使用蒽环类药物的乳腺癌患者的心脏毒性的发生。
生长分化因子-15(GDF-15)被发现与心血管疾病发生发展密切相关,是一个包含 308个氨基酸的前体蛋白,可通过自分泌和旁分泌的方式作用于自身或周围细胞,执行基因功能[11]。在正常的生理状态下,GDF-15具有明显的组织特异性,在胎盘及前列腺中高表达,在心脏微量表达或不表达,在肾脏和胰腺中可检测到表达,在其他组织和器官中表达量很低或几乎不表达[12]。当机体发生缺血再灌注损伤时,心肌细胞中GDF-15表达上调,参与心肌缺血损伤等心血管疾病发病过程,但其发挥保护作用的具体机制尚未清楚[13]。鉴于GDF-15对多种心血管疾病严重程度有预测价值,人们推测GDF-15也可能对行蒽环类化疗药物联合曲妥珠单抗治疗的Her-2阳性乳腺癌患者的心脏毒性发生风险具有预测价值[14]。然而,目前国内外仅有数个相关报道,且国内的研究大多为小样本,参考有限。另外随着应变及应变率显像技术在超声方面的发展,GDF-15正成为一种能定量评价心肌功能的诊断手段[15]。而三维斑点追踪技术因可行心肌运动时间及空间的同步分析,临床应用前景更为广阔[16-18]。
本研究通过分析GDF-15及三维斑点追踪技术对应用蒽环类药物的乳腺癌患者出现早期心脏毒性的预测价值,发现与化疗前应变参数相比,化疗2个周期及4个周期后患者GLS及GAS均下降(P<0.05),而另外两个参数变化不明显(P>0.05);另外发现,与化疗前相比,化疗2个周期及4个周期后患者血液相关指标均显著升高(P<0.05)。以上结果表明GDF-15及三维斑点追踪技术对应用蒽环类药物的乳腺癌患者出现早期心脏毒性的有着一定的预测价值。最后我们对乳腺癌患者心脏毒性预测因素进行了 Logistic 回归分析,结果表明仅有GDF-15、cTnl及GLS为乳腺癌患者接受蒽环类药物治疗出现心脏毒性的独立预测因素,此结果进一步证实GDF-15及三维斑点追踪技术同临床常规指标cTnl一样都对应用蒽环类药物的乳腺癌患者出现早期心脏毒性有着一定的预测价值。
综上所述,GDF-15及三维斑点追踪技术在评估蒽环类药物对乳腺癌患者心脏毒性的预测方面有较高的应用价值,可作为早期监测其心脏毒性的可靠方法。

