PTEN基因蛋白、Ptch在口腔鳞状细胞癌中的表达及意义
李海燕 徐 芳 李 媛 李 娟
口腔鳞状细胞癌的发病率具有较高的逐年上升趋势,在长期吸烟或者高温饮食的患者中,口腔鳞状细胞癌的发病率可继续上升[1]。分子生物学蛋白能够在癌细胞的生物学行为调控过程中发挥作用,其对于癌细胞增殖、凋亡及分化的调控障碍,可以增加早期鳞状上皮细胞异常病变的风险。其中磷酸酶及张力蛋白同源基因蛋白(PTEN)能够通过影响到磷酸激酶的活性,影响癌细胞内效应蛋白的磷酸化过程,最终降低癌细胞的自我持续增殖速度[2];补丁蛋白(Ptch)是癌细胞转录调控相关蛋白,其对于遗传物质结构的修饰作用,能够增加癌细胞DNA的异常分裂风险[3]。为了揭示PTEN、Ptch在口腔鳞状上皮细胞癌患者中的表达情况,本次研究选取2017年1月至2020年3月我院保存的口腔鳞状细胞癌组织标本78例,探讨了相关蛋白的表达情况。
1 材料与方法
1.1 一般资料
选取2017年1月至2020年3月我院保存的口腔鳞状细胞癌组织标本78例,其中男性42例,女性36例;年龄31~66岁,平均年龄(48.27±8.99)岁;TNM分期Ⅰ~Ⅱ期55例,Ⅲ~Ⅳ期23例;高分化38例,中低分化40例;有淋巴结转移35例。纳入标准:均经病理学确诊;临床病理资料完整;术前无放化疗等抗肿瘤治疗史。排除标准:合并有其他恶性肿瘤者。同时选取正常口腔组织标本56例作为对照,两组一般资料比较差异无统计学意义(P>0.05),见表1。

表1 两组一般资料比较
1.2 实验方法
将石蜡切片,脱水、清洗、加入一抗、二抗、孵育、显色、封片。
1.3 判断标准
根据染色强度:淡黄色为1分、黄棕色为2分,棕褐色为3分;根据阳性细胞比例:<5%为0分,5%~24%为1分,25%~49%为2分,50%~74%为3分,>75%为4分。染色得分与阳性细胞得分之和≥3分为阳性表达。
1.4 统计学方法

2 结果
2.1 口腔鳞状细胞癌和正常口腔组织中PTEN、Ptch表达情况
口腔鳞状细胞癌中PETN阳性表达率明显低于正常口腔组织(P<0.05),而Ptch阳性表达率明显高于正常口腔组织(P<0.05),见表2。
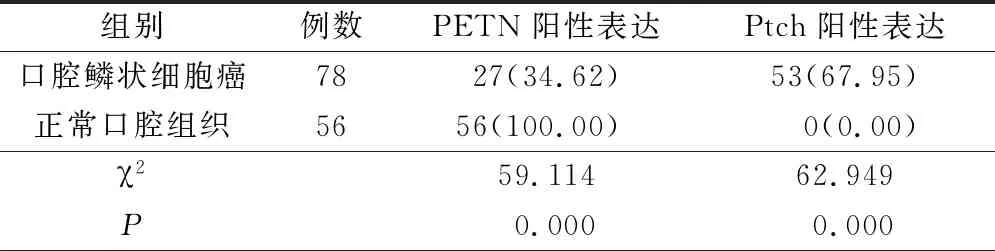
表2 口腔鳞状细胞癌和正常口腔组织中PTEN、Ptch表达(例,%)
2.2 PTEN、Ptch表达与患者临床病理的关系
TNM分期Ⅲ~Ⅳ期、中低分化和有淋巴结转移口腔鳞状细胞癌组织PETN阳性表达率明显低于Ⅰ~Ⅱ期、高分化和无淋巴结转移口腔鳞状细胞癌组织(P<0.05);TNM分期Ⅲ~Ⅳ期、有淋巴结转移口腔鳞状细胞癌组织Ptch阳性表达率明显高于无淋巴结转移口腔鳞状细胞癌组织(P<0.05),见表3。

表3 PTEN、Ptch表达与患者临床病理的关系(例,%)
2.3 相关性分析
口腔鳞状细胞癌组织中PETN表达与Ptch表达呈负相关(γs=-0.655,P<0.05),见表4。

表4 相关性分析/例
3 讨论
口腔鳞状上皮细胞的异常病变,主要由于长期物理性、生物性损伤修复过程中的基因突破有关。在癌基因异常累积的过程中,部分癌细胞增殖调控及凋亡体系的紊乱,最终能够提高口腔鳞状上皮癌的发生风险[4]。口腔鳞状上皮癌的发生,能够显著影响到患者的生活质量,并能够增加口腔癌患者远期病死的几率[5,6]。通过对于口腔鳞状上皮癌发病过程中的基础生物学机理的研究,能够为临床上口腔的病情评估、临床预后随访提供参考。同时鉴于近年来免疫靶向治疗在恶性肿瘤的整体性治疗过程中发挥了重要的作用,本次研究通过对于口腔鳞状上皮癌患者病灶组织中PETN与Ptch的表达分析,不仅能够从另外的角度揭示口腔癌的发生机理,同时还能够为临床上口腔癌的免疫靶向治疗提供新的作用靶点。
PETN作为抑癌基因相关家族成员,其对于癌细胞遗传物质的错配修复作用,能够显著降低癌细胞基因错配的风险。分子领域的分析研究还认为,PETN还能够影响到癌细胞内信号通路的上调程度,干预到MAPK或者PI3K信号通路的激活过程,最终影响到癌细胞DNA的扩增速度[7];Ptch是补丁蛋白家族成员,其对于癌细胞转录调控上游结合蛋白的补丁作用,能够提高癌细胞纺锤体或者细胞器的转录翻译速度。Ptch作为细胞内第二信使的修饰蛋白,其对于信号通路MAPK等的激活,能够进一步影响到恶性肿瘤的发生过程。有少量的研究揭示了PETN蛋白在口腔癌患者病灶组织中的表达情况,认为在口腔癌患者中,PETN蛋白的表达浓度或者表达阳性率水平明显下降[8-9],但对于Ptch的分析研究较少。
通过对于PETN与Ptch蛋白的表达阳性率的分析可见,在口腔鳞状细胞癌患者中,病灶组织中PETN蛋白的表达阳性率明显下降,而Ptch蛋白的表达阳性率水平明显上升,较良性口腔组织均具有统计学差异,表明PETN与Ptch蛋白在口腔癌患者中具有差异性表达的趋势,这可能是因为 PTEN蛋白能调控细胞周期,PTEN 蛋白具有脂质磷酸酶和蛋白磷酸酶的双重活性,可使第二信使PIP3去磷酸化,进而阻断相应的信号传导系统;而Ptch蛋白是通过自分泌和旁分泌来调节新生血管形成,使肿瘤细胞发生上皮细胞-间质转化,刺激肿瘤细胞生长及诱导肿瘤转移。PETN与Ptch蛋白的异常表达现象,主要由于口腔鳞状细胞癌生物学特征的恶化,能够影响到多种病理生理机制,影响到癌基因的错配修复能力,最终影响到PETN与Ptch蛋白的合成和释放。免疫组化染色可见,Ptch蛋白的染色具有不同的强度,在鳞状细胞癌细胞异型性较为明显,或者癌细胞形态不规则的区域,Ptch蛋白的染色强度较深,推测Ptch可能在口腔鳞状细胞癌细胞生物学特征的调控方面发挥了作用[10]。有其他研究者也认为,在口腔癌患者中,PETN蛋白的表达浓度可随着口腔癌细胞转移风险的上升而下降,在合并局部颈部淋巴结或者局部肿块较大的组织中,PETN蛋白的表达阳性率较低[11-15]。在不同的临床病理特征的口腔癌患者中,可以发现在临床终末期、发生了淋巴结转移或者癌细胞分化程度较低的患者,其病灶组织中PETN蛋白的表达阳性率较低,表明PETN能够影响到口腔鳞状细胞癌的整体性病情进展,这主要由于PETN的下降能够影响到癌基因的激活,提高了癌细胞的浸润和转移风险,最终促进了口腔癌临床病理特征的进展;在有淋巴结组织转移的患者中,Ptch蛋白的表达阳性率较高,表明Ptch也能够显著影响到口腔癌的病情进展,其中具体的机制不清,但考虑由于其能够影响到鳞状细胞上游转录启动子TAAT盒子的激活程度,提高了癌细胞的转录过程,增加了癌细胞对于淋巴结内皮组织的粘附能力[16-19]。
综上所述,在口腔鳞状细胞癌患者中,PETN蛋白的表达阳性率明显下降,而Ptch蛋白的表达阳性率明显上升,同时PETN与Ptch的表达能够影响到口腔癌淋巴结转移等病理特征的进展。本文的局限在于未深入探讨PETN与Ptch的表达与口腔癌复发或者治疗预后的关系。

