miR-9-5p对奶牛乳腺上皮细胞乳脂合成的影响
刘青悦,张岩,刘杰,魏祥飞,曲波,姜毓君,王春梅,张莉
(东北农业大学 乳品科学教育部重点实验室,哈尔滨150030)
0 引言
乳脂肪和乳蛋白是牛奶中重要的营养物质。因此,乳脂肪与乳蛋白的含量与组成是决定牛奶营养品质的重要指标[1]。非编码RNAs(miRNAs)是基因表达的重要调节因子,参与了各种生物学过程,在动物的生长、发育等方面发挥着重要作用[2-4]。近几年,miRNAs在奶牛乳腺发育和泌乳方面的研究也有一些进展。越来越多的证据表明,miRNAs通过多种方式调节乳合成相关蛋白基因的表达从而影响乳成分的合成与分泌[5-6]。miR-9-5p在哺乳动物体内普遍存在并参与多种细胞活动和代谢过程,有研究证实miR-9-5p可以抑制骨骼肌卫星细胞和人肥厚瘢痕成纤维细胞的增殖和分化[7-8]。目前关于miR-9-5p的研究主要集中在其在癌症发生发展中的作用方面,研究发现miR-9-5p可以抑制胰腺癌[9]、乳腺癌[10]、肝癌[11]等癌细胞的增殖和侵袭。本实验室在前期研究工作中检测发现miR-9-5p在高乳品质和低乳品质奶牛乳腺组织中的表达存在显著差异,但是miR-9-5p在奶牛乳腺上皮细胞中的作用及作用机制尚不明确,所以本实验主要对miR-9-5p对奶牛乳腺上皮细胞乳脂合成的影响进行了研究。
1 材料与方法
1.1 主要试剂
胶原酶IV,sigma;胎牛血清,BI;培养液干粉,胰酶,Giboc;LipofectaminceTM3000转染实验,Thermo Fisher;MTT溶液、Formazan,Sdartion。
1.2 奶牛乳腺上皮细胞的获取与鉴定
使用胶原酶消化组织块,分离得到奶牛乳腺上皮原代细胞(DCMECs)。将细胞置于含有10%血清、100 U/mL青霉素和100μg/mL链霉素的DMEM-F12培养液中,并处于5%CO2、37℃无菌环境中培养。使用0.25%胰酶进行纯化去除成纤维细胞后,得到奶牛乳腺上皮细胞。采用免疫荧光染色法对细胞进行角蛋白18染色鉴定[12]。
1.3 奶牛乳腺上皮细胞中miR-9-5p的过表达检测
将状态良好的奶牛乳腺上皮细胞均匀接种于6孔板中,并保持生长密度一致。待细胞增长至70%后使用转染试剂(LipofectamineTM3000)向6孔板中转染miRNA。miR-9-5p处理组:3μL Lip3000、100 nmol/L miR-9-5p mimics;阴性对照组:3μL Lip3000、100 nmol/L miR-9-5p NC。
1.4 miR-9-5p对奶牛乳腺上皮细胞增殖影响的检测
将对数生长期细胞接种于96孔板中,计算每孔细胞数为3 000~10 000个细胞。置于37℃、5%CO2无菌环境培养6 h。分别向奶牛乳腺上皮细胞中转染miRNA和NC(每组处理3个重复),细胞在37℃、5%CO2环境中培养24 h后,加入90μL新鲜培养液,再加入10μL MTT溶液,继续培养4 h,然后吸弃上清,每孔加入110μL Formazan溶解液。置摇床上低速震荡10 min,使结晶物充分溶解。在酶联免疫检测仪490 nm处测量各孔的吸光度值。
1.5 miR-9-5p对奶牛乳腺上皮细胞乳脂合成的影响
分别用1 00 nmol/L的miR-9-5p mimics和NC处理细胞,48 h后收取细胞蛋白样品,采用western blotting技术检测乳脂合成相关信号通路蛋白SREBP1的表达变化。使用SDS-PAGE凝胶快速配制试剂盒配制凝胶,按说明书操作。样品电泳后进行湿转,转膜时间90 min。之后进行抗体孵育,一抗SREBP1(Santa Cruz)在4℃条件下过夜孵育,二抗(HRP-山羊抗兔IgG)在37℃条件下孵育2 h。一抗和二抗孵育完成后进行显色。蛋白条带的显色结果使用Sag Capture获得,再通过软件Image J读取蛋白灰度值。
同样,向6孔板中转染mi R-9-5p mimics和NC,培养48 h后去除细胞培养基,用PBS清洗一遍细胞。每孔细胞中加入150μL RIPA裂解液,裂解后的样品(1000~1500)g离心5 min取上清。使用甘油三酯酶联测定试剂盒(普利莱)在酶联免疫检测仪562 nm处测量各孔的吸光度,并计算甘油三脂的含量。
1.6 数据处理与统计分析
所有数据均采用GraphPad Prim 8.0.2统计软件进行分析,数据结果用平均数±标准差来表示,组间比较采用单因素方差分析,组内比较采用t检验并对多组进行了单因素方差分析。p<0.01表示具有统计学显著性差异,p<0.01表示具有统计学极显著性差异。
2 结果
2.1 奶牛乳腺上皮细胞的分离培养与鉴定结果
本实验使用细胞免疫荧光染色法检测奶牛乳腺上皮细胞中角蛋白18的表达。如图1所示,细胞核(蓝色荧光)周围有大量的角蛋白18(绿色荧光)表达。实验结果表明分离纯化后得到的细胞为奶牛乳腺上皮细胞。

图1 奶牛乳腺上皮细胞角蛋白18的鉴定(400×)
2.2 miR-9-5p转染奶牛乳腺上皮细胞
MiRNA处理细胞24 h后,提取各组细胞总RNA进行反转录。使用荧光定量PCR技术分别检测miRNA处理组(mi R-9-5p组)、阴性对照组(NC组)和空白细胞对照组(Control组)的奶牛乳腺上皮细胞中miR-9-5p的表达量变化情况如图2所示。结果可见miR-9-5p组的奶牛乳腺上皮细胞中miR-9-5p的表达量显著增高,且差异性极显著(p<0.01)。
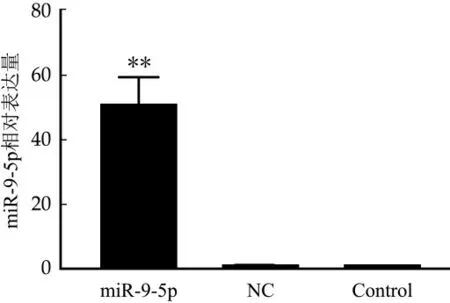
图2 miR-9-5p过表达后奶牛乳腺上皮细胞中的miR-9-5p的表达水平
2.3 miR-9-5p对奶牛乳腺上皮细胞增殖的影响
为验证miR-9-5p是否会对奶牛乳腺上皮细胞的正常生长产生影响,本实验使用MTT细胞增殖检测试剂盒检测了miR-9-5p对奶牛乳腺上皮细胞增殖的影响。实验结果如图3所示mi R-9-5p显著抑制了奶牛乳腺上皮细胞的增殖(p<0.01)。

图3 miR-9-5p对奶牛乳腺上皮细胞增殖的影响
2.4 miR-9-5p对奶牛乳腺上皮细胞乳脂合成的影响
2.4.1 miR-9-5p对乳脂合成信号通路蛋白SREBP1表达的影响
SREBP1是重要的乳脂合成信号通路蛋白,主要通过调控参与乳脂肪合成的多种酶和转运蛋白的表达影响细胞中甘油三脂的合成和分泌。为确定mi R-9-5p是否会影响奶牛乳腺上皮细胞中SREBP1的表达,本实验使用western blotting技术分别检测miRNA处理组和阴性对照组的奶牛乳腺上皮细胞中SREBP1蛋白的表达变化情况。实验结果如图4可见,在miR-9-5p作用下,奶牛乳腺上皮细胞中SREBP1蛋白的表达量显著低于阴性对照组(p<0.01),说明miR-9-5p会抑制奶牛乳腺上皮细胞中SREBP1的表达,并可能因此引起细胞中乳脂合成的下降。

图4 miR-9-5p处理奶牛乳腺上皮细胞后SREBP1蛋白的表达量检测
2.4.2 miR-9-5p对甘油三脂合成的影响
为进一步确定miR-9-5p对奶牛乳腺上皮细胞乳脂合成的影响,本实验使用酶联免疫检测仪分别检测了miRNA处理组和阴性对照组的细胞中甘油三脂的含量(μmol/mL)变化情况。通过绘制标准曲线分别计算两组细胞中甘油三酯的含量。结果如图5所示,与NC组相比,miR-9-5p组的奶牛乳腺上皮细胞中甘油三酯的含量明显降低,且差异性极显著(p<0.01),表明miR-9-5p能显著抑制奶牛乳腺上皮细胞中乳脂的合成。

图5 miR-9-5p处理奶牛乳腺上皮细胞后甘油三脂含量的检测
3 讨论
miRNA是长度大约21~25个核苷酸的一种短的、非编码的RNA分子,可以在转录后水平调节基因的表达[13]。已有研究表明,miRNA参与了调控细胞增殖[7]、分化[14]和凋亡[15]等过程,并同糖代谢[16]、脂代谢[17]、蛋白质代谢[18]及器官发育[19]等多种机体生命活动密切相关。近年来,miRNA在动物乳腺发育和乳成分代谢中的调控作用也不断地被报道。2017年Lei等[20]报道了Let-7g-5p在小鼠乳腺中抑制β-酪蛋白的表达。张等[4]发现miR-3880过表达具有促进小鼠乳腺细胞甘油三酯合成的作用。在牛乳腺上皮细胞中,研究人员发现miR-497通过调节LATS2的表达抑制甘油三酯和不饱和脂肪酸的产生,以此调控细胞的脂肪代谢[6]。固醇调节元件结合蛋白1(Sterol regulatory element-binding protein 1,SREBP1)是人和动物乳脂肪合成的主要转录因子,它主要通过调控参与乳脂肪合成的多种酶和转运蛋白的表达影响细胞中甘油三脂的合成和分泌[21]。有研究表明,miR-138-5p能抑制SREBP1的表达和稳定性,从而抑制细胞脂质代谢[22]。Lu等[23]研究发现,在奶牛乳腺上皮细胞中miR-212可调节脂肪酸合成酶(FASN)和SREBP1的表达,促进乳腺上皮细胞中脂肪的生成。本实验的研究结果发现miR-9-5p可以显著抑制细胞的增殖,降低SREBP1蛋白的表达量,并且显著降低奶牛乳腺上皮细胞中甘油三酯的表达。近几年许多研究表明SREBP1的合成与多个信号通路相关[24-26]。因此,miR-9-5p如何通过影响细胞增殖和SREBP1的表达影响奶牛乳腺上皮细胞乳脂合成的具体机制还有待进一步研究。
4 结论
miR-9-5p能够抑制奶牛乳腺上皮细胞的增殖,降低乳脂合成调控蛋白SREBP1的表达,同时抑制甘油三酯的合成,表明miR-9-5p对奶牛乳腺上皮细胞的乳脂合成具有抑制作用,并且可能通过影响细胞增殖和下调SREBP1的表达发挥作用。

