镉和模拟酸雨胁迫对桑幼苗根系特性的影响
周燕,吕惠飞,高海力,鲍跃群,王金忠
(1.建德市林业总场,浙江 建德 311600;2.浙江省公益林和国有林场管理总站,浙江 杭州 310016)
现代化发展中的废弃物排放、农药和化肥的施用、矿物开采,以及大气沉降等使得土壤镉(Cd)污染成为了全球性的环境问题[1-2]。植物修复技术因具有绿色环保、费用经济等优点,一直以来是土壤重金属污染修复的重要手段[3]。过去,相关研究主要集中在对重金属吸收和转运能力非常强的草本植物,如景天属Sedum植物[4]。近十几年来,快速生长的木本植物因为成活率高、抗逆性强等优点受到越来越多的关注,与草本植物相比,速生木本植物的重金属吸收和积累能力虽然相对较低,但是其巨大的地上生物量积累可以大大提高重金属的总积累量,例如目前已知的柳树Salixsp.和杨树Populussp.等[5-6]。另一方面,植物在自然环境中往往受到多种生态因子的综合作用,例如酸雨(acid rain,AR)沉降等。我国是继欧洲、北美之后的第三大酸雨区。虽然近年来我国酸沉降逐年减轻,但酸雨前体物质(SO2、NOx)的排放仍在增加,酸雨的防治问题任重道远[7]。
桑Morus al ba是我国的传统植物,为桑科Moraceae 桑属Morus落叶乔木或灌木,因为具有较强的适应能力和经济价值,在我国东北至西南,西北至新疆均有栽培。桑生长快速,抗逆性强,近年来在防沙治沙、水土保持、盐碱地治理、土壤重金属修复等方面的功能都在被逐渐发掘。前人研究表明,桑对土壤Cd 胁迫具有很强的耐受性,当土壤Cd 浓度低于37 mg·kg-1时,植株生长几乎不受影响;当土壤Cd 浓度达到145 mg·kg-1时,植株才会死亡[8]。陈露等研究发现低浓度Cd 溶液(5 mg·kg-1)甚至可以促进桑幼苗总生物量积累,而且不同桑品种对Cd 的耐受性差异较大[9]。胡月等发现pH3.5 的酸雨抑制了桑的光合作用,但是pH4.5 以上的模拟酸雨对桑的光合作用具有明显的促进作用[10]。而臧畅、毛晓瑜等分别研究了酸雨和Cd 对桑的复合影响,发现酸雨会降低桑对Cd 的耐受性[11-12]。可见酸雨和Cd 对桑生长的影响已受到一定关注,但是研究焦点主要集中在地上部分,对根系的探索较少,因此,本研究通过盆栽受控试验,比较在Cd 污染环境中生长的桑幼苗根系指标在模拟酸雨处理下的变化特征,揭示酸沉降背景下桑对Cd 的响应特性及机理。
1 材料与方法
1.1 试验地概况
试验在浙江省杭州市临安区(119°44′ E,30°16′ N)开展,该区域气候类型为亚热带季风气候,区域年平均气温为16.6℃,其中,月均最高温度为29.1℃,月均最低温度为4.1℃;年均降水日约为158 d,年均降水量为1 628.6 mm,年均蒸发量为1 450 mm,年均无霜期约为237 d,年均日照总时长为1 825.7 h,土壤为红黄壤[13]。
1.2 试验材料与试验设计
试验材料为我国南方地区栽培较广的‘农桑14 号’,该品种具有适应性广,抗逆性强的特点。2019 年春季,选取大小、长短均一的健康枝条进行扦插培养。待生根后移栽至直径为30 cm、高为40 cm 的塑料花盆中(每盆1 株),花盆中装有土壤质量约为5 kg,放置于温室大棚内,常规管理。土壤为当地红黄壤,养分和Cd背景值分别为:土壤pH 5.43、速效K 含量65.0 mg·kg-1、速效N 含量67.3 mg·kg-1、速效P 含量 2.091 mg·kg-1、Cd 含量0.009 mg·kg-1。缓苗60 d 后,挑选长势基本一致的植株81 株,随机分成9 组,每组9 株,用于试验。
设置Cd 和AR 的2 因素和3 梯度水平交互试验,共计9 个处理。Cd 处理浓度分别为:0(A1)、25(A2)、50(A3)mg·kg-1,AR 处理梯度分别为pH7.0(B1)、pH4.5(B2)、pH3.0(B3),试验处理具体设置见表1,其中0 mg·kg-1Cd 和pH7.0 的组合(A1B1)为对照(CK)。试验初期先进行模拟Cd 污染土壤处理,将CdCl2·2.5H2O 分别配制成Cd 浓度为35.7 和71.4 mg·L-1的溶液,每2 d 向花盆土壤中均匀喷洒(每盆500 mL,反复回浇至不再流出,以确保Cd 与土壤充分混合均匀),一共添加7 次,稳定15 d后测定土壤中的Cd含量分别达到了25和50 mg·kg-1。而后进行模拟酸沉降(酸雨)处理,根据我国南方地区目前的平均离子组成,使用浓H2SO4(浓度为98%,密度为1.84 g·mL-1)与浓HNO3(浓度为68%,密度为1.4 g·mL-1)以1∶3 的体积比配制母液[14]。用蒸馏水将母液分别稀释为pH4.5 和pH3.0 的模拟酸沉降溶液,喷洒量根据当地各月平均降水量,折算后为每周2 次,每次300 mL,无酸雨处理喷淋等量蒸馏水(pH7.0),直至试验结束。试验时间为2019 年6 月1 日至9 月30 日。

表1 试验处理设置Table 1 Test design
1.3 测定方法
株高、地径和根系生物量测定:测定试验前后的株高和地径,并根据测定值分别计算株高增长量和地径增长量。试验完成后,将试验桑整株取回,用蒸馏水洗净后将根部取下,于105℃烘箱中杀青5 min 后,置于60℃下烘干至恒质量,称取根干质量。
植株表型测定:使用根系扫描仪(LA2400,Seiko Epson Corp,Japan)扫描根系图像,图像分辨率为800 dpi,存储格式为TIFF;并使用WinRHIZO 软件(Version 2012a,Regent Instruments,Canada)计算总根长、总根表面积、总根体积、根尖数等指标。
根系Cd、Fe 和Mg 元素含量和活力测定:将桑幼苗根系样品粉碎过100 目筛,称取0.20 g 粉末置于三角烧瓶中,加入2 mL 蒸馏水和5 mL HNO3(浓度为68%)并混匀,浸泡过夜后加入1 mL H2O2(浓度为30%),放入微波消解仪(CEM-MARS 6,CEM,USA),在1 200 W 功率下消解15 min,而后用蒸馏水定容至50 mL,使用电感耦合等离子体质谱仪(XSERIES 2 ICP-MS,Thermo Fisher,USA)测定植株各器官Cd、Fe 和Mg 元素含量[15]。根系活力采用TTC 法测定[14]。
1.4 数据处理
采用SPSS 19.0 软件对数据进行统计分析,各处理间的差异使用单因素方差分析(One-way ANOVA),Cd和AR 对生物量、根系表型等的交互影响采用双因素方差分析(Two-way ANOVA),显著性采用Student’s 检验(P<0.05),并用Excel 2010 软件作图。
2 结果与分析
2.1 Cd 和AR 对桑幼苗株高和地径生长的影响
由图1 可知,A1B2处理和A1B3处理的桑株高增长量均显著低于CK(A1B1)的,可见AR 处理显著抑制了桑的株高生长。A2B1处理的桑株高增长量与CK 的相比没有显著差异,而A3B1处理的桑株高增长量显著低于CK 的,可见低浓度Cd(25 mg·kg-1)对桑株高生长的影响不大,但是高浓度Cd(50 mg·kg-1)显著抑制了桑株高生长。A2B2处理和A2B3处理的桑株高增长量显著低于A2B1,A3B2和A3B3处理的桑株高增长量显著低于A3B1处理的,结合表3 可知,AR 加强了Cd 对桑株高生长的抑制。

图1 不同处理对桑株高和地径增长量的影响Figure 1 Growth of height and ground diameter of seedlings under different treatments
由图1 可知,Cd 和AR 处理对桑幼苗地径生长的影响与对株高生长的影响不完全一致,A1B2、A1B3处理对桑地径生长并没有显著影响,说明AR 对桑地径生长几乎没有影响。与CK 相比,A2B1处理的桑地径增长量变化不显著,A3B1处理的桑地径增长量显著减低,说明低浓度Cd(25 mg·kg-1)对桑地径生长的影响不大,但是高浓度Cd(50 mg·kg-1)显著抑制了桑地径生长。A2B2处理的桑地径增长量与A2B1处理的相比,A3B2处理的桑地径增长量与A3B1处理的相比,均无显著差异;但A2B3处理的桑地径增长量显著低于A2B1处理的,且A3B2处理的桑地径增长量显著低于A3B1处理的。以上分析结果表明,重度AR(pH3.0)显著加剧了Cd 对桑地径生长的抑制,但是轻度AR(pH4.5)作用不明显。
2.2 Cd 和AR 对桑幼苗根系生物量积累的影响
由表2 可知,Cd 处理显著抑制了桑幼苗根生物量的积累,且抑制程度随着Cd 浓度的增加而升高。A2B1和A3B1处理的桑根系生物量积累仅分别为CK 的77%和55%。与CK 相比,轻度AR 对桑根系生物量积累的影响不显著,但是重度AR 显著降低了桑根系生物量积累。Cd 和AR 对桑根系生物量积累的交互作用显著,与单独Cd 处理相比,轻度和重度AR 均显著降低了桑根系生物量积累(表3)。

表2 不同处理对桑根系表型、生物量积累和活力的影响Table 2 Root phenotype,biomass accumulation and vigor of seedlings under different treatments
2.3 Cd 和AR 对桑幼苗根系表型和活力的影响
由表2 可知,Cd 处理显著降低了桑幼苗根系表型参数,其影响程度随着Cd 浓度的增加而升高。其中,A2B1处理的桑的总根长、总根表面积、总根体积和根尖数分别比CK 的降低了20%左右,A3B1处理的这些指标分别比CK 的降低了46%~ 68%。轻度AR 对桑幼苗根系表型参数的影响不显著,重度AR 显著降低了根系表型参数。A2B2处理的总根长、总根表面积、总根体积和根尖数显著低于A2B1处理的,与A2B3处理的结果类似;A3B2处理的这些指标分别比A3B1处理降低了约20%,A3B3处理比A3B1处理降低了约30%,Cd 和AR 对根系表型影响的交互作用显著(表2,表3)。
由表2 可知,Cd 处理显著抑制了桑幼苗根系活力,且抑制程度随着Cd 浓度的增加而升高。A2B1和A3B1处理的根系活力分别为CK 的71%和58%。A1B2处理显著提高了桑幼苗的根系活力,比CK 的增加了23%,但是A1B3处理的提高作用不显著。Cd 和AR 对桑根系活力影响的交互作用显著(表3)。A2B2和A2B3处理的根系活力比A2B1处理的分别降低了22%和28%;A3B2和A3B3处理的根系活力比A3B1处理的分别降低了14%和22%(表2)。

表3 AR 和Cd 污染对桑各指标的交互作用Table 3 Interaction of acid rain and Cd contamination on tested indicators
2.4 Cd 和AR 对桑幼苗根系元素含量的影响
由图2 可知,桑幼苗根系Cd 含量随着Cd 处理浓度的增加而增加,而且AR 处理显著促进了根系对Cd 的吸收。A2B1和A3B1处理的根系Cd 含量分别为56.70 和170.09 mg·kg-1;A2B2和A2B3处理的根系Cd 含量分别比A2B1处理的增加了44%和50%;A3B2和A3B3处理的根系Cd 含量分别比A3B1处理的增加了13%和24%。
Cd 处理显著降低了桑幼苗根系Fe 和Mg 的含量(图2)。A2B1处理的根系Fe 和Mg 含量分别比CK 的降低了20%和9%,A3B1处理的根系Fe 和Mg 含量分别比CK 的降低了44%和48%。A1B3处理亦显著降低了根系的Fe 和Mg 含量,而A1B2处理对根系Fe 和Mg 含量的影响不显著。Cd 和AR 对根系Fe 和Mg 含量影响的交互作用显著(表3)。与A2B1处理相比,A2B2处理的根系Fe 含量,A2B3处理的根系Fe、Mg 含量显著下降;和A3B1相比,A3B2处理的根系Fe 含量,A3B3处理的根系Fe、Mg 含量显著下降。
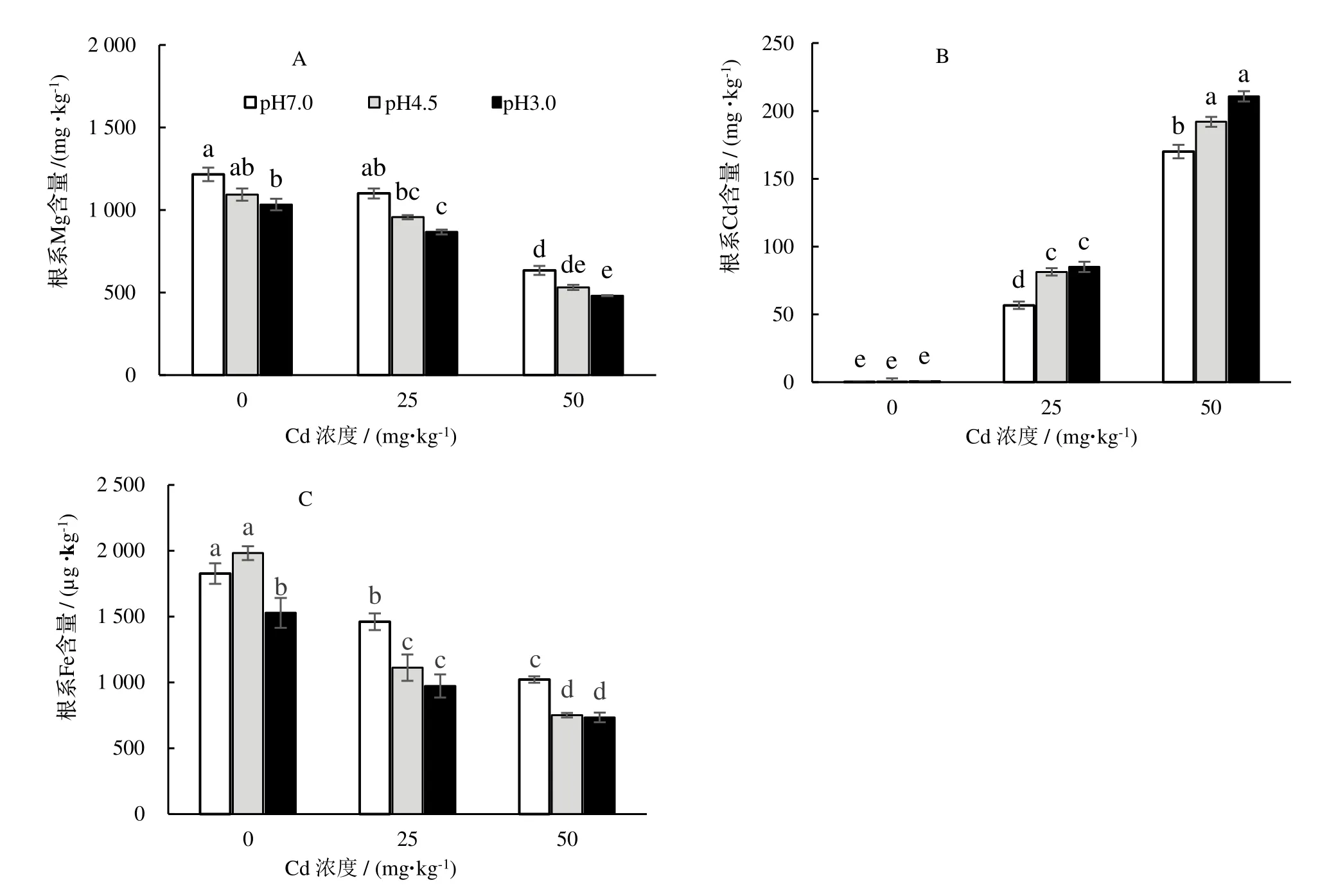
图2 不同处理对桑根系Cd、Fe 和Mg 含量的影响Figure 2 Cd,Fe and Mg contents in seedlings root under different treatments
3 讨论与结论
Cd 是植物生长的非必需元素,土壤中Cd 过高会导致根系变短变粗、根系活力下降,影响水分和养分吸收[16]。本研究中,Cd 处理显著改变了桑幼苗的根系表型特性、降低了根生物量和根系活力,这与前人的研究结果一致,可见两种浓度的Cd 均显著抑制了桑根系的生长,而且随着Cd 浓度的增加,抑制程度显著增加。但是在低浓度Cd 处理下,桑幼苗地上部分生长与CK 的差异不显著;而在高浓度Cd 处理下,桑幼苗地上部分生长显著低于CK 的,说明桑幼苗对25 mg·kg-1的Cd 浓度有一定的耐受性,而50 mg·kg-1的Cd 浓度已经对地上部分生长产生了胁迫。同时,Cd 处理还显著降低了桑根系对Fe 和Mg 元素的吸收,且根系Cd 含量越高,这两种元素的含量越低。这是因为Cd 占据了Fe 等元素的转运蛋白和通道,使得这些元素无法进入植物体[17]。这与卢倩云等发现的油菜Brassica napus毛状根中Cd 含量超出一定范围后,Fe 含量降低的结论一致[18]。
酸沉降主要通过两方面干扰植物正常生长,一是AR 中含有的H+和N、S 化合物会紊乱植物体的氮代谢平衡,干扰叶绿素的合成和分解,同时导致植物体内活性氧的过量积累,从而降低光合能力[19]。二是AR 会导致植物根系质膜受损,影响养分元素的吸收和转运,造成植物体内养分失衡,并且AR 还会增加土壤活性铝离子的溶出量,对植物产生铝毒[20]。根据本研究中桑幼苗的地径生长状况、根系表型和活性、根系Fe 和Mg 含量变化等可知轻度AR 对桑幼苗生长的影响不大,即桑对pH>4.5 的AR 有一定的耐受性,但是重度AR 对桑幼苗生长有一定的抑制作用,可能是因为根系活力受抑制,养分吸收受到干扰。
前人研究表明AR 与Cd 对植物生长的影响具有协同作用[11-12]。这是因为一方面酸沉降自身对植物生长具有伤害作用,另一方面是酸沉降会促进植物对Cd 的吸收。本研究发现低浓度Cd 和轻度AR 的交互作用显著,即AR 导致25 mg·kg-1Cd 处理对桑幼苗产生了明显的胁迫,具体表现为两者复合处理的桑地上部和根系指标均显著低于CK,而且随着Cd 浓度的增加,抑制程度升高。这与AR 与Cd 复合处理对楝Melia az edarach、玉蜀黍Zea mays的影响类似[21-22],即酸沉降会加剧Cd 污染对这些植物的胁迫。
酸沉降会促进植物对Cd 的吸收、积累和转运,这是因为根际对Cd 的吸收能力主要取决于土壤中的Cd 交换容量(CEC)和Cd2+的电化学电位,AR 中的H+、N 能显著提高这两个指标,从而向土壤中释放足够的生物有效态Cd[23]。本研究中,轻度AR 使得桑根系的Cd 含量显著高于单独Cd 处理,说明酸沉降很有可能通过增加土壤有效Cd 加剧了对桑的胁迫。这与AR 导致镧对大豆Glycine m ax根系生长产生抑制、AR 导致锌对杨树Populussp.根系生长产生危害有类似的机理[24-25]。另一方面,Cd 跨膜运输进入细胞需要转运蛋白和通道蛋白的参与,在无Cd 环境中这些蛋白主要用于运输Ca2+、Zn2+、Fe2+等二价阳离子。Cd 因为与这些离子具有相似的特性,通过竞争与转运蛋白和通道蛋白结合后亦可进入植物细胞,而AR 中的N 可以诱导更多转运蛋白的产生,促进了Cd 从植物细胞壁向细胞、根系向地上部分的转移[26]。本研究发现AR 不仅提高了根系的Cd 含量,而且降低了根系中的Fe 和Mg 含量。一方面,AR 可以直接影响植物对养分的吸收,另一方面,AR 引起的根系Cd含量增加间接影响了植物对养分的吸收,因为Cd 占据了Fe 等元素的转运蛋白和通道[17]。
综上可知,桑对轻度AR 和低浓度Cd 有一定的耐受性,但是酸沉降会加强Cd 对桑根系的胁迫,因此在酸沉降区域采用桑进行土壤Cd 污染修复时,需要考虑AR 的协同作用,综合分析复杂环境对桑耐受性和修复效率的影响。

