海马缝隙连接蛋白43与卒中后抑郁的关系研究
陈金梅,王喻,王洁,黄晓华,冯云, 罗雪莲,王功俊,包成政,李雪斌
(1. 右江民族医学院研究生学院,广西 百色 533000;2. 右江民族医学院附属医院神经内科,广西 百色 533000;3. 右江民族医学院附属医院肾内科,广西 百色 533000)
脑卒中是全球第三大死因,每年有590万例死亡,预计到2030年将增加到2300万例患者,其中预计1200万例患者会死亡,7000万例会成为脑卒中幸存者。大约1/3的幸存者患有卒中后抑郁(post-stroke depression,PSD),累积发生率为55%[1]。 PSD是指在脑血管意外后发生的以持续性的情绪低落、睡眠紊乱、思维困顿、有自杀倾向等为主要表现的情感认知障碍[2]。PSD是脑卒中后的严重神经精神病学后果,可降低患者的生活质量和提高死亡率[3]。尽管抑郁症与脑卒中有很强的关联,但确切的机制仍然不明确。PSD是一种经过充分研究的身心疾病,在相关的危险因素、诊断和患病率,认知恢复、身体恢复以及预防和治疗方面已经取得了很大进展[4]。然而对PSD的病理生理了解甚少。缝隙连接是由连接蛋白的亚基在相邻细胞之间形成组成的管道,并允许直接的细胞间通讯,分子量高达1000 Da的各种化合物可以通过缝隙连接管道的被动扩散进行交换,即代谢产物、离子、第二信使、水和电脉冲[5]。神经系统中合成的缝隙连接蛋白种类繁多,海马组织缝隙连接蛋白43(Cx43)被普遍认为是在星形胶质细胞中表达[6]。越来越多证据证明星形胶质细胞的缝隙连接受损可能与精神疾病有关,在抑郁症自杀患者的新皮层、小脑皮层、内侧丘脑和尾状核中发现星形胶质细胞Cx30和Cx43明显降低[7]。本课题组前期研究发现,在PSD组大鼠海马组织Cx43的表达较正常组下调[8]。缝隙连接功能的改变可能会导致相关的抑郁症状,但目前尚不清楚缝隙连接受损是否会导致PSD的抑郁症状。本文的目的阐明PSD的抑郁症状与海马Cx43的关系。本研究分别选择应用缝隙连接阻断剂(CBX)和激动剂(ATRA)干预PSD大鼠模型后观察抑郁症状的改变情况,以进一步验证PSD的抑郁症状与海马Cx43的相关性。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 SPF级SD健康大鼠42只,雄性,6~8周龄,体重(275±25) g。大鼠购自湖南长沙市天勤生物技术有限公司,许可证号为SCXK(湘)2019-0014,实验过程严格按照《中国实验动物使用和管理办法》执行。
1.1.2 主要试剂和仪器 内皮素-1(美国sigma公司);兔抗Cx43多克隆抗体和鼠抗GAPDH单克隆抗体(中国武汉protein公司);山羊抗小鼠二抗(美国ThermoFisher公司);山羊抗兔二抗(美国ThermoFisher公司);Alexa Fluor488标记的IgG及DAPI试剂(美国ThermoFisher公司);冰冻切片机(德国LEICA公司);荧光倒置显微镜(德国LEICA公司);脑立体定位仪(中国安徽正华公司);微量注射泵和颅骨钻(中国安徽正华公司)。
1.2 方法
1.2.1 动物分组和脑卒中后抑郁动物模型的建立 42只大鼠随机均分为正常组、卒中组、抑郁组、PSD组、生理盐水组、CBX组和ATRA组。正常组6只:采用脑立体定位仪定位(AP:0.0,ML:+2.5,DV:-2.1)和(AP:+2.3,ML:+2.5,DV:-1.9),微量注射内皮素-1制备脑缺缺血性卒中型[9];抑郁组6只:采用慢性不可预见的温和应激刺激(CUMS)结合孤养法制备抑郁模型。应激方法包括:①足底电击3 min;②持续光照21 h;③夹尾1 min;④40 ℃热水游泳10 min;⑤倾斜17 h;⑥束缚2 h;⑦湿笼24 h;⑧禁水禁食24 h。孤养方法为每只老鼠单独1笼[10];PSD大鼠24只:建立脑缺血模型术后1周,加以CUMS和孤养法制备PSD模型。在PSD组术后14 d,将大鼠随机分为PSD组、生理盐水组、ATRA组、CBX组,每组6只。PSD组继续进行PSD造模,不做其他干预。其余3组在继续PSD造模的同时予以以下干预:生理盐水组每日予生理盐水1 ml腹腔内注射;ATRA干预组,用乙醇和磷酸盐缓冲液按1∶9配制后,加入ATRA浓度为(1 mg/ml),每天1 ml腹腔内注射;CBX干预组,每日予CBX,20 mg/kg的标准腹腔注射,连续给药14 d。
1.2.2 行为学方法
1.2.2.1 体重 分别称量大鼠术后7 d、28 d的体重。
1.2.2.2 旷场实验 采用周壁、底面均为黑色的立柱体旷场箱,底面划分为面积相等的25块,实验开始时将大鼠放置于旷场箱底面的中心。在光线昏暗、安静的环境下进行测试,用SMART2.5实时视频图像跟踪系统分析记录大鼠在5 min的总距离。
1.2.3 取样及样品分析 所有行为学测试完成后,次日麻醉大鼠后,断头取大脑海马组织,3只大鼠应用Real time PCR和Western blot检测大鼠海马CX43 mRNA及其蛋白表达,另外3只大鼠进行冰冻切片,应用免疫荧光染色检测CX43蛋白的表达。
1.2.4 实验方法
1.2.4.1 Real time PCR分离大鼠海马组织,置于冻存管中,液氮急速冷冻,于研钵中磨碎海马组织,用TRIZOL试剂盒提取海马总RNA,采用紫外分光光度仪对其浓度、纯度进行检测,使用cDNA逆转录试剂盒将RNA逆转录成cDNA,采用SYBR GREEN I 实时荧光定量PCR试剂盒上机扩增检测,qRT-PCR 反应条件参照说明书,采用2-△△Ct法计算Cx43的相对表达量。每组重复3遍。引物设计如下:Cx43上游5′-CCACTCTCACCTATGTCTCCTCCTG-3′,Cx43下游5′-CTCGCTGGCTTGCTTGTTGTAATTG-3′,GAPDH上游5′-GACATGCCGCCTGGAGAAAC-3′,GAPDH下游5′-AGCCCAGGATGCCCTTTAG-T-3′,由上海生工合成引物。
1.2.4.2 Western blot 分离大鼠海马组织,置于冻存管中,液氮急速冷冻,于研钵中磨碎海马组织,蛋白提取试剂盒提取总蛋白,BCA法测定蛋白浓度,依次进行10%SDS-PACE电泳分离蛋白,转印至PVDF膜上,快速封闭液封闭,一抗孵育过夜,TBST洗膜3遍,加入二抗,室温孵育2 h,ECL法发光显影,保存图片,Image J软件分析数据。
1.2.4.3 免疫荧光染色 将带海马的脑组织进行冰冻切片,10%正常山羊血清的PBS室温封片1 h,加入一抗,4 ℃孵育过夜,PBS洗3遍,加入带荧光的二抗室温避光孵育1 h后,封片后使用荧光显微镜观察结果,Image J软件分析数据。

2 结果
2.1 7组大鼠体重情况比较 术后7 d,与正常组相比,卒中组、PSD组、生理盐水组、CBX组和ATRA组体重降低(P<0.05)。术后28 d,与正常组相比,抑郁组和PSD组体重降低(P<0.05);与PSD组相比,生理盐水组和抑郁组体重差异无统计学意义(P>0.05),CBX组体重降低(P<0.05)和ATRA组体重升高(P<0.05),ATRA组低于正常组(P<0.05)。见表1。
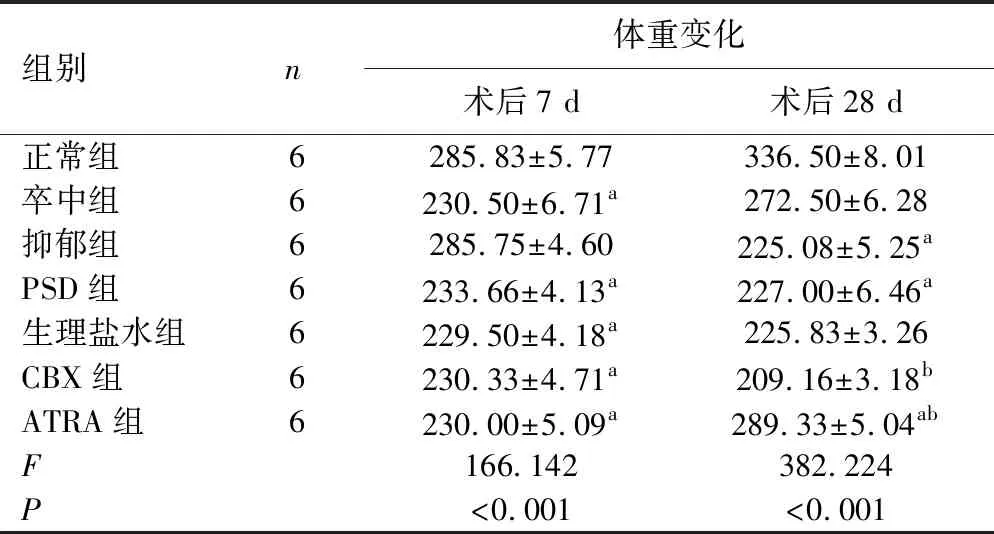
表1 各组大鼠不同时间体重变化情况 单位:g
2.2 7组大鼠运动行为改变 见表2。大鼠旷场实验结果显示,术后7 d,与正常组相比,卒中组、PSD组、生理盐水组、CBX组和ATRA组穿越总距离降低(P<0.05)。术后28 d,与正常组相比,抑郁组和PSD组穿越总距离降低(P<0.05);与PSD组相比,生理盐水组和抑郁组穿越总距离差异无统计学意义(P>0.05),CBX组穿越总距离降低(P<0.05)和ATRA组穿越总距离升高(P<0.05),ATRA组低于正常组(P<0.05)。

表2 各组大鼠不同时间旷场实验穿越总距离 单位:cm
2.3 各组Cx43 mRNA表达水平比较结果 抑郁组和PSD组大鼠海马Cx43 mRNA表达水平明显低于正常组(P<0.05);与PSD组相比,生理盐水组和抑郁组大鼠海马Cx43 mRNA表达差异无统计学意义(P>0.05),CBX组大鼠海马Cx43 mRNA表达降低(P<0.05),ATRA组大鼠海马Cx43 mRNA表达升高(P<0.05),仍低于正常组(P<0.05)。见图1。
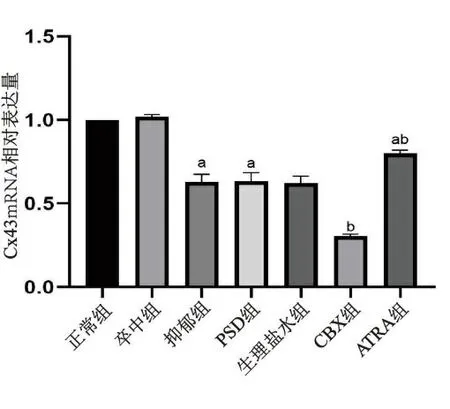
注:与正常组相比,a:P<0.05,与PSD组相比,b:P<0.05。
2.4 各组Cx43蛋白表达比较结果 与正常组相比,抑郁组和PSD组大鼠海马Cx43蛋白表达明显降低(P<0.05);与PSD组相比,生理盐水组和抑郁组大鼠海马Cx43蛋白表达差异无统计学意义(P>0.05),CBX组大鼠海马Cx43蛋白表达降低(P<0.05),ATRA组大鼠海马Cx43蛋白表达升高(P<0.05),仍低于正常组(组间F=82.540,P<0.001),见图2。
2.5 免疫荧光染色结果 与正常组相比,抑郁组和PSD组大鼠海马组织中Cx43蛋白表达降低(P<0.05);与PSD组和生理盐水组相比,CBX组大鼠Cx43蛋白表达降低(P<0.05),ATRA组大鼠的Cx43蛋白表达升高(P<0.05),但仍低于正常组(P<0.05)。见表3。

注:与正常组相比,a:P<0.05,与PSD组相比,b:P<0.05。
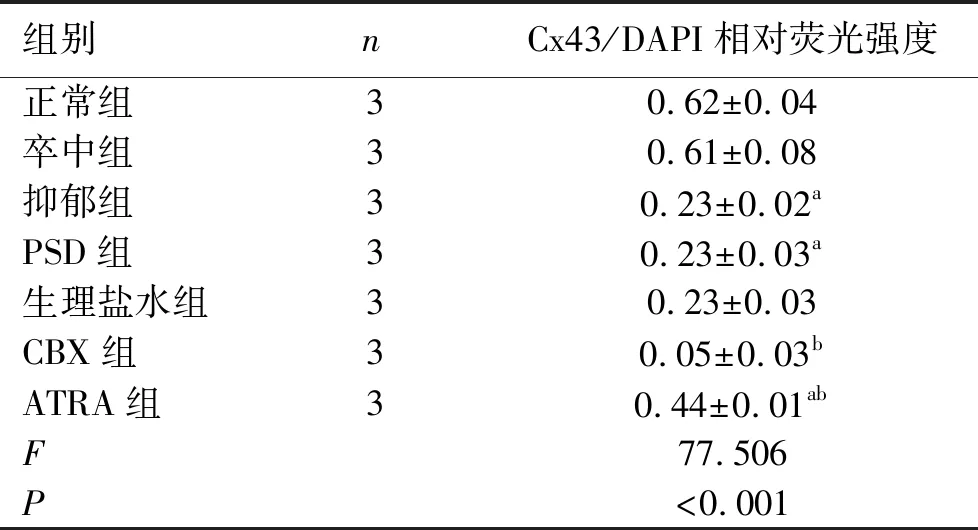
表3 各组大鼠海马Cx43荧光强度比较
3 讨论
抑郁症是缺血性卒中最常见的精神疾病,通常持续存在,即使长时间缓解也有很高的复发风险[11]。研究表明中风发作后第一年的PSD的发病率和死亡率增加,PSD患者具有更多的功能障碍和较差的康复结果[12]。与单纯抑郁症不同,PSD是在血管损伤的基础上发生的抑郁症,并且具有更严重的抑郁症状、更多的认知功能障碍,但是睡眠障碍相对较轻[13]。本研究采用脑立体定位仪微量注射内皮素-1,引起大鼠大脑皮层与纹状体缓慢缺血造成脑卒中模型,术后7 d采用慢性不可预见温和应激结合孤养建立PSD模型。术后28 d,PSD组体重和旷场实验中的穿越总距离明显降低,差异有统计学意义,提示建模成功。
越来越多证据证明,Cx43的表达水平变化与抑郁症的发生发展相关,一项使用抑郁症动物模型的研究表明,抑郁小鼠的内侧前额叶皮层和海马中星形胶质细胞Cx43和Cx30蛋白表达下调,此时神经元的活性也受到抑制。小鼠还表现出行为缺陷、快感缺乏,在同一研究中敲低抑郁小鼠内侧前额叶皮层和海马的星形胶质细胞的Cx43和Cx30表达后,神经元的活性进一步降低,在不减少星形胶质细胞数量的情况下进一步诱导快感缺乏症[14]。本实验结果PSD组和抑郁组大鼠一样,海马Cx43 mRNA、蛋白和荧光强度表达下调,并且出现抑郁症的核心症状,即快感缺乏及行为绝望。在旷场实验中的穿越总距离也明显降低以及体重明显下降,提示海马Cx43下降可能会诱导抑郁症和PSD的发生和发展。有研究发现血栓性梗塞大鼠模型海马组织中Cx43表达变化,缺血性损伤后第1天,同侧海马组织中表达Cx43 mRNA的星形胶质细胞减少了50%,到3~14 d,在海马CA1层中表达Cx43 mRNA的细胞数目显著增加,但是第30~120天,与正常组相比,海马中却未检测到表达Cx43 mRNA的细胞数量有相对的表达差异[15]。有研究者发现大脑中动脉闭塞术(MCAO)后大鼠模型,缺血后灌注后6 h大脑皮层、海马、纹状体Cx43蛋白表达升高,在1 d内达到峰值,然后逐渐下降,但在7 d仍高于假手术组[15-16]。本实验结果提示卒中组大鼠海马Cx43 mRNA、蛋白、荧光强度却和正常组差异无统计学意义,但在旷场实验中发现卒中组大鼠的穿格次数和穿越总距离减少,我们猜测这种变化可能是因为大鼠术后肢体瘫痪所导致的。抑郁组和PSD组大鼠海马Cx43 mRNA、蛋白、荧光强度差异无统计学意义,我们推测Cx43蛋白表达与抑郁症和PSD的抑郁行为有密切的关系,且PSD的抑郁行为可能由Cx43下降引起。
本实验进一步采用CBX和ATRA干预PSD大鼠发现,CBX组大鼠1 h糖水消耗率、体重和旷场实验中的穿格次数和穿越总距离进一步降低,快感缺乏及行为绝望更加明显,大鼠海马Cx43 mRNA、Cx43蛋白和荧光强度也进一步降低。然而,给予ATRA干预的PSD大鼠,快感缺失和行为绝望得到改善,大鼠海马Cx43 mRNA、Cx43蛋白和荧光强度升高,进一步验证海马缝隙连接Cx43的表达变化与PSD的抑郁行为的相关性,提示提高海马Cx43的表达可以在一定程度上改善PSD大鼠兴趣下降的表现,并能对抗PSD大鼠的绝望和无助行为。
综上所述,海马Cx43在PSD模型中表达水平降低,ATRA上调Cx43的表达后,大鼠的快感缺乏及行为绝望症状得到改善,然而CBX下调Cx43的表达后,大鼠的快感缺乏及行为绝望症状进一步加重。海马组织Cx43的表达参与PSD抑郁行为的发生发展,有可能成为PSD治疗的新靶点。

