新型铁素体耐热钢抗蒸汽氧化性能对比研究
马云海, 王延峰, 张作贵
(上海发电设备成套设计研究院有限责任公司,上海 200240)
笔者对G115钢和T92钢在650 ℃/27 MPa蒸汽参数下的氧化性能进行研究,验证和评价2种材料的抗蒸汽氧化性能,并探讨高温高压蒸汽条件下2种铁素体钢的氧化机理。
1 试验材料与试验方法
1.1 试验材料

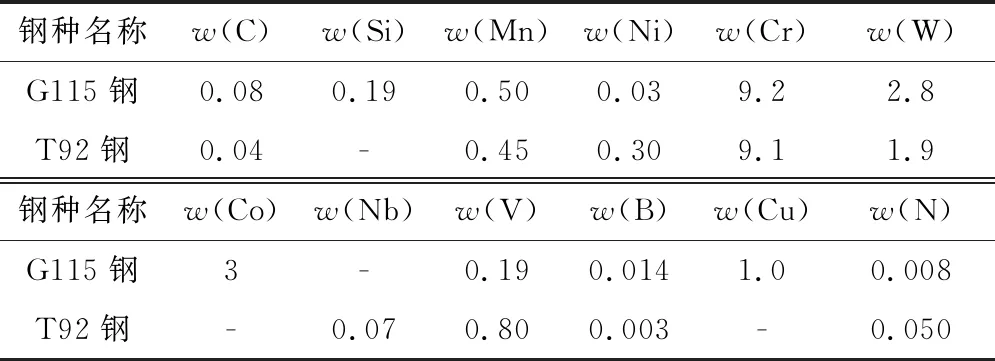
表1 试验材料的化学成分

(a) G115钢
1.2 试验方法

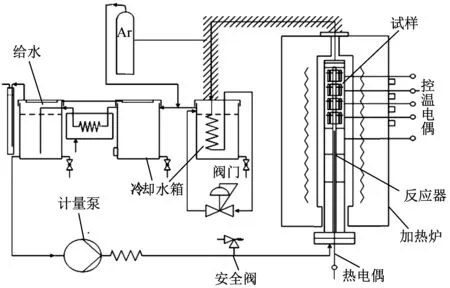
图2 系统装置示意图
采用增重法测量试样的腐蚀速率,并结合厚度法进行半定量评价。按照GB/T 38804—2020 《金属材料高温蒸汽氧化试验方法》中增重法测量方法,通过精密电子天平(精度为0.000 1 g)测量每个时间点试样氧化前后的质量,每个时间点设置2个平行试样。采用扫描电镜(SEM)测量试样横截面氧化层厚度,观察前试样对半切开,镶嵌后横截面研磨、抛光。氧化试样的表面和横截面形貌采用SEM观察,微区成分采用SEM附带能谱仪(EDS)分析,采用电子背散射衍射(EBSD)对氧化物相结构进行表征分析。
2 试验结果与试验分析
2.1 氧化动力学关系
G115钢和T92钢在650 ℃/27 MPa蒸汽参数下的氧化质量增重与氧化时间的关系见图3。由图3可知:氧化到1 300 h时,2种材料的氧化质量增重均随氧化时间的延长而增加,氧化到2 000 h时,氧化质量增重减小,原因是发生了氧化物的剥落。对1 300 h内的氧化质量增重数据与氧化时间进行拟合,得到拟合公式(1)。
F2=3.90×105+3.91×105+1.95×105+1.95×105+2.58×105+2.58×105=16.87×105N
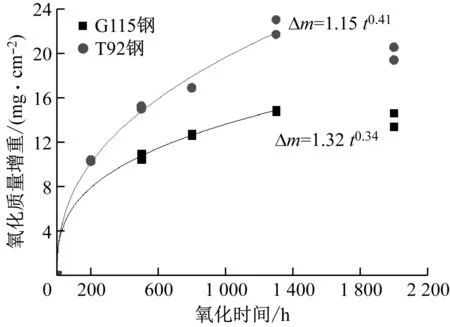
图3 氧化质量增重与时间的关系
Δm=kptn
(1)
kp=k0exp(-Q/RT)
(2)
式中:Δm为单位表面质量增重,mg/cm2;Q为激活能,kJ/mol;kp为与温度相关的氧化速率常数;k0为材料本身的氧化速率常数;t为氧化时间,h;R为热力学常数,8.314 J/(mol·K);T为蒸汽温度,K;n为时间指数。
通过拟合可知,G115钢和T92钢的时间指数分别为0.34和0.41,氧化速率常数kp分别为1.32和1.15。总体上,在1 300 h的氧化时间内,G115钢的氧化速率小于T92钢,这与时间指数n的变化规律基本一致。
2.2 氧化膜的形貌观察
G115钢和T92钢在650 ℃/27 MPa蒸汽参数下氧化1 300 h的氧化膜表面和横截面形貌见图4。由图4可知,氧化后表面都形成了多角状的氧化物颗粒,横截面氧化物可分为3个部分,从基体到氧化膜的方向依次为内氧化区、氧化膜内层和氧化膜外层;内氧化区为氧化的前沿,实际上内氧化区为氧化物和金属的混合区域[7,9-10],随着氧化的进行,内氧化区也会转变为氧化膜内层;2种铁素体钢形成的氧化膜内层均比较致密,与基体之间的黏附较好,未见明显的界面分离现象;对比氧化膜外层的形貌发现,G115钢氧化膜外层孔洞较少,较为致密,而T92钢的氧化膜外层疏松而多孔;氧化到1 300 h,G115钢氧化膜厚度约为110 μm,T92钢氧化膜厚度接近160 μm。

(a) G115钢氧化膜表面
2.3 氧化膜成分和结构
G115钢和T92钢在650 ℃/27 MPa蒸汽参数下氧化1 300 h的氧化膜横截面形貌及对应的元素线扫描结果见图5。由图5可知,2种材料氧化膜外层均为富Fe氧化物,氧化膜内层为富Cr、富Fe的氧化物,G115钢内氧化区Fe的含量要高于氧化膜内层,T92钢的这种趋势并不明显。通过离子减薄技术制备氧化膜横截面样品,采用EBSD进一步分析氧化膜的结构和物相,结果见图6和图7。由图6和图7可知,2种铁素体钢氧化膜外层均为粗大的柱状晶,物相为Fe3O4,而氧化膜内层晶粒细小,主要为尖晶石型氧化物,结合氧化膜EDS分析结果,可以确认氧化膜内层主要为Fe-Cr尖晶石和少量的Fe3O4,内氧化区的物相结构与氧化膜内层无明显差异,只是其含铁量更高,由FeO+Cr2O3组成[11],一般也将其归于氧化膜内层。

(a) G115钢

(a) 离子抛光后的氧化膜截面形貌

(a) 离子抛光后的氧化膜截面形貌
3 讨 论
3.1 蒸汽氧化机理探讨
G115钢和T92钢2种铁素体钢生成的氧化膜为典型的“双层结构”,外层为粗大的柱状Fe3O4,内层为细晶尖晶石。18O同位素研究表明外层的氧化物/气体界面和内层的金属/氧化物界面同时分别向外和向内生长[10],造成氧化膜内层和氧化膜外层具有相近的厚度,内外层界面对应原始金属表面。

图8(b)说明随着时间的延长,在氧化物基底上的内氧化Cr2O3粒子混合到氧化膜内层(并最终溶解形成Fe-Cr尖晶石),这对铁离子的扩散有阻碍作用。在氧化膜内层和外层界面,氧化膜外层持续分解,不断提供氧,但也导致孔洞的形成,如图4和图5所示。
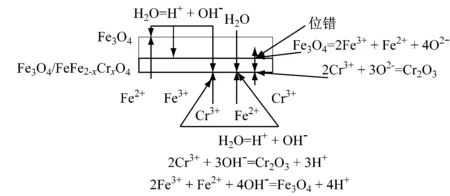
(a)
G115钢和T92钢在650 ℃/27 MPa蒸汽参数下的氧化过程可分为5个阶段[11],如图9所示。

图9 G115钢和T92钢的氧化过程示意图[11]
第一阶段:氧化膜快速生长。形成(Fe,Cr)2O3层或覆盖Fe2O3的富Cr的(Fe,Cr)3O4,这个阶段时间很短。
第二阶段:氧化膜厚度增加。保护层分解,Fe3O4快速生长,同时形成FeO+Cr2O3内层,Cr2O3沉淀粒子在 “FeO基体”中形成。氧化膜分别向外和向内生长,造成氧化膜内层和外层具有相近的厚度,氧化膜内层和外层界面对应原始金属表面,形成氧化膜的外层为Fe3O4、内层为(Fe,Cr)3O4为主的富Cr氧化物,此阶段涉及Cr的挥发。
第三阶段:氧化膜孔洞的形成。Cr与扩散进入的氧化性物质(H2O、OH-)反应,在氧化膜内层和氧化膜/基体界面处生成Cr2O3沉淀粒子,Cr2O3沉淀粒子也可与Fe固溶生成(Fe,Cr)3O4,生成的富Cr氧化物对Fe和Cr的扩散有一定的抑制作用,在氧化膜内层和外层界面,氧化膜外层持续分解,不断提供氧,但也导致孔洞形成。
第四阶段:氧化膜长时生长。此过程取决于物质输运方式,即参与反应物质的扩散方式和扩散速率。
第五阶段:Fe2O3的形成阶段。随着氧化膜增厚以及间隙的存在,铁离子向外扩散困难,氧化膜/气体界面上Fe的活度下降,导致形成Fe2O3。这个阶段,因G115钢和T92钢的氧化物/金属界面Cr含量足够高,形成了连续或半连续的Cr2O3氧化层[14](见图6和图7),这将会进一步阻止铁离子的扩散,导致外层Fe3O4加速向Fe2O3转变,这也是造成氧化膜外层剥落的一个原因。
3.2 氧化膜中孔洞的形成机制
随着氧化时间的增加,G115钢和T92钢氧化膜外层中的孔洞数目增加(见图10),孔洞数目的增加会影响氧化膜的保护性,氧化膜中孔洞的形成涉及力学机制,Kofstad[12]提出氧化膜中形成的孔洞和微通道是由于氧化物塑性变形和晶粒生长共同作用产生的。如果氧化物生长是通过金属离子向外扩散在氧化物/气体界面形成新的氧化物而发生的,则会在氧化膜中产生平行表面的压应力和垂直表面的拉应力。如果氧化物生长是通过氧化膜中氧和金属离子的互扩散形成的,则在氧化膜中产生大的压应力,总之氧化物的生长将在氧化膜中产生压应力。在此应力作用下,氧化膜将发生扩散蠕变和晶界滑动,蠕变的发生导致晶界上产生微孔洞。同时,氧化膜中还伴随着氧化物晶粒长大,变形和晶粒长大均是扩散控制,晶粒生长越快的区域变形也越大。晶界上少量的杂质集聚会在很大程度上影响氧化层变形以及力学和输运性质。

(a) G115钢
界面机制[13]和扩散机制也是影响氧化膜中孔洞形成的重要因素。Maruyama等[14]通过对氧化层中金属和氧元素化学势分面和离子通量的理论计算,认为氧化时氧化层中形成孔洞的条件是离子通量发散,氧化物中的金属和氧离子从氧化物/金属界面到氧化物/气体界面的化学势发生变化,氧离子和金属离子穿过氧化层的扩散由化学势梯度驱动,在稳态氧化阶段,氧化动力学过程遵循抛物线生长规律,穿过氧化层的离子通量恒定。当金属离子扩散率远高于氧离子时,金属的化学势分布受到恒定金属离子通量的约束。由于二元金属氧化物中元素的化学势互相关联,氧的化学势分布由金属离子的化学势分布决定。氧的化学势梯度驱动氧离子的扩散,氧离子通量随位置不同而变,取决于不同位置的化学势梯度和扩散率。通量发散的地方表示贫氧或富氧,分别对应空洞和新的氧化物。
3.3 保护性氧化膜的破坏机制
保护性的氧化膜一旦被破坏,蒸汽氧化速率会加快,氧化膜不断增厚,当氧化膜达到一定厚度时就会发生氧化膜的剥落,本文重点探讨保护性氧化膜的破坏机制。
高温下氧化铬在含氧和水的气氛中会转变为气态Cr化合物挥发,挥发性物质的生成见反应式(3)~式(5)。
(3)
CrO2(OH)2(g)
(4)
CrO2(OH)(g)
(5)
在900 ℃以下温度范围,CrO2(OH)2被认为是最主要的Cr挥发物。在高温水蒸气环境中,合金表面形成的Cr2O3氧化膜与氧和水蒸气反应生成CrO2(OH)2,其中氧来源于水蒸气分解。
反应(4)的平衡常数k为:
k=p[CrO2(OH)2]/[p(O2)3/4·p(H2O)]
(6)
式中:p(·)为某种物质的分压。
标准反应吉布斯自由能ΔG0为:
ΔG0=53 500+45.5T
(7)
水的平衡分解式为:
H2O=H2(g)+1/2O2(g)
(8)
由式(6)、式(7)和式(8)可得反应(8)的平衡常数k8为:
k8=p(H2)·p(O2)1/2/p(H2O)
(9)
系统中O2分压与系统总压p的关系见式(10)。
p(O2)=(k8/2)2/3/p2/3
(10)
由式(9)和式(10)可得到CrO2(OH)2的分压与体系总压力p和温度的关系,见式(11)和图11。

图11 CrO2(OH)2的分压与温度的关系
(11)
由图11可以看出,随着蒸汽温度的升高,CrO2(OH)2的分压升高,Cr越容易挥发,保护性氧化膜越容易被破坏,同理,随着蒸汽压力的升高,Cr也越容易挥发。因此,应该严格控制材料的基于蒸汽氧化性能的使用温度上限。Helcome等计算了Cr的反应挥发速率,对于汽轮机叶片在760 ℃/34.5 MPa蒸汽中的氧化,CrO2(OH)2的挥发速率为5.18×10-8kg/(m2·s),相当于Cr以每年0.080 mm的速率损失。Asteman等[15-16]通过对304L和310不锈钢在O2/H2O气氛中氧化行为的研究,认为Cr的挥发造成富Cr氧化物保护膜破坏和失稳氧化。高温高压蒸汽下Cr的挥发是影响保护性氧化膜稳定性的主要因素,值得重点关注。
4 结 论
(1) 氧化到2 000 h,结合质量增重和氧化膜厚度数据判断 G115钢的抗蒸汽氧化性能优于T92钢。
(2) G115钢和T92钢生成的氧化膜大致分为氧化膜外层、氧化膜内层和内氧化区,其中氧化膜外层为粗大的柱状晶,主要为Fe3O4;氧化膜内层晶粒细小,由Fe-Cr尖晶石型氧化物和少量的Fe3O4组成,内氧化区氧化物的物相结构与氧化膜内层无明显差异,只是含铁量更高,一般认为由FeO+Cr2O3组成。
(3) G115钢和T92钢氧化到2 000 h,氧化膜外层中的孔洞增多,氧化膜中产生了贯穿性裂纹等缺陷,氧化膜的剥落倾向增大。

