弱精子症和非梗阻性无精子症患者精浆中miR-106b-5p和miR-202-3p的表达检测及临床价值
丁宁,赵铭佳,张瑶楠,韩宝生,刘美玲*
(1.国家卫生健康委科学技术研究所 男性生殖健康重点实验室,北京 100081;2.唐山市妇幼保健院生殖遗传科,唐山 063000;3.北京协和医学院研究生院,北京 100730)
不孕不育症是全球性的公共卫生问题,在育龄人群中的发病率约为15%,在所有不孕不育因素中男性因素约占50%[1]。男性不育症有很多分类,根据病因主要分为:(1)下丘脑垂体功能障碍;(2)睾丸因素;(3)导管阻塞;(4)难以分类的一些其他因素。无精子症是男性不育中最为严重的一种,根据有无梗阻,主要分为梗阻性无精子症(OA)和非梗阻性无精子症(NOA)。NOA的发生机制尚不明确,约10%的不育男性和近60%的无精子患者为NOA[2]。弱精子症是男性不育症的另一常见原因。弱精子症定义为精子浓度>15×106/ml而精子前向运动(PR)<32%,这阻碍了精子运动和穿透卵母细胞,影响受精,最终导致不育。目前,男性不育的诊断主要依据WHO推荐的精液参数和睾丸活检诊断,但这些指标的敏感性和特异性均不十分理想,活检取材有一定的侵入性,因此探讨男性不育的发病机制和发现潜在的无创性分子诊断标志物具有重要的临床意义。
微小RNAs(miRNAs)是长度为19~25 nt的非编码RNAs,通过与靶基因mRNA的3′UTR非翻译区结合,使靶基因mRNA被降解或翻译过程被抑制[3-4],继而在转录后水平上发挥调节作用。miRNAs参与多种生命活动,其在哺乳动物精子发生过程中也起着重要作用。研究发现,睾丸中存在高丰度miRNAs,在精子发生和成熟的各个阶段均起着重要的调控作用,并且miRNAs的表达或功能异常与男性不育相关[5-6]。文献报道,miR-106b可能参与生殖细胞分化及减数分裂后雄性生殖细胞功能发育及成熟[3]。与正常男性相比,少精子症和弱精子症患者精子的miRNA表达谱存在多个差异表达的miRNAs[7]。本课题组前期研究结果提示,miR-106b-5p具有抑制生精细胞凋亡、促进生精细胞增殖的作用[8]。另有研究发现,miR-202-3p在小鼠睾丸中呈现组织特异性表达,尤其在A型精原细胞中的表达量远远高于在粗线期精母细胞和圆形精子细胞,且miR-202-3p在精子发生过程中对精原干细胞维持和自我更新有重要作用[8-9,10]。此外,本课题组利用 Illumina HiSeq X10高通量测序分析NOA患者精浆miRNAs表达谱发现,NOA患者精浆miR-106b-5p和miR-202-3p与正常生育者比较有显著差异[11]。因此,为了研究精浆miR-106b-5p和miR-202-3p是否对男性不育具有诊断价值,本研究拟采用实时定量PCR(qRT-PCR)检测精液参数正常男性、NOA患者和弱精子症患者精浆中miR-106b-5p和miR-202-3p的表达情况,并绘制受试者工作特征曲线(ROC),初步探讨miR-106b-5p和miR-202-3p对NOA的诊断价值。
资料与方法
一、研究对象
选取2018年12月至2020年10月于唐山市妇幼保健院就诊的男性不育症患者和精液参数正常的志愿者为研究对象。
纳入标准:(1)年龄23~44岁;(2)依照WHO诊断标准[12]确诊为NOA或弱精子症;(3)有详细的病史采集和生殖专科检查;(4)正常生育男性为男性生殖专科检查正常且近3年育有健康后代的男性。
排除标准:(1)存在引起男性不育的其他因素如隐睾、尿道下裂、精索静脉曲张、染色体异常、性腺发育不全等;(2)采样期间服用过药物、酗酒、吸烟等。
共纳入317例研究对象。根据精液检查参数和临床资料不同分为3组:精子浓度>15×106/ml且PR<32%的患者为弱精子症组(n=106),NOA症患者为NOA组(n=92),同期精液检查参数正常男性为对照组(n=119)。本研究通过国家卫生健康委科学技术研究所及唐山市妇幼保健院伦理委员会批准,所有受试者均自愿签署知情同意书。
二、研究方法
1.样品采集:所有受试者均禁欲3~5 d,手淫法取精,留于无菌的取精杯中,37℃温育 30 min,液化后于唐山市妇幼保健院实验室进行精液常规检查。精液1 500g离心10~15 min去除精子细胞,取上清以11 000 g离心5 min得到精浆,-80℃保存备用。
2.qRT-PCR检测:采用改良精浆提取法提取各组精浆miRNA[13]。用特异性茎环引物进行反转录,合成cDNA,加入SYBR Premix ExTaq(Takara,日本),进行qRT-PCR反应。反应条件:95℃ 0.5 min;95℃ 15 s,60℃ 1 min,共40个循环。每个样本设3个复孔,以DEPC处理的ddH2O作为阴性对照,以U6为内参,miR-106b-5p、miR-202-3p及内参U6的引物均购自苏州吉玛有限公司,各引物扩增序列见表1。
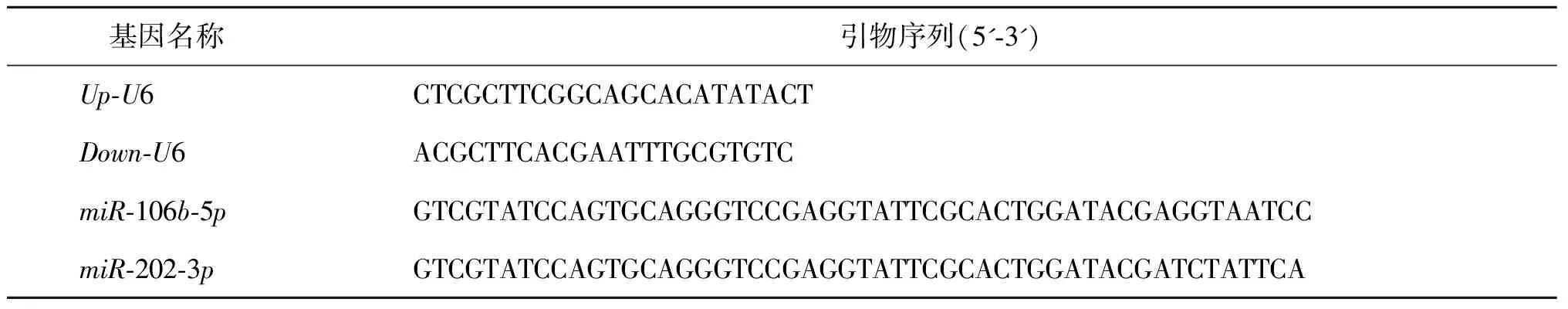
表1 qRT-PCR引物扩增序列
三、统计学分析
结 果
一、研究对象的一般资料比较
3组研究对象的平均年龄及体质量指数(BMI)差异均无统计学意义(P>0.05);NOA组与弱精子症组患者的不育年限比较亦无显著性差异(P>0.05)(表2)。
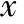
表2 研究对象的一般资料比较(-±s)
二、3组研究对象精浆中miR-106b-5p和miR-202-3p的表达水平
qRT-PCR检测结果显示,NOA组miR-106b-5p的表达水平显著低于对照组及弱精子症组(P<0.05),弱精子症组miR-106b-5p的表达水平略高于对照组,但差异尚无统计学意义(P>0.05);NOA组miR-202-3p的表达水平亦显著低于对照组及弱精子症组(P<0.05),弱精子症组miR-202-3p的表达水平略低于对照组,但差异尚无统计学意义(P>0.05)(图1)。
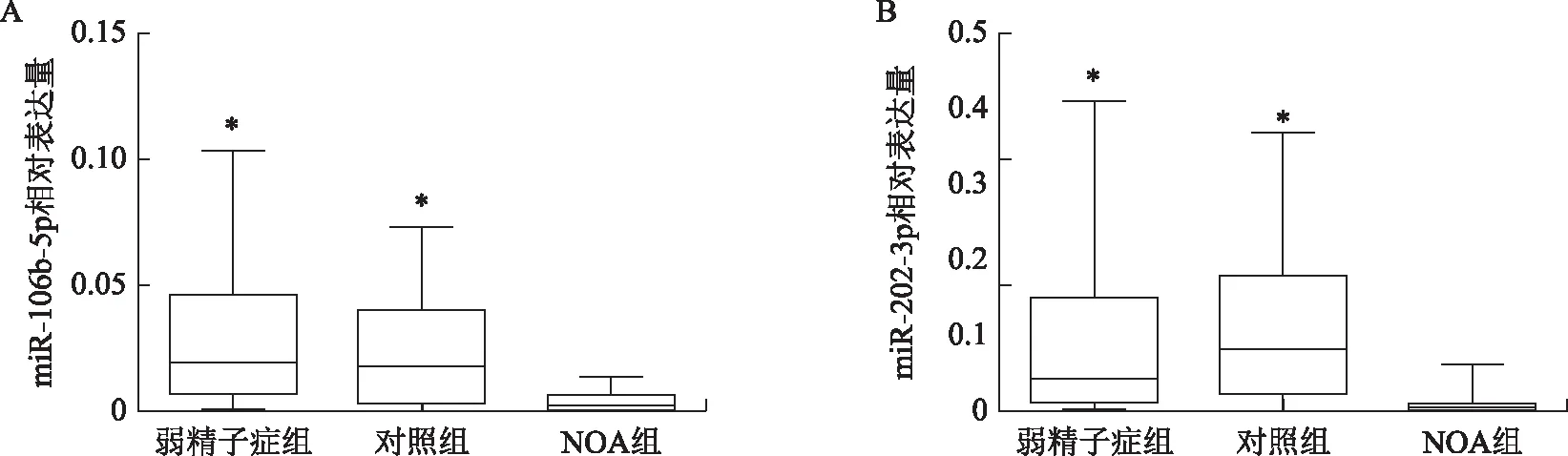
A:miR-106b-5p的相对表达量比较;B:miR-202-3p的相对表达量比较。注:与NOA组比较,*P<0.05。图1 qRT-PCR检测精浆miR-106b-5p和miR-202-3p的表达情况
三、精浆miR-106b-5p和miR-202-3p对NOA的诊断价值
由前述可知,精浆miR-106b-5p和miR-202-3p在NOA组的表达水平存在显著差异,推测二者可能对NOA有一定的诊断价值。绘制ROC曲线进行分析后结果显示,miR-106b-5p的AUC为0.750[95%CI(0.665,0.835),P<0.000 1];miR-202-3p的AUC为0.873[95%CI(0.810,0.936),P<0.000 1];miR-106b-5p诊断NOA的灵敏度和特异度分别为72.1%和61.2%,miR-202-3p诊断NOA的灵敏度和特异度分别为88.6%和82.9%(图2,表3)。
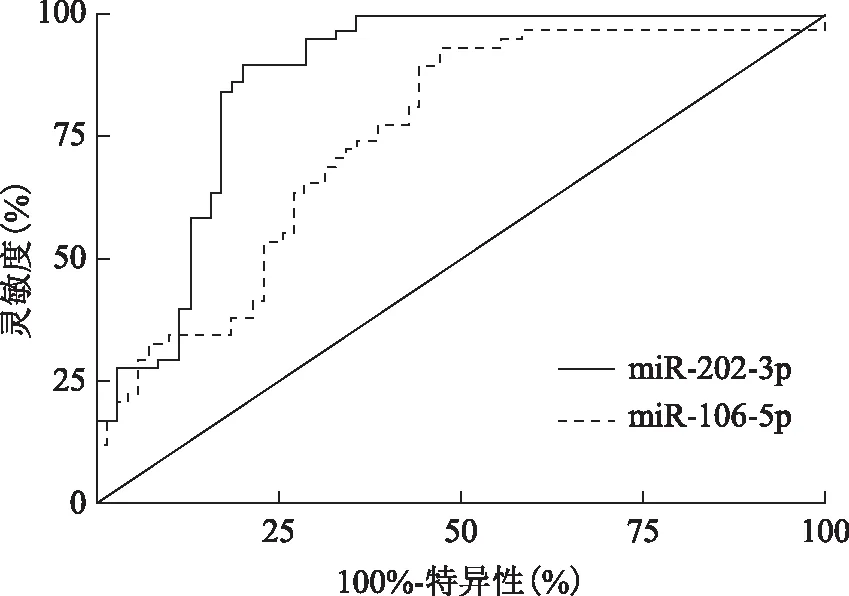
图2 ROC曲线分析
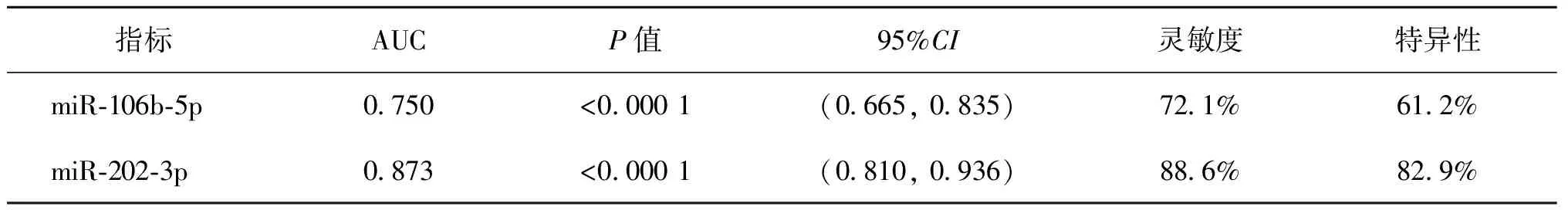
表3 精浆miR-106b-5p和miR-202-3p诊断NOA的灵敏度和特异性
讨 论
男性不育作为困扰许多育龄夫妇的难题,给患者带来巨大心理压力,且男性不育已成为一个严重的健康问题[1]。无精子症是男性不育中最为严重的类型,其中NOA的发病机制相对复杂,且大部分NOA患者病因及发病机制尚不明确,临床上称之为特发性无精子症[12]。弱精子症是男性不育症的另一常见原因,其由于精子的运动性差或活力低,阻碍了精子运动和穿透卵母细胞,最终导致不育。目前,睾丸活检病理学诊断是明确睾丸生精功能的“金标准”,但这些诊断程序伴有一定的侵袭性并可能引起一些并发症。因此,研究男性不育的病因及致病机理,寻求潜在的无创性分子标志物成为临床研究的主要挑战。
精浆miRNAs含量丰富,来源于生殖系统中不同组织及细胞,具有一定的特异性,其通过与蛋白相结合保持性质的相对稳定,因此,选择miRNAs作为诊断男性不育的无创性分子靶标,具有很好的优势及前景。精子在睾丸中产生,从精原干细胞(SSCs)经过有丝分裂、减数分裂直到形成成熟精子,这一复杂过程除了受激素和转录因子的调控,非编码RNA(ncRNAs)也在精子发生中发挥作用,其中miRNAs是人类和动物睾丸发育及精子发生过程中的关键介质[14-16]。有研究发现,条件性敲除小鼠睾丸生精细胞中的Drosha和Dicer后,小鼠表现为少精子或无精子症,提示miRNAs参与调节精子发生[16]。还有研究发现,与正常男性精子的miRNA谱相比,弱精子症患者有27种miRNAs表达下调,50种miRNAs表达上调;少精子症患者有44种miRNA表达下调,42种miRNAs表达上调[17]。Abu-Halima等[18]研究发现,生精障碍(低生育力和NOA)患者精浆hsa-miR-34b、hsa-miR-34c-5p和hsa-miR-122与男性不育显著相关。卢新喆等[19]研究发现,复方玄驹联胶囊联合常规西医治疗弱精子症,通过调节精浆miR-106b、抗苗勒管激素(AMH)水平,能有效增强精子活力,提高精子顶体完整率,疗效较好。吴彩云等[20]利用Solexa测序技术分别检测弱精子症、NOA患者和正常生育男性的精浆miRNAs表达发现,弱精子症组精浆miR-106b表达水平显著高于正常生育组,而NOA组miR-106b表达水平显著低于正常生育组(P<0.05)。本研究结果显示,NOA组精浆miR-106b-5p的表达水平显著低于对照组和弱精子症组(P<0.05),弱精子症组精浆miR-106b-5p表达水平略高于对照组,但无显著性差异(P>0.05);与吴彩云等[20]的研究结果不完全一致,这可能与纳入病例间的个体差异有关,今后需进一步扩大样本量进行验证。miR-202-3p位于10q26染色体易碎位点,其调控多种肿瘤细胞的增殖、侵袭和凋亡,如胃癌、乳腺癌、宫颈磷状细胞癌、结直肠癌等[21]。有报道显示,miR-202-3p在成年男性睾丸组织中高表达[11],在精子发生过程中发挥着重要的生理功能[9]。此外,在男性生殖系统中,miR-202-3p通过抑制细胞周期因子和RNA结合蛋白来维持小鼠SSCs[21]。本研究结果发现,NOA组患者miR-202-3p的表达水平显著低于对照组和弱精子症组(P<0.05),而弱精子症组miR-202-3p的表达水平与对照组比较无显著性差异(P>0.05)。有研究表明,精浆中miRNAs主要来源于精子细胞的释放[20],这或许可以解释本研究中NOA患者精浆中miR-106b-5p和miR-202-3p含量均显著降低,而弱精子症患者精浆中miR-106b-5p和miR-202-3p表达量却无显著变化的现象。
为了探讨精浆miR-106b-5p和miR-202-3p对NOA的诊断价值,进一步绘制ROC曲线显示,miR-106b-5p和miR-202-3p的ROC-AUC分别为0.750和0.873,二者的ROC-AUC均大于0.7,提示精浆miR-106b-5p和miR-202-3p对NOA的诊断价值较好。
本研究纳入的病例数较少,今后应扩大样本量进一步验证本研究结果的可靠性。其次,应进一步深入研究miR-106b-5p和miR-202-3p在精子发生过程中的具体分子调控机制,以期为无精子症的诊断和治疗提供理论参考。
综上所述,不同类型的不育症患者精浆中miR-106b-5p和miR-202-3p表达具有显著差异,且ROC曲线结果显示,精浆miR-106b-5p和miR-202-3p有望成为无创性NOA临床诊断的标志物,但尚需扩大样本量进一步验证本结论。miRNAs在精子发生中起到重要的调控作用,可以为不孕不育的研究和治疗提供崭新的思路;另外,对一些在睾丸组织中特异性表达的miRNAs及其作用机制进行深入研究,可以为避孕研究提供生物学基础。目前,对于miRNAs在男性生殖健康领域中的调控机制仍然有很多未解之谜,但是随着研究的不断展开深入,miRNAs可能成为男性生殖系统疾病诊断和预后分析的新的生物学标志物。

