利用含锰硅胶低温制备钾水玻璃
张 吉,宁延生,郭西凤,朱建平,王 阔
[1.河北省无机精细氟化工技术创新中心(筹),河北承德 067500;2.承德莹科精细化工股份有限公司]
工业上副产硅胶种类较多,由于其夹带杂质问题,综合利用较为困难。多以铺路、掩埋处理为主,不仅浪费资源,更会污染环境。对于工业副产硅胶[1]的综合利用科研工作者们做了大量的工作。宁延生[2]、吴立群等[3],以磷肥副产含氟硅胶为原料,通过湿法制备水玻璃溶液,进而以水玻璃溶液制备合格白炭黑。明大增等[4]将中性含氟硅胶制备成钠水玻璃后,通过外加偏硅酸钠晶种得到五水偏硅酸钠。白瑞瑜等[5]将含氟硅胶与氟化铵反应生成氟硅酸铵溶液,进一步使用氨气分三段氨化、沉淀得到白炭黑成品。韩建军等[6]以磷肥行业副产的氟硅酸钠、碳酸氢铵以及中间产品碳酸氢钠为原料,采用氟硅酸钠法制备无夹晶、质量高可满足绿色轮胎行业需求的白炭黑产品。工业副产的含锰氟硅酸盐,在通过碱解分离其中氟资源的同时,也会产生部分活性硅胶,由于其含锰导致使用困难,当下并无含锰硅胶使用的相关报道。
水玻璃又称泡花碱是一种无色或淡黄色的黏稠液体,强碱性[7]。水玻璃多以碱金属的种类分为钠水玻璃(Na2O·nSiO2)和钾水玻璃(K2O·nSiO2)。水玻璃的应用非常广泛,在化工领域多用干法制备水玻璃。但是由于工业副产硅胶结晶度低,多为无定形状态,与高结晶度的石英砂相比具有很好的活性,是一种采用湿法工艺制备水玻璃很好的原材料。工业上副产的含锰硅胶也是活性较高的二氧化硅,锰质量分数为0.5%~4%,可以方便地制备成水玻璃。但是由于硅胶中可溶性+2、+3 价锰离子的存在,会导致水玻璃溶液呈红褐色,无法正常使用。通常工业上采用氧化法除锰,通过外加氧化剂使锰离子氧化为二氧化锰进而分离[8-9],但是水相条件下氧化法生成的二氧化锰粒径小,固液分离困难。所以,将锰离子氧化成二氧化锰的同时,使二氧化锰粒子长大,并使其快速分离是工业副产含锰硅胶利用的难题,也是实验攻关的关键。国内外并无含锰硅胶制备合格水玻璃溶液的相关报道。
含锰硅胶属于锰相关行业副产物,由于存在于固相中,相比液相除锰难度较大,且由于硅胶价值原因,限制了除锰成本不宜过高,所以对于此类硅胶多采取掩埋处理。常规以含锰硅胶制备钾水玻璃溶液过程中,会产生大量粒径在5 μm 以下的氧化锰粒子,在产业化过程中过滤困难,使水玻璃溶液呈褐色无法正常使用。本文首次采用热活化-氧化法,实现了固相含锰硅胶转化为液相水玻璃溶液,并同时去除其中杂质锰离子。本路线以溶解热、反应热完成含锰硅胶制成钾水玻璃反应,并通过热活化法使锰离子在硅胶中形成部分氧化锰晶种,进一步在水相中通过氧化剂氧化,使氧化锰晶种长大为易过滤尺寸的MnOx。实现了夹带锰与水玻璃溶液的快速分离,解决了副产含锰硅胶利用的难题。
1 原理与实验步骤
1.1 实验原理
热活化-氧化法如图1所示。由图1可见,将含锰硅胶在100 ℃下活化2 h,使滤饼中部分锰离子在高温作用下发生氧化,按反应方程(1)生成MnOx晶种。然后将得到的活化硅胶与工业氢氧化钾溶液、水按比例混匀制备钾水玻璃溶液,见反应(2)。反应过程加入一定量过氧化氢溶液,使液相中的Mnx+及MnOx粒子氧化,成长为大颗粒的MnOx,见反应(3)。
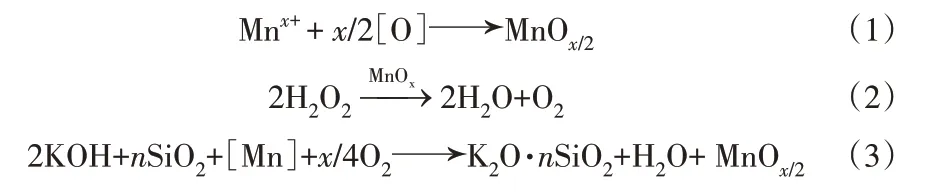
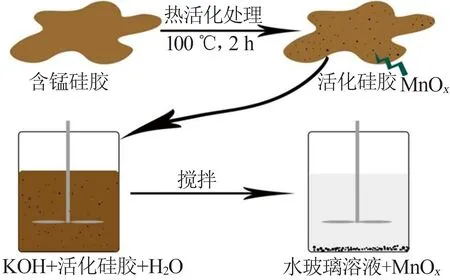
图1 含锰硅胶制备钾水玻璃溶液原理图Fig.1 Schematic diagram of potassium water glass solution prepared by manganese-containing silica gel
热活化-氧化反应在较低温度下靠自身产热完成:1)氢氧化钾溶液稀释过程放出大量热量;2)过氧化氢溶液在MnOx的催化作用下分解为氧气,放出大量热量;3)在混合溶液中,由过氧化氢分解生成的氧气与液相中的Mnx+及MnOx粒子发生氧化反应放出热量[10],加之活化硅胶具有一定活性,使反应(3)能在较低的温度下不用外加热,制备出钾水玻璃溶液。同时通过调整钾水玻璃溶液的硅钾比找到分离MnOx的最佳条件,控制过氧化氢的投料速度,使液相中的Mnx+及MnOx粒子发生氧化[11]的同时,促进MnOx晶种的生长[12-13],在MnOx晶种外围生长到工业中易于过滤分离的尺寸,实现钾水玻璃溶液与MnOx的高效快速分离。
1.2 实验步骤
1.2.1 实验试剂
工业复产含锰硅胶(锰质量分数<10%,含水质量分数<20%),工业过氧化氢(质量分数为23%),工业KOH 溶液(质量分数为48%),去离子水,工业盐酸(质量分数为36%)。
1.2.2 探索实验
自然氧化法:正常情况下将含锰硅胶与氢氧化钾于100 ℃下反应可得到褐色钾水玻璃溶液,通过空气氧化法自然静置氧化8~15 d,得到澄清透明钾水玻璃溶液。但是工业上没有可操作性。
酸洗法:对于副产含锰硅胶的处理,笔者将含锰硅胶与工业盐酸按照质量比1∶(2.5~4)在70 ℃下酸洗2 h,过滤得到不含锰硅胶。但是洗涤滤饼产生含盐酸的废水处理难度大,工业上也无法采用。
1.2.3 热活化-氧化法对钾水玻璃溶液除锰实验
向反应器中加入KOH 溶液(48%,质量分数)、去离子水,分别加入含锰硅胶100 g与热活化过的含锰硅胶83 g(100 g 含锰硅胶在100 ℃下热活化处理2 h 得83 g)。将混合物搅拌10 min 成浆,加入一定量工业过氧化氢(23%,质量分数)溶液,投料完成后继续搅拌100 min。减压抽滤后得到钾水玻璃溶液,滤饼洗涤后得到MnOx固体。通过实验验证了热活化后的硅胶加入工业过氧化氢(23%)对产物的影响,进而确定钾水玻璃除锰的最佳反应条件,具体投料参数如表1所示。
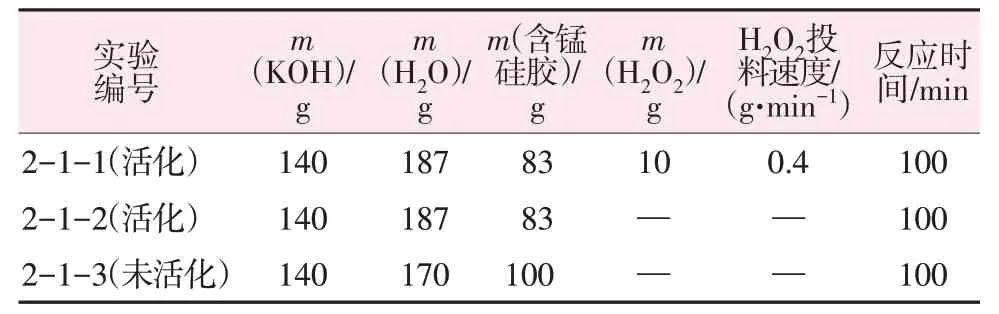
表1 热活化含锰硅胶、氧化剂的使用对钾水玻璃除锰的影响实验投料数据Table 1 Experimental feeding data of effect of thermally activated manganese containing silica gel and oxidant on manganese removal by potassium water glass
1.2.4 H2O2投料速度对钾水玻璃溶液除锰的影响
向烧杯中依次加入质量分数为48%KOH 溶液140 g,分别加入去离子水187 g,加入热活化含锰滤饼83 g,用保鲜膜密封;开启搅拌器,150 r/min 下搅拌10 min,控制搅拌速度,匀速缓慢向烧杯中加入工业双氧水10 g,投料速度见表2。投料完成后,继续搅拌至100 min,反应结束后,减压抽滤、收集滤液。
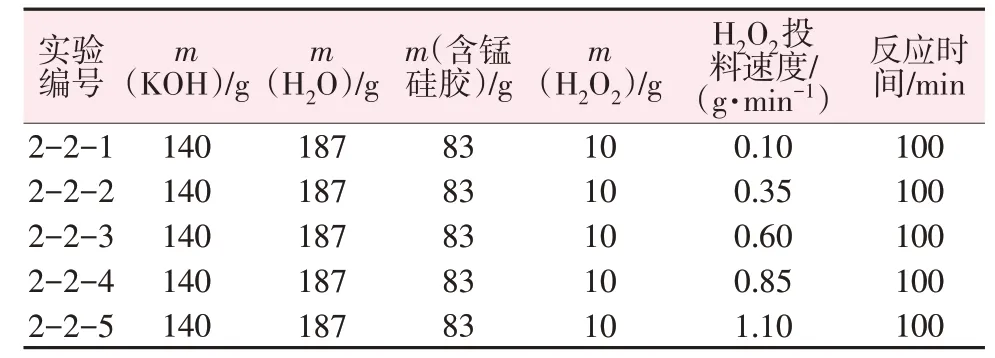
表2 H2O2投料速度对钾水玻璃除锰影响实验投料数据汇总Table 2 Summary of experimental feeding data of effect of H2O2 feeding rate on manganese removal in potassium water glass
1.2.5n(SiO2)/n(K2O)模数对钾水玻璃溶液除锰的影响
向烧杯中依次加入质量分数为48%KOH 溶液140 g,分别加入50、100、150、200、250 g热活化含锰湿滤饼,通过改变去离子水的加入量控制钾水玻璃浓度一定,用保鲜膜密封;开启磁力搅拌器,搅拌10 min,按照0.6 g/min 的速度向烧杯中加入工业双氧水10 g,投料完成后,继续搅拌反应1 h,反应结束后减压抽滤、收集滤液,投料数据如表3。

表3 不同模数下钾水玻璃溶液除锰实验投料数据Table 3 Experimental feeding data of manganese removal of potassium water glass solution under different modulus
理论硅钾比计算公式:
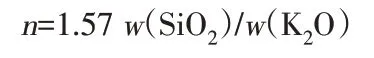
2 讨论与分析
2.1 含锰硅胶热活化-氧化对钾水玻璃除锰影响
热活化含锰硅胶与氧化剂的使用对钾水玻璃除锰影响实验数据如表4所示。由表4可见,对比实验2-1-2 与2-1-3 发现,活化硅胶后钾水玻璃溶液除锰率提高33.7%,100 g 钾水玻璃溶液过滤时间缩短33.1 s,这是由于含锰滤饼经热活化处理后,滤饼中锰离子部分氧化为MnOx晶种,使锰离子在制备钾水玻璃过程中在碱性条件下发生氧化,在MnOx晶种表面生长、变大[14-15],成为易过滤尺寸MnOx,提高了过滤速度。而未经过热活化处理的含锰滤饼,在制备钾水玻璃过程中锰离子发生氧化反应生成MnOx,由于没有晶种的存在,生长出大量MnOx粒子,这种粒子粒径小,过滤时存在穿滤,且易堵塞滤纸,钾水玻璃溶液呈黄色,除锰效果差。钾水玻璃样品经过量酸处理后,将钾水玻璃溶液中穿滤的MnOx溶解为锰离子,检测后发现实验2-1-3 钾水玻璃溶液中锰质量分数为3.648 8×10-3。2-1-2 对比2-1-3 实验,硅胶活化后,除锰率提高33.7%;进一步加入氧化剂过氧化氢后,在反应热、溶解热、过氧根的共同作用下,氧化速度明显提高,2-1-1 实验除锰率高达98.3%。所以,热活化处理含锰硅胶、外加氧化剂可在快速过滤的同时提高除锰率。
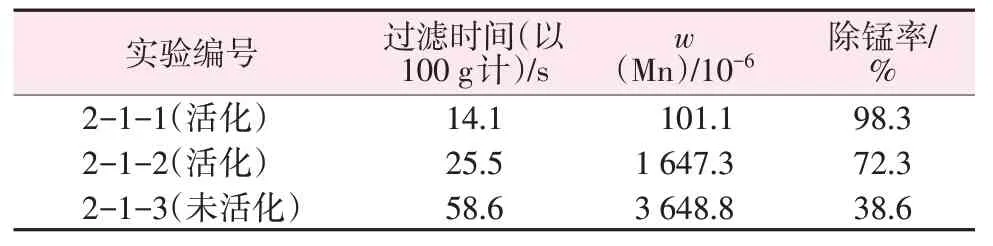
表4 热活化含锰硅胶与氧化剂的使用对钾水玻璃除锰的影响实验数据Table 4 Experimental data of effect of thermally activated man-ganese-containing silica gel and oxidant on manganese removal by potassium water glass
2.2 H2O2投料速度对钾水玻璃除锰影响
H2O2投料速度对钾水玻璃除锰影响实验投料数据如表5所示。观察表5发现随着过氧化氢投料速度的增加,过滤时间先缩短后提高,对应的除锰率呈现先提高后降低趋势。这是由于当过氧化氢投料速度过慢时,氧化速度较慢导致反应热利用率低,液相体系中生成的MnOx一部分缓慢地生长在MnOx晶种外围;由于溶液体系温度较低,降低了碱性条件下溶液的氧化能力,另一部分生成新的氧化锰微粒,无法通过过滤实现固液分离,导致钾水玻璃溶液中存在MnOx微粒,溶液呈淡黄色。而当过氧化氢投料速度过快时,溶液体系温度随之升高,一方面由于其中MnOx的存在,加快了过氧化氢分解速度,导致过氧化氢利用率低,溶液中存在未被氧化的锰离子,除锰困难;另一方面短时间内体系内氧化剂的大量存在,MnOx生成速度快,无法均匀地成长在晶种MnOx外围,而是以更多的MnOx微粒的形式出现,导致一部分中等粒径的MnOx堵塞滤纸,增加过滤时间,一部分微小粒径的MnOx穿滤进入钾水玻璃溶液,导致钾水玻璃溶液着色,且不易分离含锰杂质。所以,含锰滤饼制备钾水玻璃溶液过程中,除锰的最佳过氧化氢投料速度为0.6 g/min。
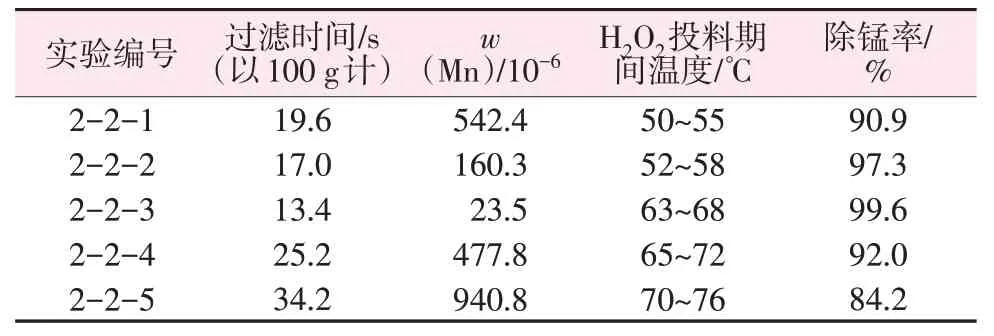
表5 H2O2投料速度对钾水玻璃除锰影响实验数据Table 5 Experimental data of H2O2 feeding rate on manganese removal from potassium water glass
2.3 n(SiO2)/n(K2O)对钾水玻璃溶液除锰影响
不同硅钾比下,钾水玻璃溶液除锰实验数据如表6所示。观察表6发现,控制钾水玻璃质量分数为24%,随着滤饼投料量的增加,钾水玻璃硅钾比不断提高,过滤时间不断延长,除锰率呈下降趋势。这是由于,随着钾水玻璃硅钾比的提高,钾水玻璃流动性降低,黏度提高,不利于溶液中锰离子的分散与MnOx晶种微粒的生长,导致氧化生成了大量MnOx微粒,钾水玻璃溶液除锰困难。所以,钾水玻璃溶液除锰的最佳硅钾比<1.19。

表6 不同硅钾比下钾水玻璃溶液除锰实验数据Table 6 Experimental data of manganese removal of potassium water glass solution under different n(SiO2)/n(K2O)
2.4 滤渣物相分析
利用D8 ADVANCE 型X 射线衍射仪对钾水玻璃溶液过滤得到产物的物相进行分析检测,XRD谱图如图2 所示。使用X'pert High Score Plus 与Gen-eral Structure Analysis System(GSAS)软件对产物MnOx相组成进行分析,发现MnOx的主要成分为立方相的MnO2(PDF 00-042-1169)与单斜相的Mn5O8(PDF 01-072-1427)。

图2 MnOx的XRD谱图Fig.2 XRD patterns of MnOx
通过GSAS(General structure analysis system)软件对其相含量进行计算,发现其中MnO2质量分数为76.3%,Mn5O8质量分数为23.7%。这说明,通过热活化-氧化法得到的水玻璃溶液滤渣中基本不存在未反应二氧化硅,氢氧化钾与硅胶反应充分;同时,滤渣主要成分是MnO2及质量分数为23.7%的Mn5O8,这是由于过氧化氢在液相中分解过快,产生的氧气无法充分与Mn5O8反应,导致部分锰以Mn5O8的形式存在。但这对分离钾水玻璃溶液中的锰并无影响,通过热活化-氧化法在制备钾水玻璃过程中除锰,使活化硅胶中MnOx粒子在液相中进一步增大,粒子结晶度较高(XRD谱图中主峰都很尖锐),使MnOx实现快速分离,达到水玻璃溶液除锰的目的。
3 结论
本文通过控制变量法确立最佳含锰硅胶除锰条件为:100 ℃热活化处理含锰硅胶2 h 后,控制过氧化氢加入速度为0.6 g/min,当钾水玻璃硅钾比<1.19时,能得到除锰率>99%以上的、澄清透明的钾水玻璃溶液。相对于传统的制备水玻璃的方法,本法在含锰硅胶制备钾水玻璃溶液过程中无需外界提供能量,反应过程体系温度基本维持在63~68 ℃,大大降低了反应的成本,为副产硅胶提出了一种新的解决思路,有望在行业内推广使用。