磷、铁胁迫对棘孢木霉根际定殖的影响
赵 微,崔 璇,赵 蕾
(山东师范大学 生命科学学院,济南 250014)
磷是满足植物生长发育所必需的大量元素之一,通常以正磷酸盐的形式吸收,构成核酸、生物膜等物质,参与多种重要的生化反应,但由于磷在土壤中的有效性低,易通过离子交换吸附、配位吸附和化学反应固定等方式被土壤转化为无效态磷[1],导致世界性耕地普遍面临着缺磷问题,而铁作为保证机体生物氧化还原活动正常进行的重要微量元素,组成多种酶类和电子传递蛋白,但铁常以难溶或微溶性化合物形式存在于土壤中,从而造成植物的铁营养缺乏[2]。
木霉菌(Trichodermasp.)是一类广泛存在于土壤中的植物根际有益真菌,可通过产生酸性磷酸酶、有机酸等溶磷作用[3-5]以及缺铁条件下产生嗜铁素[6-7]等促进植物对磷和铁等元素的吸收利用。木霉菌在植物根际的有效定殖是其促进植物根系生长和营养吸收的必要条件,而土壤胁迫因子如缺磷、缺铁对木霉菌在植物根际定殖的影响尚不明确。
有研究表明,多种病原菌对植物的侵染与嗜铁素有关[8],如食源性致病菌沙门氏菌(Salmonellaenterica)侵染植物与嗜铁素的生物合成有关[9],引起植物叶斑病的病原菌链格孢菌(Alternariaalternata)嗜铁素合成相关基因AaNPS6敲除后对柑桔的致病性降低[10],说明胞外嗜铁素不仅与病原菌的铁吸收有关,还参与菌体对植物的侵染过程。而木霉菌在植物根部的定殖也与某些因素有关,如纤维素膨胀因子合成相关基因swollenin过度表达能促进里氏木霉菌(Trichodermareesei)在黄瓜根系的定殖[11],但木霉菌产生的嗜铁素对菌体在植物根际定殖的影响尚不明确。本试验利用筛选并鉴定的棘孢木霉菌(Trichodermaasperellum)T6以及获得的棘孢木霉菌(T.asperellum)嗜铁素合成相关基因sidA的敲除突变株[12],研究磷、铁胁迫对菌体在拟南芥根部定殖的影响,为进一步完善非生物胁迫下棘孢木霉菌(T.asperellum)对植物的促生机制提供借鉴。
1 材料与方法
1.1 材料与试剂
1.1.1 材 料 棘孢木霉菌(Trichodermaasperellum)T6、棘孢木霉菌(T.asperellum)sidA基因敲除突变株,由山东师范大学微生物学实验室获得并保存;拟南芥(Columbia 生态型),由齐鲁师范学院能源植物研究中心惠赠。
1.1.2 培养基 PDA(Potato dextrose agar):200 g马铃薯,20 g葡萄糖,20 g琼脂,去离子水定容至1 L。
MS(Murashige & Skoog)固体培养基:30 g蔗糖,50 mL MSⅠ储液(6.6 g NaCl,33 g NH4NO3,38 g KNO3,3.4 g KH2PO4,7.4 g MgSO4·7H2O,去离子水定容至1 L),5 mL MSⅡ储液(4.46 g MnSO4·4H2O,1.24 g H3BO3,1.72 g ZnSO4·7H2O,0.166 g KI,0.05 g Na2MoO4·2H2O,0.005 g CuSO4,0.005 g CoCl2·6H2O,去离子水定容至1 L),5 mL MSⅢ储液(5.56 g FeSO4,7.46 g EDTA,去离子水定容至1 L),5 mL MSⅣ储液(20 g肌醇,0.1 g盐酸硫胺素,0.1 g盐酸吡哆醇,0.1 g烟酸,0.4 g甘氨酸,去离子水定容至1 L),20 g琼脂,去离子水定容至1 L,pH调至5.8。
缺磷MS固体培养基:在MS培养基基础上去除KH2PO4。
缺铁MS固体培养基:在MS培养基基础上去除FeSO4。
1/2 MS固体培养基:2.32 g MS培养基干粉,15 g蔗糖,20 g琼脂,去离子水定容至1 L,pH调至6.0。
无磷液体培养基:10 g葡萄糖,0.5 g (NH4)2SO4,0.3 g CaCl2,0.3 g MgSO4·7H2O,0.3 g KCl,0.03 g MnSO4,0.03 g FeSO4·7H2O,0.4 g酵母膏,去离子水定容至1 L,pH调至7.0~7.5。
1.1.3 主要试剂 RNA提取试剂盒、DNA反转录试剂盒购自大连TaKaRa生物科技有限公司;Chrome azurol S(CAS)检测液、透明液,磷酸二氢钾、磷酸二氢钠、利福平等试剂均为国产分析纯。引物合成、序列测定由上海生工生物工程有限公司完成。
1.2 方法
1.2.1 孢子悬液的制备 将棘孢木霉菌(T.asperellum)T6划线接种于PDA平板,28 ℃培养 7 d,待培养基表面被深绿色孢子覆盖,用移液器取5 mL无菌水加入平板中,反复吹打菌落表面,获得高浓度孢子悬液。取1 mL孢子悬液加入盛有30 mL无菌水的锥形瓶中,内含玻璃珠,振荡15 min,获得均匀孢子悬液。用血球计数板计数,孢子终浓度调至1×107CFU/mL。
1.2.2 嗜铁素产量的测定 利用CAS检测法[13]测定嗜铁素含量。取2 mL孢子悬液加入100 mL无磷液体培养基,28 ℃、180 r/min振荡培养5 d。每24 h取样4~6 mL,4 ℃、10 000 r/min离心10 min,取上清液2 mL,加入等体积CAS检测液,充分摇匀后暗处理30 min。测定630 nm处吸光值(As),未接菌对照组的吸光值为参比值(Ar),用去离子水调零。嗜铁素含量计算公式如下:
嗜铁素含量=[(Ar-As)/Ar]×100%
1.2.3 木霉菌生物量的测定 采用细胞干重法[14]测定木霉菌生物量。将棘孢木霉菌(T.asperellum)T6在不同磷浓度的无磷液体培养基中28 ℃、180 r/min振荡培养7 d后,抽滤收集菌丝体,50 ℃烘干至恒质量,称量菌丝干质量。
1.2.4 嗜铁素合成相关基因sidA表达的半定量测定 采用RT-PCR检测磷浓度对sidA基因表达的影响。在不同磷浓度的液体培养基28 ℃、180 r/min振荡培养棘孢木霉菌(T.asperellum)5 d后,将菌液移入100 mL离心管中,离心弃上清,将菌丝沉淀用液氮研磨至粉末状,采用Trizol法提取菌体的总RNA。依据艾德莱生物试剂盒说明书在RNase-free离心管中构建反转录体系,进行反转录得cDNA。以cDNA为模板,以S-RT-F/S-RT-R为引物进行 PCR 扩增(表1)[12]。对PCR产物进行琼脂糖凝胶电泳,观察内参基因(actin)和(sidA)基因的电泳条带亮度,分析不同磷浓度下sidA基因的表达情况。
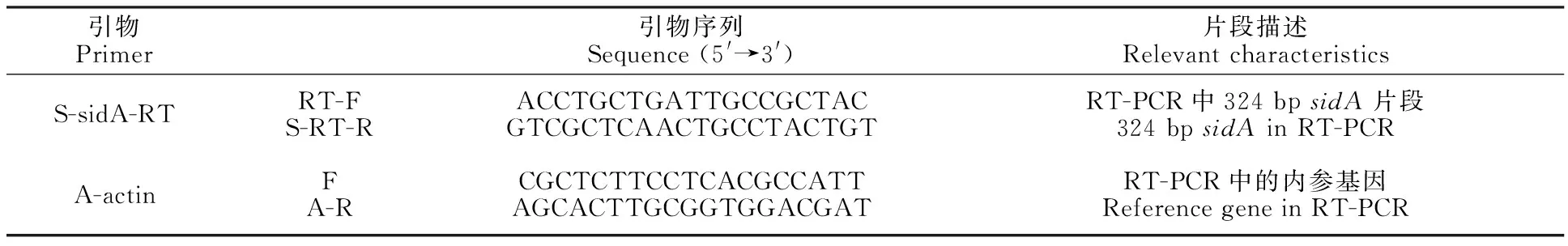
表1 引物序列Table 1 Primers used in this study
1.2.5 木霉菌利福平抗性标记 将棘孢木霉菌(T.asperellum)T6和sidA基因敲除突变株(记为ΔsidA)分别接种于含10 μg/mL利福平的PDA培养基中28 ℃培养2 d。挑取菌落形态与出发菌株相似的单菌落,分别接种于含50 μg/mL、80 μg/mL和100 μg/mL利福平的PDA培养基中培养,直至筛选出能在含200 μg/mL利福平的PDA培养基上稳定生长的棘孢木霉菌 (T.asperellum)T6和ΔsidA作为标记菌株[15]。
1.2.6 标记菌株的定殖检测 将已消毒的拟南芥种子点种于1/2 MS固体培养基中,4 ℃冰箱中春化3 d。随后在光照培养箱中培养3 d,设置 25 ℃、16 h光照、8 h黑暗处理、光照强度为300 μmol/(m2·s)。选取长势相似的拟南芥幼苗转接至不同处理MS固体培养基中培养7 d,接种经筛选得到的标记菌株。
待拟南芥根部被菌丝侵染,将拟南芥放入75%乙醇表面消毒3 min后用无菌水冲洗,取最后一次冲洗液涂布于含200 μg/mL利福平的PDA平板,28 ℃培养2 d,检查根表面的消毒效果。将已消毒的拟南芥根部研磨至糊状,使根组织内的标记菌株释放,取100 μL组织悬液稀释10倍、100倍、1 000倍,涂布于含200 μg/mL利福平的PDA平板上,28 ℃培养2 d后进行平板计数,计算单位为CFU/g[15]。
拟南芥继续光照培养2 d后,将植株浸入透明液,4 ℃保存24 h后在倒置荧光显微镜下观察标记菌株在拟南芥根部的侵染情况。
1.3 数据分析
采用Microsoft Excel 2010和SPSS 19.0软件进行数据处理和方差分析。
2 结果与分析
2.1 磷浓度对嗜铁素产量的影响
将棘孢木霉菌(T.asperellum)T6接种于不同磷浓度的培养基中,每24 h测定发酵液中嗜铁素含量。结果表明,在第5天,无磷和低磷 (1 μmol/L)条件下嗜铁素产量显著高于足磷 (1 mmol/L)浓度,三者嗜铁素含量分别为: 16.41%、16.77%和6.45%;与足磷培养基相比,无磷和低磷培养基中菌体嗜铁素产量分别增加154.42%和160%(图1)。使用独立样本t检验,对不同磷浓度菌丝体干质量进行差异性分析可知,菌丝干质量差异不显著(P>0.05),表明磷浓度对菌体生长量影响不大。由此可见,磷充足时嗜铁素产量较低,而缺磷胁迫则能促进嗜铁素的产生。
2.2 磷浓度对嗜铁素合成相关基因sidA表达的影响
sidA基因表达的半定量测定结果见图2。以内参基因actin作为标准,无磷条件下电泳条带最亮,说明sidA基因表达量最多,磷浓度为 1 μmol/L和1 mmol/L的电泳条带较暗,说明sidA表达量较少。由此在分子水平上证明,缺磷胁迫能促进嗜铁素合成相关基因sidA的表达。
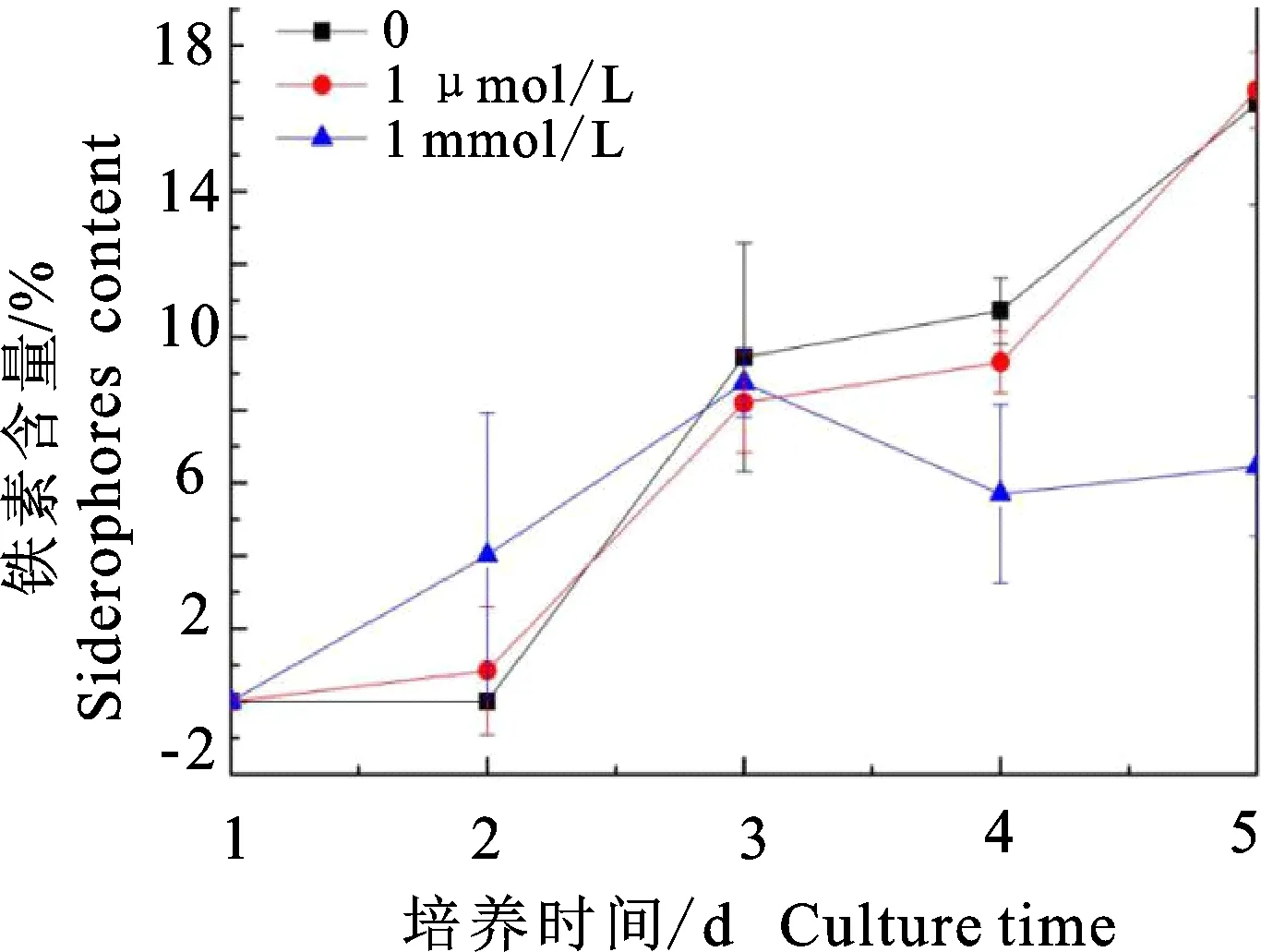
图1 磷浓度(0、1 μmol/L、1 mmol/L)对嗜铁素产量的影响Fig.1 Yield of siderophores under different phosphorus concentrations(0,1 μmol/L,1 mmol/L)
2.3 磷胁迫对棘孢木霉T6和ΔsidA定殖的 影响
在证明拟南芥根部消毒彻底后,采用抗利福平标记法测定磷胁迫对棘孢木霉菌(T.asperellum)T6和ΔsidA定殖的影响,对平板中的菌落进行计数。在缺磷(MS-P)培养基中棘孢木霉菌(T.asperellum)T6的定殖量是含磷(MS)培养基的3倍;而ΔsidA在含磷与缺磷培养基中的定殖量却无显著性差异(P>0.05)(图3-A);并且无磷条件下棘孢木霉菌丝分布较为密集,在拟南芥根尖处常聚集成团;而足磷处理的菌丝在远离根尖处偶有分布(图3-B)。以上结果说明,磷含量充足以及嗜铁素合成相关基因sidA敲除时,由于棘孢木霉菌嗜铁素产量明显减少,菌体的根际定殖能力降低。因此,缺磷胁迫下棘孢木霉菌(T.asperellum)产生的嗜铁素能够促进菌体在植物根际的定殖。

图2 RT-PCR产物电泳图Fig.2 Electrophoresis map for RT-PCR-amplified products
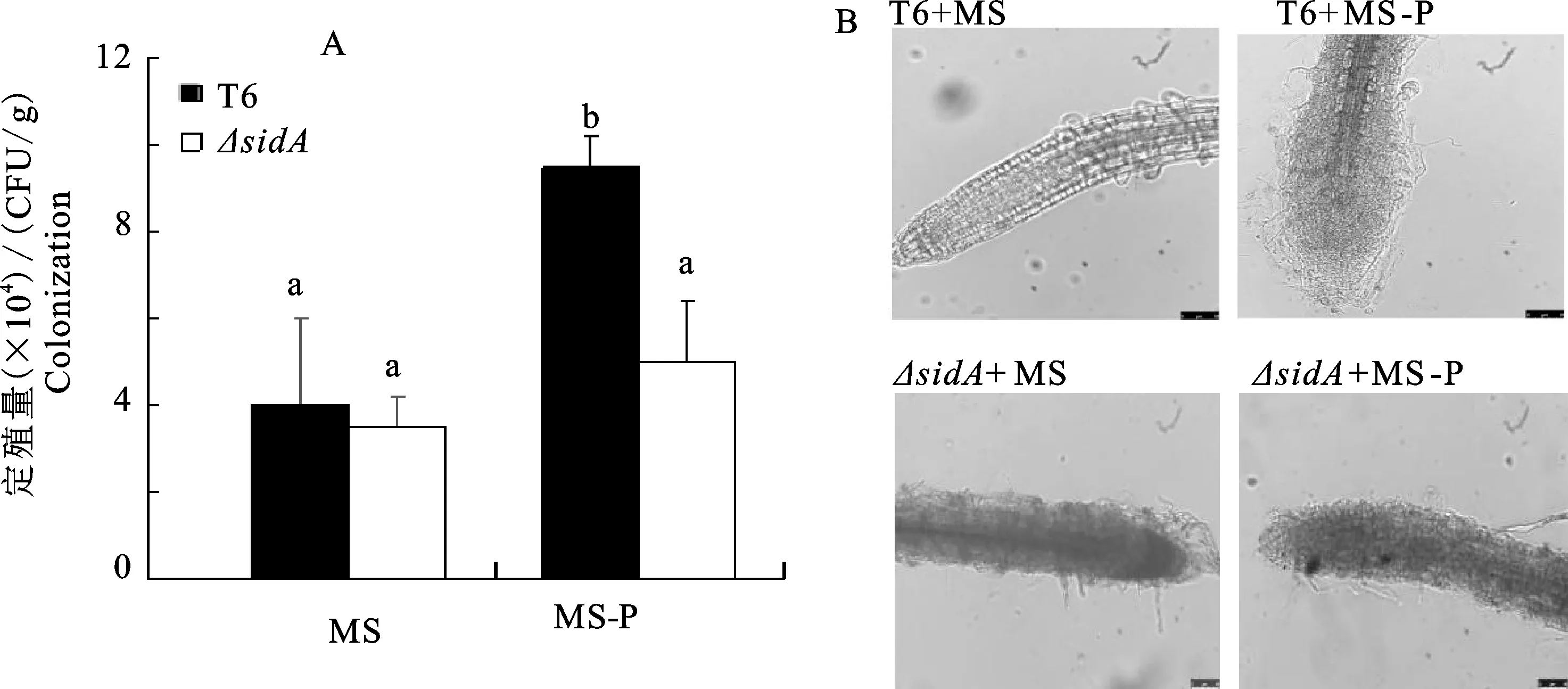
A. 菌体的定殖量; B. 菌体定殖拟南芥根部的显微照片(标尺=10 μm);不同字母表示差异显著(P<0.05),下同
2.4 铁胁迫对棘孢木霉T6和ΔsidA定殖的影响
图4是采用抗利福平标记法测定铁胁迫对棘孢木霉菌(T.asperellum)T6和ΔsidA在拟南芥根部定殖的影响。结果表明,缺铁(MS-Fe)培养基中棘孢木霉菌T6的定殖量是含铁(MS)培养基的2.1倍;且缺铁条件下,棘孢木霉菌T6在拟南芥根部的定殖量显著高于ΔsidA,是突变株的1.9倍(图4-A)。用倒置荧光显微镜对拟南芥根部进行镜检发现,缺铁培养基中棘孢木霉菌丝已侵入拟南芥根部并产生大量孢子;而含铁培养基中菌体在拟南芥根际的定殖密度较低(图4-B)。说明在缺铁条件下,突变株由于嗜铁素合成相关基因sidA的缺失,嗜铁素产量明显减少,减弱棘孢木霉菌(T.asperellum)的根际定殖能力。因此,缺铁胁迫下棘孢木霉菌(T.asperellum)产生的嗜铁素能够促进菌体在植物根际的定殖。
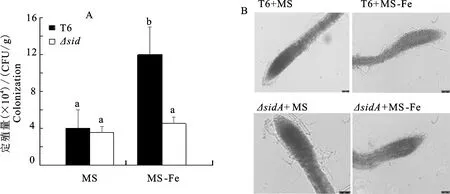
A.菌体的定殖量; B.菌体定殖拟南芥根部的显微照片(标尺=10 μm)
3 讨论与结论
木霉菌是一种应用广泛的植物生防促生真菌,能够通过与植物形成共生体、分泌多种酶类和代谢产物[16]提高植物对生物和非生物胁迫的抗性[17-18]。研究发现,木霉菌在铁胁迫下具有通过非核糖体途径产生一种或几种嗜铁素的能力[19],提高植物对土壤难溶性矿质元素的利用率。山东师范大学微生物学实验室前期研究发现,棘孢木霉菌(T.asperellum)不仅在缺铁胁迫下能够产生特异性螯合Fe3+的嗜铁素,将土壤中难溶性铁转变为可溶性铁[3, 6],还具有根际定殖能力[5]。本研究利用CAS检测法和RT-PCR检测法研究磷浓度对棘孢木霉菌(T.asperellum)嗜铁素产量和嗜铁素合成相关基因sidA表达量的影响,发现磷胁迫同样能够提高菌体嗜铁素产量以及sidA基因表达,具体机制尚待明确,而磷胁迫对菌体嗜铁素合成的影响至今未见报道。
有文献报道,缺磷胁迫能够促进丛枝菌根真菌(AMF)定殖及其与植物根系的相互作用[20-21],而菌体产生的嗜铁素与定殖也有一定的关系,如荧光假单胞菌(Pseudomonasfluorescens)分泌的荧光嗜铁素可显著提高其种子粘附和根际定殖能力[22]。本试验采用抗利福平标记法测定缺磷、含磷以及缺铁、含铁下棘孢木霉菌(T.asperellum)T6和sidA敲除突变株在拟南芥根际的定殖能力,发现棘孢木霉菌丝可以穿透并定殖于植物根表皮和外皮层组织中,且磷、铁胁迫下棘孢木霉菌(T.asperellum)产生的嗜铁素能够促进菌体在植物根际的定殖。
水杨酸(SA)、茉莉酸(JA)和乙烯(ET)介导的信号通路是目前已知的植物调控自身防御反应的3个重要信号通路。研究发现,致病性肠杆菌欧文氏菌(Erwiniasp.)产生的嗜铁素chrysobactin(CB)能够激活水杨酸介导的抗病信号传导途径,抑制PDF1.2(ET/JA pathway)基因表达,提高菌体对拟南芥的侵染能力[23]。此外,木霉菌能够增强WRKY18和WRKY40基因表达,抑制JAZ蛋白激活JA信号途径,并负调控防御基因FMO1、PAD3和CYP71A1表达,通过短暂抑制植物早期防御反应,促进菌体在植物根际定殖[24]。由此推测,可能是由于缺磷、缺铁胁迫下棘孢木霉菌产生的胞外嗜铁素不仅有利于菌体从寄主植物中获得铁营养,还能够对植物防御反应进行调控,从而有益于菌体对植物根系的粘附与定殖。此研究结果为进一步探究非生物胁迫下棘孢木霉菌对植物根际定殖和促生机制奠定了基础。

